外周血嗜酸性粒細胞計數與中老年人冠狀動脈鈣化的關系*
程 序,楊忖卿,石鳳祥,孫 黎,龐 博,谷 春,侯雪筠,費佳欣,劉貴建△
中國中醫科學院廣安門醫院:1.檢驗科;2.放射科,北京 100053
近年來,冠心病的診療技術取得了飛速的發展,然而冠狀動脈粥樣硬化的發病機制仍然是一個值得探究的問題。冠狀動脈鈣化是動脈壁礦物質的病理性沉積過程,使血管壁的彈性和順應性降低,被認為是冠狀動脈粥樣硬化的進展標志[1],并與不良心血管事件有關。許多局部和全身因素參與了冠狀動脈鈣化的過程,包括持續的炎癥、糖尿病、高脂血癥等[2]。冠狀動脈鈣化評分(CACS)可通過使用第二代雙源CT對冠狀動脈鈣化進行無創性評估,是冠狀動脈鈣化的定量、客觀指標,與冠心病的危險因素和心血管事件有關[3]。有報道指出,過敏性鼻炎或哮喘等過敏性疾病與動脈粥樣硬化有關[4]。血嗜酸性粒細胞通過與血小板相互作用,相互激活,促進動脈粥樣硬化斑塊的形成和血栓形成[5],表明外周血嗜酸性粒細胞計數增加可能是冠心病的一個危險因素[6-8]。本研究探討了外周血嗜酸性粒細胞計數與CACS之間的關系。
1 資料與方法
1.1一般資料 選取2021年2-5月就診于本院、年齡>40歲并行CT冠狀動脈造影的患者118例為研究對象,其中男64例、女54例,平均年齡(63.0±10.2)歲。排除其他心臟先天性疾病、瓣膜病、腦梗死急性期、重度神經官能癥等所致胸痛者;排除合并肝、腎、造血系統等嚴重原發性疾病、最近2周內有急性感染者;排除合并其他較嚴重疾病而必須治療者(如血液病、腫瘤等);排除妊娠或哺乳期婦女等不適合參加者。本研究經本院醫學倫理委員會審查通過后進行。
1.2方法 于患者空腹時采集靜脈血,采用全自動血細胞分析儀(日本希森美康株式會社)和全自動生化分析儀(美國貝克曼庫爾特公司)進行檢測。收集患者的一般資料及入院時血常規和生化檢測指標,包括性別、年齡、身高、體質量、吸煙情況、血壓、白細胞計數、嗜酸性粒細胞計數、空腹血糖、總膽固醇、三酰甘油等臨床資料。吸煙被定義為目前的煙草使用情況。高血壓定義為收縮壓≥140 mm Hg、舒張壓≥90 mm Hg。血脂異常定義為總膽固醇水平≥5.7 mmol/L,三酰甘油水平≥1.7 mmol/L。糖尿病定義參照美國最新糖尿病學會標準[9]。根據相關研究將118例患者分為低嗜酸性粒細胞組(嗜酸性粒細胞計數<0.2×109/L)92例和高嗜酸性粒細胞組(嗜酸性粒細胞計數≥0.2×109/L)26例[10-12]。
1.3CACS測定 所有患者均使用西門子第二代雙源CT行冠狀動脈造影檢查,患者取仰臥位,由頭至腳掃描,范圍由氣管分叉下方1 cm達心臟膈面水平。在獲取圖像信息后,在處理工作站進行圖像分析,以獲得左冠狀動脈主干、右冠狀動脈、左前降支、左回旋支等各部位的鈣化積分,并將各部位積分之和計為CACS,根據積分進行定量分析或分層分析。
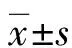
2 結 果
2.1不同臨床特征的嗜酸性粒細胞計數和log(CACS+1)的比較 女性外周血嗜酸性粒細胞計數明顯低于男性(P=0.001),糖尿病患者的外周血嗜酸性粒細胞計數明顯高于非糖尿病患者(P=0.038)。高血壓患者的log(CACS+1)明顯高于無高血壓患者(P=0.036),血脂異常患者log(CACS+1)明顯高于血脂正常患者(P=0.019)。見表1。

表1 不同臨床特征的嗜酸性粒細胞計數和log(CACS+1)的比較[ M(P25,P75)]
2.2低嗜酸性粒細胞組和高嗜酸性粒細胞組log(CACS+1)比較 高嗜酸性粒細胞組的log(CACS+1)為2.24(1.10,2.88),高于低嗜酸性粒細胞組的1.59(0.00,2.24),差異有統計學意義(P=0.014 7)。見圖1。
3 討 論
TANAKA等[13]研究表明,嗜酸性粒細胞計數是log(CACS+1)的獨立影響因素,與冠狀動脈鈣化程度呈正相關。本研究結果顯示外周血嗜酸性粒細胞計數對CACS有影響,并且糖尿病患者的嗜酸性粒細胞計數明顯高于非糖尿病患者(P<0.05)。有研究表明,冠狀動脈鈣化的發展是在炎癥刺激下的一個主動過程[13]。嗜酸性粒細胞作為炎性反應的一種效應細胞,合成并釋放生物活性介質參與炎癥過程。嗜酸性粒細胞陽離子蛋白(ECP)是一種儲存在嗜酸性粒細胞顆粒中含鋅的高陽離子蛋白,作為活性標志物由嗜酸性粒細胞通過免疫球蛋白和補體成分等觸發而分泌[14]。在高嗜酸性粒細胞綜合征或過敏性疾病中,ECP通過抑制血栓調節蛋白的功能來激活血小板并促進血栓形成[15-16]。除此之外,ECP上調內皮細胞上細胞間黏附分子-1的表達,使單核細胞與內皮細胞黏附,被認為是動脈粥樣硬化形成的基本步驟[17]。研究提示,急性心肌梗死患者血清中ECP水平升高可能與嗜酸性粒細胞在炎癥過程中的積極作用有關[18]。ERDOGAN等[19]研究發現不穩定型心絞痛患者外周血中的嗜酸性粒細胞數量比體檢健康者高。在石建靜等[20]的研究中,與對照組和不穩定心絞痛組相比,急性心肌梗死組患者的外周血嗜酸性粒細胞數量明顯減少。王德昭等[21]的報道與上述報道相符,并觀察到其與心肌壞死標志物肌鈣蛋白水平呈負相關,而在冠狀動脈抽吸的血栓中觀察到了大量的嗜酸性粒細胞浸潤,表明嗜酸性粒細胞參與了冠狀動脈血栓的形成。這種下降趨勢可能是因為在急性血栓性事件后嗜酸性粒細胞被吸引到損傷區域,與細胞因子復雜的相互作用及與血漿皮質醇水平升高有關。有研究結果顯示血液嗜酸性粒細胞計數在急性心肌梗死后第2天達到峰值,這種升高可能是保護心臟免受缺血損傷的一種代償機制[22],同時血清ECP水平在梗死后2~3 d亦達到高峰。
炎癥細胞因子已被證明能刺激血管細胞的成骨分化和鈣化。WANG等[23]提出循環中的嗜酸性粒細胞特異性趨化因子Eotaxin水平可能反映冠狀動脈粥樣硬化的程度。Eotaxin是嗜酸性粒細胞的特異性化學誘導物,它在動脈粥樣硬化病變中由平滑肌細胞過度表達,促進炎癥。RAGHURAMAN等[24]對嚴重頸動脈疾病患者的血漿分析結果顯示,與無鈣化斑塊相比,鈣化斑塊患者的Eotaxin水平更高,并隨著鈣化程度的增加而升高。與非糖尿病患者相比,糖尿病患者冠狀動脈內的斑塊通常表現出更大的壞死核心和更嚴重的炎癥[25],其血漿Eotaxin水平更高[24]。在高血糖和氧化應激的鈣化環境中,Eotaxin增加堿性磷酸酶的活性,增強鈣沉積,促進血管平滑肌細胞鈣化和成骨細胞轉化。調節血管平滑肌細胞表達的Eotaxin可能通過延遲部分由趨化因子誘導的侵襲性血管鈣化來改善中老年人的不良心血管事件,針對糖尿病患者血液循環中的Eotaxin進行靶向治療可能是減少斑塊負擔和并發癥的新方法。
本研究的局限性在于僅對嗜酸性粒細胞的數量進行了分析,而沒有檢測與其相關的嗜酸性粒細胞陽離子蛋白或趨化因子。研究人群也是基于入院患者,而不是基于社區人群。此外,本研究的樣本量較小,確切的結論有待今后進一步開展多中心、大樣本的臨床研究加以證實。
綜上所述,本研究表明外周血嗜酸性粒細胞計數對CACS有影響,這為理解冠狀動脈鈣化形成的分子機制提供了新的視角和方向,為冠狀動脈鈣化的預防和治療也提出了新的可能性,值得在今后的研究中繼續深入分析。

