苗藥消疤草對四氯化碳肝纖維化大鼠作用機制的研究*
鐘 朕,申曉旭,龍 歷,王 歡,吳亞云
(貴州醫科大學附屬醫院感染科,貴陽 550004)
肝纖維化是由多因素所致的慢性肝損傷修復反應。現普遍認為,肝損傷激活肝星狀細胞并引起細胞外基質堆積是肝纖維化的關鍵環節[1]。如肝纖維化不能得到明顯抑制,將發展成肝硬化甚至誘發肝癌危及生命[2-3]。目前研究認為,肝纖維化是可逆的,因此積極而有效地控制肝纖維化成為現在亟待解決的問題。近年研究發現,中藥在抗纖維化治療中具有明顯成效。以安絡化纖丸、扶正化瘀膠囊、復方鱉甲軟肝片、強肝膠囊等為代表的復合制劑可通過多途徑、多靶點、多層次治療肝纖維化,并在臨床取得一定的療效[4-5]。但是,市場上仍缺乏有效成分確切、價格便宜、能充分逆轉肝纖維化的藥物。對此尋找該類藥物成為現階段最迫切的問題。通過觀察,苗族人用單味搗爛消疤草外敷瘢痕,數月后瘢痕組織可見明顯消退。瘢痕組織主要由膠原蛋白組成,和肝纖維化的形成類似,故受此現象啟發,設計本實驗探尋消疤草抗肝纖維化的作用。本實驗以大鼠為研究對象,從血清水平、肝臟病理形態、肝組織Ⅰ型膠原蛋白(Col-Ⅰ)、α-平滑肌肌動蛋白(α-SMA)的蛋白及mRNA表達方面驗證本實驗可行性。
1 材料與方法
1.1 實驗動物
無特定病原級Wistar大鼠84只,雄性,周齡8周,體重280~320 g,購自貴州醫科大學動物實驗中心[批號:SCXK(京)2015-0005]。本研究通過貴州醫科大學倫理委員會批準(2001099)。
1.2 實驗試劑
四氯化碳(CCl4)購自上海三抒生物科技有限公司。普通飼料購自重慶騰鑫生物技術有限公司。葵花籽油購自益海嘉里食品營銷有限公司。無菌生理鹽水購自貴州科倫制藥有限公司。扶正化瘀膠囊購自上海黃海制藥有限公司(批準文號:Z20020073)。消疤草植株采自貴州省黔東南州山區。YBR Green PCR試劑盒購自上海拜力生物科技有限公司(貨號:KM4101)。兔抗大鼠Col-Ⅰ多克隆抗體購自武漢博士德生物工程有限公司(貨號:BA03250)。兔抗大鼠α-SMA多克隆抗體購自武漢博士德生物工程有限公司(貨號:BA0002)。兔二步法檢測試劑盒購自武漢博士德生物工程有限公司(貨號:PV6001)。
1.3 方法
1.3.1藥物制備
將扶正化瘀膠囊去掉膠囊外殼,按5.25 g/L濃度配成扶正化瘀水溶液[4]。因前期已將采樣植株送至貴州醫科大學藥學院民族藥與中藥實驗教學中心鑒定,結果提示消疤草為罌粟科紫堇屬植株地錦苗,主要成分為異喹啉類生物堿。實驗證明消疤草水煎液對實驗大鼠無毒。取1 000 g新鮮消疤草,洗凈后加入100 mL水中進行文火煎煮直至300 mL。然后將煎液離心去除殘渣,濃縮至2 g/mL作為消疤草原煎液,將其稀釋至1∶5、1∶10濃度的藥液。以原煎液為高劑量組用藥,1/5原煎液為中劑量組用藥,1/10原煎液為低劑量組用藥。藥物制備完成在4 ℃冰箱保存。
1.3.2造模、分組、給藥
所有大鼠適應性飼養1周分成空白對照組,模型組,扶正化瘀組,消疤草高、中、低劑量組,每組14只。各組分籠飼養,實驗前適應性飼養1周。除空白對照組外,每組予以40% CCl4 葵花籽油混合溶液皮下注射(首次0.5 mL/100 g,后予0.3 mL/100 g),每天1次。空白對照組予以等量生理鹽水皮下注射,所有大鼠予以普通飼料喂養。造模時間共8周。第9周開始,扶正化瘀組和消疤草高、中、低劑量組分別予以扶正化瘀水溶液(1.0 mL/100 g)和消疤草高、中、低劑量煎液(1.0 mL/100 g)灌胃治療,其他組大鼠予以等量生理鹽水灌胃,1天2次,連續治療12周。
1.3.3標本采集
實驗結束后,稱量各組大鼠體重。每組大鼠腹腔注射戊巴比妥(4 mg/100 g)麻醉后,無抗凝真空采血管收集股動脈血,靜置、離心分離血清,-20 ℃冰箱保存,后續測定丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、總膽紅素(TBIL)、清蛋白(ALB)水平。解剖大鼠,取出新鮮肝臟,稱量大鼠肝重量,計算肝臟指數(肝臟指數=肝臟重量/小鼠體重×100%)。取新鮮肝右葉組織,部分予10%甲醛保存,后續HE染色、Masson染色。其余肝臟-80 ℃冰箱保存,用免疫組化法、熒光定量PCR分別檢測Col-Ⅰ、α-SMA蛋白和mRNA表達水平。
1.3.4肝臟病理組織檢測
取適量肝組織經常規脫水、浸泡、包埋、固定、切片后,行HE及Masson染色,于顯微鏡下觀察各種大鼠肝組織肝纖維化病理變化。按照Scheuer方法[6]進行炎癥分級(G)和纖維化分期(S)評估。
僅1990—2004年的十多年間,李淑榮經手的曲線超過千萬米,經她解釋的一大批國內外重點井獲得可喜勘探成果,為勝利油田規模勘探和海外勘探提供了重要技術支撐。李淑榮終于實現了自己的理想—成為了名副其實的能聽懂地層語言的測井女專家。
1.3.5血清生化指標檢測
采用全自動生化檢測儀檢測血清ALT、AST、TBIL、ALB水平。
1.3.6Col-Ⅰ、α-SMA檢測
取出肝組織用流水反復沖洗干凈,常規脫水、浸泡、包埋、切片,脫蠟脫水,抗原修復,滴加Col-Ⅰ、α-SMA一抗,加PBS 4 ℃過夜,滴加二抗,滴加DAB染色液顯色,自來水反復沖洗,蘇木素染色,脫水透明、中性樹膠封片。于顯微鏡下觀察并采集圖像,采用Image-Pro Plus 6.0圖像分析系統測定各切片陽性細胞平均吸光度(A)。流水反復沖洗肝組織,采用Trizol提取總RNA,以RNA為模板逆轉錄cDNA,進行Real-time PCR擴增,結果采用2-ΔΔCt法進行各組基因的表達量。引物序列見表1。

表1 引物序列
1.4 統計學處理

2 結 果
2.1 大鼠生存情況
實驗造模期間,除空白對照組外其余組均有大鼠死亡。其中模型組死亡3只,扶正化瘀組,消疤草高、中劑量組均死亡1只,消疤草低劑量組死亡2只,各組大鼠死亡情況比較差異無統計學意義(P>0.05)。治療期間各組均無死亡。
2.2 大鼠體重、肝重量、肝臟指數情況
實驗結束時,模型組大鼠體重低于空白對照組(P<0.05),扶正化瘀組和消疤草各劑量組大鼠體重顯著高于模型組(P<0.05)。模型組大鼠肝臟重量、肝臟指數明顯高于空白對照組(P<0.05),扶正化瘀組和消疤草各劑量組肝臟重量、肝臟指數低于模型組(P<0.05),見表2。

表2 大鼠體重、肝臟重量、肝臟指數比較
2.3 大鼠血清ALT、AST和TBIL水平
與空白對照組比較,模型組血清ALT、AST、TBIL水平顯著升高(P<0.05),ALB水平顯著降低(P<0.05)。與模型組比較,扶正化瘀組,消疤草高、中、低劑量組ALT、AST和TBIL水平顯著下降(P<0.05),ALB水平顯著上升(P<0.05),見表3。
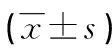
表3 血清肝功能指標比較
2.4 大鼠肝組織病理觀察HE及Masson染色
空白對照組大鼠肝組織結構完整,可見完整肝細胞、肝血竇,肝索排列整齊,肝小葉結構完整,未見明顯纖維組織。模型組肝細胞結構紊亂,可見纖維組織增生,有典型假小葉形成,匯管區及周圍可見明顯炎癥細胞浸潤。扶正化瘀組和消疤草各劑量組肝組織損傷明顯改善,匯管區炎癥浸潤較少,纖維組織增生較輕,見圖1、圖2。在炎癥分級中,空白組無炎癥。與模型組比較,扶正化瘀組和消疤草高、中、低劑量組炎癥分級明顯下降(P<0.05),見表4。在纖維化分期中,空白對照組無纖維增生。與模型組比較,扶正化瘀組和消疤草高、中、低劑量組纖維分期明顯下降(P<0.05),見表5。

A:空白對照組;B:模型組;C:扶正化瘀組;D:消疤草高劑量組;E:消疤草中劑量組;F:消疤草低劑量組。圖1 大鼠肝組織HE染色病理切片(×200)

A:空白對照組;B:模型組;C:扶正化瘀組;D:消疤草高劑量組;E:消疤草中劑量組;F:消疤草低劑量組。圖2 大鼠肝組織Masson染色病理切片(×200)

表4 大鼠肝損傷活動度分級(n)

續表4 大鼠肝損傷活動度分級(n)

表5 大鼠肝纖維化分期(n)
2.5 免疫組化檢測Col-Ⅰ、α-SMA蛋白表達
與空白對照組比較,模型組大鼠肝臟中Col-Ⅰ、α-SMA蛋白表達明顯增加(P<0.05)。與模型組比較,扶正化瘀組和消疤草各劑量組肝臟組織中Col-Ⅰ、α-SMA蛋白表達均有不同程度的下降(P<0.05)。在消疤草各劑量組中,高劑量組Col-Ⅰ、α-SMA蛋白表達最低,見圖3~4、表6。

表6 各組大鼠免疫組化檢測結果

A:空白對照組;B:模型組;C:扶正化瘀組;D:消疤草高劑量組;E:消疤草中劑量組;F:消疤草低劑量組。圖3 大鼠肝組織Col-Ⅰ免疫組化(×200)

A:空白對照組;B:模型組;C:扶正化瘀組;D:消疤草高劑量組;E:消疤草中劑量組;F:消疤草低劑量組。圖4 大鼠肝組織α-SMA免疫組化結果(×200)
2.6 Real-Time PCR檢測Col-Ⅰ、α-SMA 的mRNA表達量
與空白對照組比較,模型組Col-Ⅰ、α-SMA的mRNA表達量明顯減少(P<0.05);與模型組比較,扶正化瘀組和消疤草各劑量組Col-Ⅰ、α-SMA的mRNA表達量明顯減少(P<0.05);消疤草高劑量組的Col-Ⅰ的mRNA表達量最低,但略高于扶正化瘀組,消疤草低劑量組α-SMA的mRNA表達量最低,見圖5。

*:P<0.05,與空白對照組比較;△:P<0.05,與模型組比較。圖5 大鼠Col-Ⅰ、α-SMA mRNA表達量
3 討 論
肝纖維化是由肝炎病毒、乙醇、藥物、化學等因素所引起的慢性肝病,是向肝硬化發展的必經病理過程。肝纖維化是由肝星狀細胞(hepatic stellate cells,HSC)激活,再轉化成肌成纖維細胞(myofibroblasts,MFB),最后產生大量細胞外基質(extracellular matrix,ECM)堆積[1,7-8]。近年來,大多數學者認為,肝纖維化是可以被逆轉的。通過去除誘因,控制肝臟炎癥,清除炎癥介質,重塑瘢痕組織等途徑治療肝纖維化甚至肝硬化已成為一種可能[7-8]。
本實驗中,經不同劑量消疤草煎液治療后,可顯著降低大鼠血清ALT、AST、TBIL水平,而消疤草各劑量組ALB水平處于空白對照組和模型組之間。在病理層面,空白對照組可見結構完整的肝小葉,肝竇、肝索排列整齊,模型組可見明顯假小葉形成,肝索排列紊亂,匯管區沉淀大量膠原纖維,經消疤草煎液治療后大鼠肝損傷程度較模型組明顯改善。故推測消疤草具有保護肝細胞受損,增強肝臟代謝水平和抑制假小葉形成的作用。
在分子生物水平,消疤草組大鼠肝組織中Col-Ⅰ、α-SMA的表達均比模型組下調,其中以消疤草高劑量組治療效果最佳。實驗證明α-SMA和Col-Ⅰ的表達和激活的HSC呈正相關[9]。激活的HSC致大量纖維膠原蛋白沉積在Disse間隙,促進ECM積累[10-11]。ECM積累是肝纖維化發生、發展的關鍵[12]。本研究結果表明,消疤草可下調Col-Ⅰ、α-SMA的表達,抑制HSC激活,減少纖維膠原蛋白沉積和ECM的積累。
本實驗還存在很多不足,以后仍需改進。本實驗采用造模時間短、建模成功率高、死亡率低、可重復性高的CCl4皮下注射造模方法[13-15]。因CCl4有自愈作用,該造模方式對實驗結果可靠性產生影響,后期需進一步探索更加接近人類肝纖維模型方法。在臨床過程中,肝纖維化治療是一個漫長的過程,本實驗干預只有短短12周,對肝細胞修復遠遠不夠。下一步本課題組將選用更長的時間節點動態監測大鼠肝臟情況,不斷豐富實驗數據,進一步探索消疤草抗纖維化的作用。
綜上所述,本實驗初步表明,苗藥消疤草通過保護肝臟細胞受損、增強肝臟代謝能力、下調肝組織Col-Ⅰ、α-SMA 的表達,對CCl4肝纖維化大鼠起到抗纖維化作用。

