番茄BZR基因家族鑒定及非生物脅迫下表達模式分析
陳 旭,沈春洋,莫福磊,呂 瑞,李鑫茂,豆志滔,王傲雪*
(1.東北農業大學園藝園林學院,哈爾濱 150030;2.東北農業大學生命科學學院,哈爾濱 150030)
番茄是世界主要經濟作物之一,原產自南美洲且在我國廣泛種植。近年來,低溫、干旱、極端高溫等非生物脅迫是制約番茄產量的重要因素,通過分子手段發掘番茄抗逆優質基因是解決這一難題的可行辦法[1]。油菜素內酯(Brassinosteroid,BR)是新型植物內源激素,且是第一個被分離出具有活性的油菜素甾族化合物,可將植物體內存在的抗逆潛能充分激發,使其通過內部調節減緩植物遭遇各種不利外界環境時受到的傷害[2-3]。BZR(Brassinazole resistant)是一個轉錄因子家族,作用于BR信號通路下游,主要通過調控一些響應BR的相關基因表達調節植物生長發育并參與植物逆境應答反應[4]。Yin等在擬南芥中首次發現并鑒定得到BZR基因家族[5]。有報道稱BZR1蛋白在其N末端存在一個非典型螺旋-環-螺旋(Basic helix-loop-helix,bHLH)DNA結合基序(即BZR結構域),可結合E-box結構(CANNTG)或BRRE元件,誘導或者抑制靶基因表達[6-7]。研究發現,BES1(BRI1-EMS-suppressor 1)也是一種轉錄因子,且和BZR1被劃分為同一個家族;二者DNA結合結構域相似性較高,因此BES1在植物BR信號通路中也同樣發揮關鍵作用,該基因主要調控植物生長發育及一系列脅迫反應[8]。
擬南芥中響應干旱脅迫的轉錄因子RD26是BES1蛋白靶基因。當RD26過表達時抑制BR信號調節生長,在擬南芥中,轉錄因子RD26與BES1存在相互作用,RD26過表達時抑制BES1在BR調節中的活性,負調控植物響應干旱脅迫[9]。Saha等在白菜中發現15個BZR基因,對白菜冷處理后發現,BrBEH4在冷敏感白菜品種和耐冷白菜品種中表達模式不同,且證實BrBZR可能是調節CBF冷應答途徑的一種轉錄激活因子,提高白菜耐冷性[10]。高溫脅迫主要損害植物葉綠體和線粒體功能,導致體內活性氧(ROS)過度積累,造成氧化損傷。Yin等在番茄中發現BZR1-like蛋白調控BR反應,并通過調節FERONIA(FER)同系物提高番茄耐熱性[5]。CRISPR-bzr1突變體植株顯示生長減慢,且對EBR不敏感。BZR1突變損害RBOSH1誘導、抑制質外體中H2O2產生和耐熱性減弱。而BZR1過表達則增強質外體H2O2產生和高溫應答能力,得出BZR1是番茄耐高溫關鍵基因[11]。
目前,在番茄中對于BZR轉錄因子家族研究相對較少。本研究利用生物信息學手段,綜合分析BZR基因家族生物學特征和表達模式,并利用實時熒光定量PCR技術分析番茄BZR基因在不同脅迫條件下表達情況,為BZR基因對番茄逆境脅迫響應研究提供理論參考。
1 材料與方法
1.1 植物材料與處理
本試驗選用番茄材料為AC(Ailsa Craig);選取顆粒飽滿種子,播種于基質土:蛭石為3∶1栽培基質中,常規栽培管理,光周期為16 h/8 h。當番茄生長至四葉一心時,作低溫脅迫、干旱脅迫、高溫脅迫及鹽脅迫。低溫脅迫處理條件為:4°C處理0、1、6、12和24 h;干旱脅迫處理條件為:濃度為10%聚乙二醇(Polyethylene glyco,PEG)處理0、1、6、12和24 h;高溫脅迫處理條件為:42℃處理0、1、6、12和24 h;鹽脅迫為200 mmol.L-1NaCl溶液浸泡幼苗根部0、1、6、12和24 h。
每個處理設置3個生物學重復,取每株番茄幼苗嫩葉,置于離心管中,然后迅速放置在液氮中速凍,保存于-80℃冰箱中備用。
1.2 番茄BZR基因家族成員鑒定
在茄科數據庫網站SGN(Sol Genomics Network,https://solgenomics.net/)下載番茄基因組文件(SL4.0)和基因組注釋、總蛋白序列文件(ITAG4.0)。在Pfam數據庫(https://pfam.xfam.org/)下載BZR保守結構域(PF05687)隱馬爾可夫模型(Hidden markov model,HMM)文件。使用HMMER 3.0軟件hmmsearch功能,在番茄總蛋白序列中搜索與BZR結構域相似蛋白,且設置E值為1×10-5過濾搜索結果,得到候選番茄BZR基因家族成員。將候選成員蛋白質序列提交到SMART(http://smart.embl.de/)、Pfam和CDD(Conserved Domains Database,https://www.ncbi.nlm.nih.gov/cdd)3個數據庫,確認其是否含有BZR結構域,確定番茄BZR基因家族成員。
1.3 番茄BZR基因家族成員序列分析
利用ExPasy(https://www.expasy.org)在線網站預測SlBZR基因編碼氨基酸長度、等電點和相對分子質量。使用MEGA7.0中MUSCLE比對番茄BZR蛋白序列,獲得番茄BZR蛋白間進化關系。使用MEME-v4.12.0鑒定番茄BZR蛋白序列中保守基序(Motif),最大保守結構域數量設置為10,最小motif寬度為6,最大motif寬度為20。然后利用TBtools分析并可視化進化樹、保守基序信息。為鑒定BZR基因相關順式作用元件,提取BZR基因轉錄起始位點上游1 500 bp堿基基因組序列,提交到PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)網站預測順式作用元件。
1.4 系統發育分析與染色體定位
在Ensembl Plants數據庫下載擬南芥(Arabidopsis thaliana)、馬鈴薯(Solanum tuberosum)與葡萄(Vitisvinifera)蛋白序列文件,利用1.2中方法鑒定擬南芥、馬鈴薯與葡萄中BZR基因家族成員,將鑒定得到物種BZR蛋白序列與番茄BZR蛋白序列使用MEGA7.0中MUSCLE比對,利用鄰接法(Neighbor joining,NJ)構建系統發育樹,bootstrapping值設置為1 000,其余參數為默認值,最后使用iTOL(https://itol.embl.de)網站美化進化樹。
1.5 基于轉錄組數據表達分析
在GEO(Gene Expression Omnibus,https://www.ncbi.nlm.nih.gov/geo/)數據庫下載番茄在干旱和高溫脅迫下轉錄組數據,用于提取SlBZR基因家族成員在兩種逆境處理下表達量,使用TBtools繪制基因表達熱圖。
1.6 RNA提取與qRT-PCR驗證
采用Trizol法提取RNA,使用反轉錄試劑盒(東洋紡)將RNA反轉錄為cDNA。使用熒光染料SYBR(東洋紡)作qRT-PCR試驗,反應體系參考文獻[12]方法,反應程序參照試劑說明書,每個樣品3次生物學重復和3次技術重復。相對表達量計算方法采用2-ΔΔCt法,使用Graphpad作可視化繪圖,引物序列如表1所示。
2 結果與分析
2.1 番茄全基因組中BZR基因鑒定
使用HMMER軟件在番茄全基因組范圍內共鑒定得到9個候選SlBZR基因家族成員,提取9個候選番茄BZR基因家族成員蛋白序列提交到SMART、Pfam和CDD數據庫鑒定其保守結構域,發現9個候選SlBZR基因家族成員均具有BES_N蛋白結構域。如表2所示,根據9個基因在染色體上先后順序,將這9個基因分別命名為SlBZR1~SlBZR9;編碼氨基酸長度在180(SlBZR8)~695(SlBZR1)個氨基酸之間;編碼蛋白質相對分子質量最小為20.39 ku(SlBZR8),最大為77.86 ku(SlBZR1);等電點介于5.33(SlBZR1)~9.73(SlBZR2)之間。
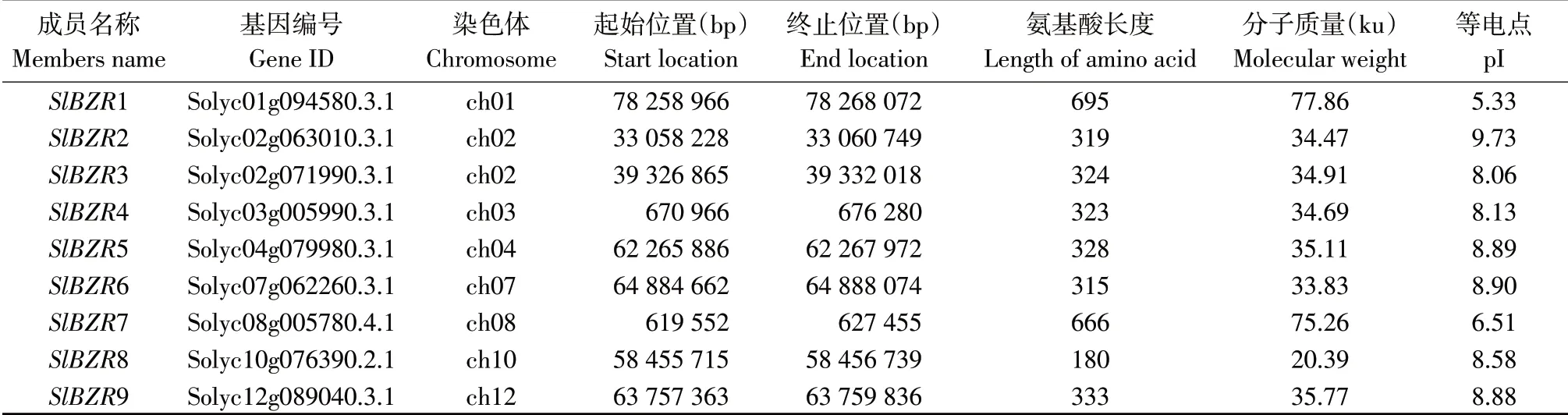
表2 番茄BZR基因家族成員基本信息Table 2 Base information of BZR gene family in tomato
2.2 番茄BZR基因家族成員序列信息
為探究番茄SlBZR基因家族成員序列信息,使用MEME和TBtools軟件分析9個SlBZR基因家族成員進化關系及保守基序,結果如圖1所示。9個Sl-BZR基因在保守基序方面一致性較高,Motif1在所有SlBZRs蛋白上均出現。結合進化關系聚類發現,SlBZR2、SlBZR3、SlBZR4、SlBZR5、SlBZR6和SlBZR9均含有Motif3、Motif5、Motif7和Motif10,而SlBZR1和SlBZR7特有保守基序為Motif2和Motif6。SlBZR8僅含有Motif1,因此被單獨劃分為一個進化分支。
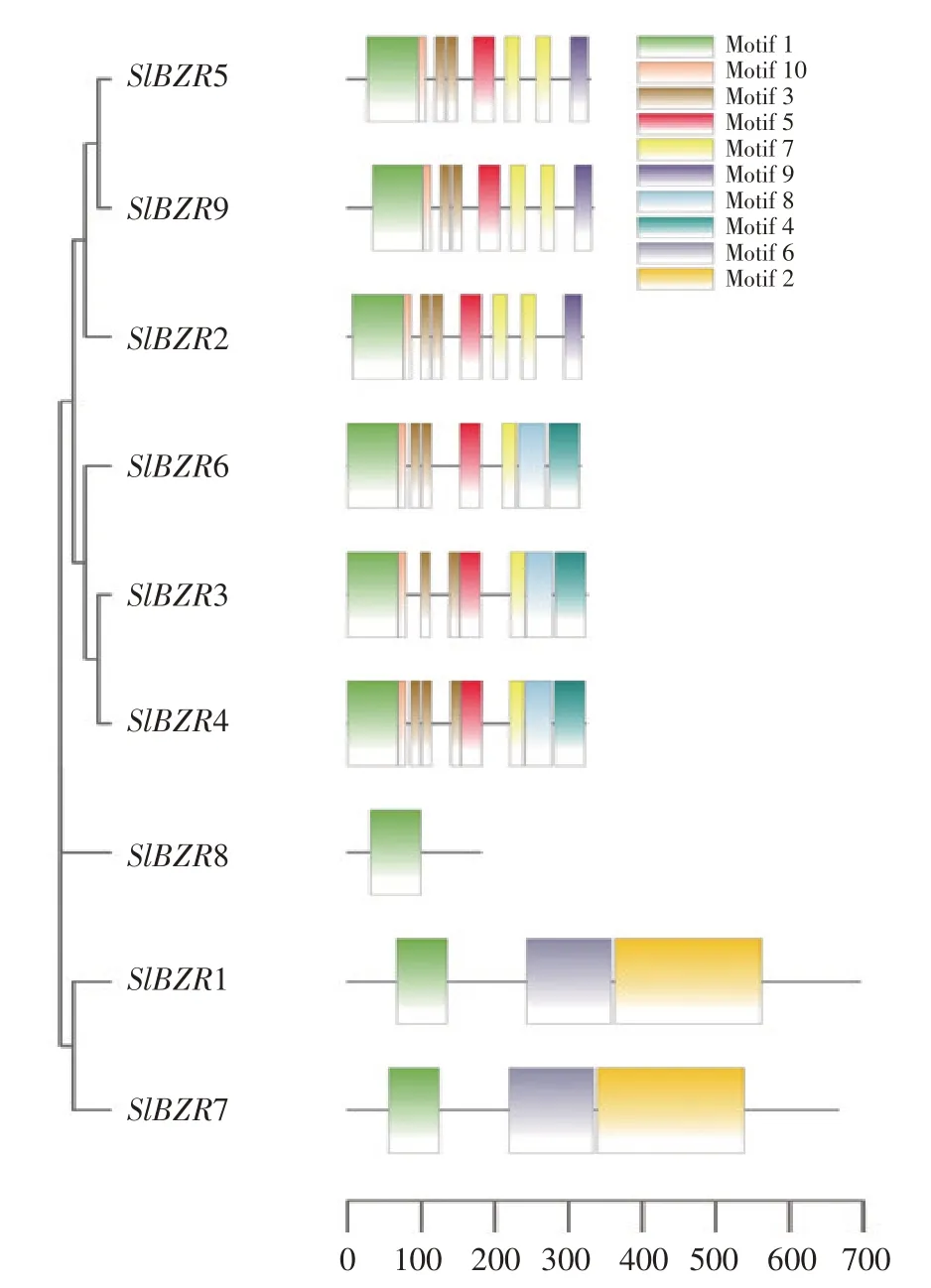
圖1 SlBZR基因家族成員進化關系及保守基序Fig.1 Evolutionary relationships and conserved motifs of SlBZR genes
2.3 番茄BZR基因染色體定位分布
在番茄全基因組范圍內共鑒定得到9個SlBZR基因,以上9個基因分布于番茄12條染色體中8條染色體上,根據其在基因組注釋文件中信息,使用TBtools可視化SlBZR在染色體上的位置,以展示SlBZR基因分布及基因間距離。如圖2所示,除2號染色體上分布有兩個SlBZRs基因外,1、3、4、7、8、10、12號染色體均僅有1個SlBZR基因。同時,SlBZR2和SlBZR3位于2號染色體中間部分,即著絲粒附近,而其他所有SlBZRs基因均分布在染色體兩端遠離著絲粒區域。
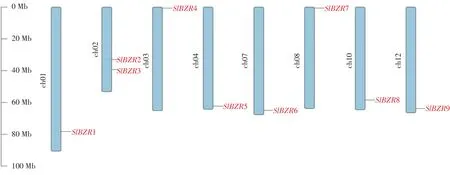
圖2 番茄BZR基因染色體定位Fig.2 Chromosomemapping of BZR genesin tomato
2.4 番茄BZR基因系統發育分析
為研究番茄BZR基因進化關系,按照本研究材料與方法1.2中鑒定方法,分別在擬南芥、馬鈴薯與葡萄中鑒定BZR基因家族成員,并繪制番茄、擬南芥、馬鈴薯與葡萄4個物種BZR家族成員系統發育樹。結果如圖3所示,4個物種BZR基因成員系統發育樹共分為I~V個亞家族,4個物種中與番茄BZR基因家族成員進化關系最近的BZR基因均為馬鈴薯中BZR成員,而擬南芥和葡萄中BZR成員,與番茄BZR成員在進化上關系較遠;如IV亞家族,僅有兩個葡萄中BZR成員。
2.5 番茄BZR基因順式作用元件預測
為預測SlBZR基因生物學功能,使用Plant-CARE數據庫對SlBZR基因起始密碼子上游1 500 bp啟動子區域作順式作用元件分析(見圖4)。結果表明,SlBZR相關基因啟動子區存在豐富的順式作用元件,可能對其生物學功能影響較大。在所預測31個順式作用元件中,SlBZR基因啟動子上均含有較多CAAT-box(啟動子和增強子區域中常見順式作用元件)、TATA-box(轉錄起始的核心啟動子元件)。SlBZR5含有較多AT~TATA-box元件、SlBZR3含有較多Box元件、SlBZR4含有較多ABRE元件(參與脫落酸響應的順式作用元件)、SlBZR1含有較多MYC元件且SlBZR6含有較多ERE元件(乙烯響應元件)。部分順式作用元件盡管含量較少但仍具有重要生物學功能,如ARE(厭氧誘導元件)等。
2.6 基于轉錄組數據番茄BZR基因表達模式分析
為探究番茄SlBZR基因在非生物脅迫下表達情況,本研究在GEO數據庫下載通過干旱與高溫脅迫處理番茄葉片轉錄組數據。轉錄組(FPKM)數據包括干旱處理、高溫處理和對照,如圖5所示,圖5a為干旱處理(D,drought),每組數據為不同處理天數(d,day);圖5b為高溫處理(H,heat),每組數據為不同處理小時數(h,hour)。有8個SlBZR基因在不同條件下均表達,而SlBZR8基因在高溫脅迫下不表達。SlBZR3、SlBZR6和SlBZR9在干旱處理后與對照相比,隨處理時間增加,表達量呈先升后降趨勢,且表達量最高時均在干旱處理3 d時,SlBZR1和SlBZR8在干旱處理4 d時上調表達最明顯。SlBZR2和SlBZR5經干旱處理后表達量均比對照組低。同時在高溫脅迫下發現,處理后表達量比對照低,如SlBZR2、SlBZR5和SlBZR9。而SlBZR3、SlBZR4、SlBZR6和SlBZR7在高溫脅迫下與對照相比,隨脅迫時間增加,表達量呈先升再降又升趨勢。由此表明,SlBZR基因不同表達方式也間接揭示SlBZR基因家族在番茄響應逆境脅迫中的功能多樣性。
2.7 番茄BZR基因家族成員在非生物脅迫下表達模式分析
為驗證RNA-Seq數據準確性,研究番茄中Sl-BZR基因家族對非生物脅迫反應,本研究選擇4個SlBZR家族成員,分別為SlBZR3、SlBZR6、Sl-BZR8和SlBZR9。
如圖6所示,在冷脅迫下,隨時間推移,與對照相比SlBZR6和SlBZR8表達量呈現上調表達(Sl-BZR6在冷脅迫12 h后其相對表達量驟降,但整體仍上調表達);SlBZR3和SlBZR9則表現為先降再升趨勢。冷脅迫下,與對照相比,SlBZR6上調表達最明顯,其相對表達量約為對照組(冷處理0 h)6倍。鹽脅迫時,SlBZR3、SlBZR6和SlBZR9均在處理12 h時呈相對表達量峰值,而SlBZR8則出現在6 h時(約為對照組5.7倍),且SlBZR6無明顯上調趨勢。干旱脅迫前12h,SlBZR6、SlBZR8和SlBZR9相對表達量呈逐步升高趨勢,且4個基因均在處理12 h后達最高相對表達量,且24 h后相對表達量略低于12 h。高溫脅迫下,SlBZR3在12 h前相對表達量隨時間呈階梯上調,其余基因在高溫脅迫下無明顯上調或下調趨勢,且SlBZR3和SlBZR8在高溫脅迫24 h時相對表達量顯著低于對照,其他兩個基因則略低于對照,與轉錄組數據結果一致。
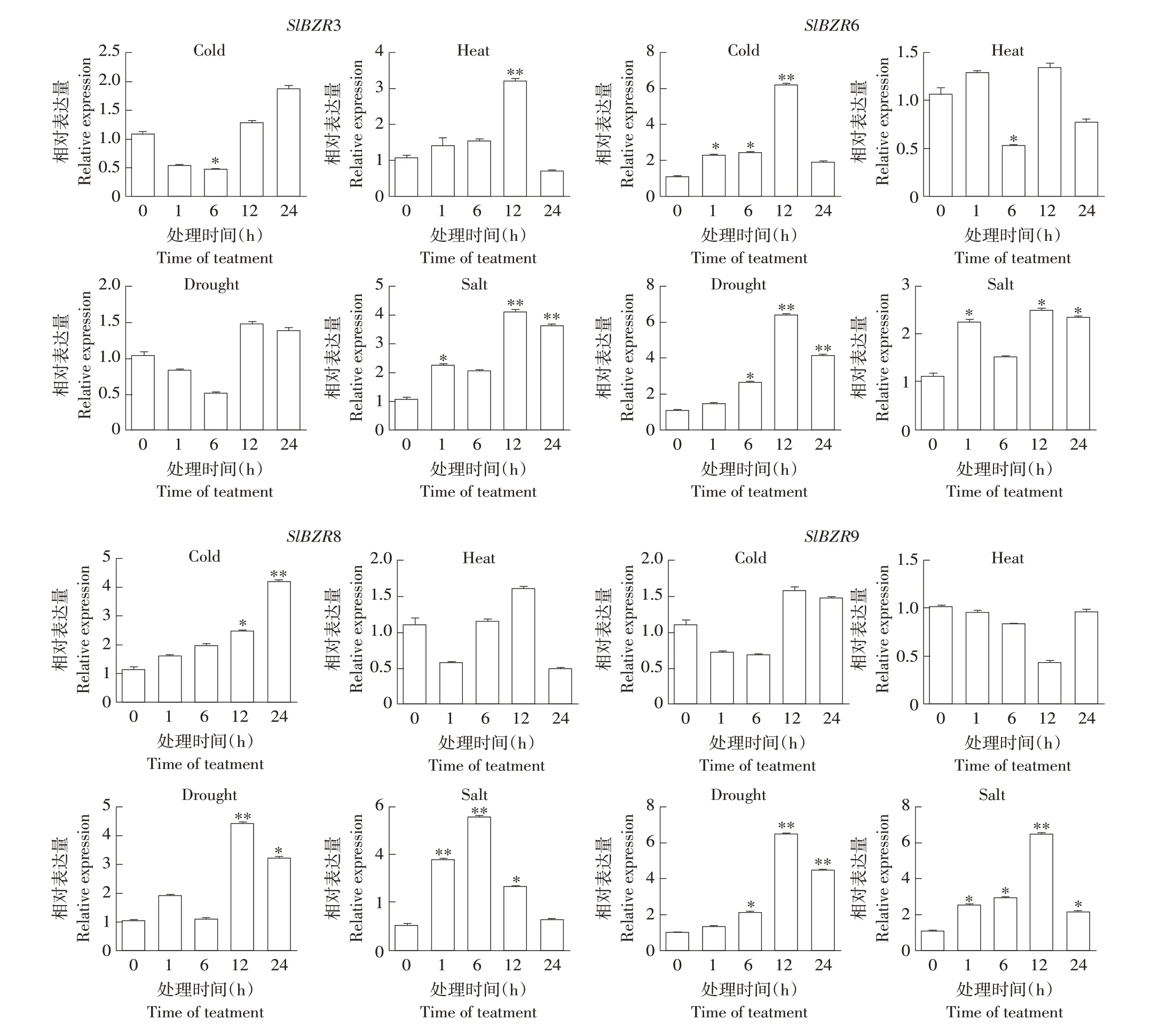
圖6 4個番茄BZR基因不同脅迫處理下相對表達量Fig.6 Relativeexpression of four tomato BZR genesunder different stresstreatments
3 討論
作為植物轉錄因子家族之一,BZR家族基因通過在轉錄水平調控下游各類靶基因,參與植物多種生理過程和生長發育[13]。目前,已在多種植物中發現BZR基因家族,如擬南芥[9],大豆[14],小麥[15]和水稻[16]等。植物中存在的BZR蛋白功能復雜,如調控響應BR的基因表達調節植株生長發育和使植株抗逆性增強等[4]。然而在番茄中,關于BZR基因家族研究較少。
本研究共鑒定出9個SlBZR基因家族成員,且獲得其序列特征和結構、保守基序、染色體位置和啟動子區順式作用元件等信息;此外基于轉錄組數據,獲得9個基因在干旱和高溫下表達模式,已通過qRT-PCR驗證其結果。如表2所示,SlBZR基因家族成員平均分子質量為42.5 ku,平均pI為8.11。前人研究得出BZR蛋白結構包含N端核定位信號序列、高度保守DNA結合結構域、磷酸化區域、PEST序列及C端結構域,這可能是導致Sl-BZR基因家族平均等電點大于7的原因[5]。BZR1和BES1(和BZR1同屬一類的轉錄因子)可調節下游BR響應基因表達,且二者均既發揮轉錄激活子功能又發揮轉錄抑制子功能[4]。其DNA結合域通常包含一個bHLH(螺旋-環-螺旋)結構,BZR1 DNA結合域是BZR1相關蛋白中最保守區域,由第一外顯子編碼,可與BRRE元件特異結合,從而實現對靶基因誘導或抑制[7,10]。如圖1所示,該基因家族成員含保守基序,有較高一致性,進化分支劃分也較清晰。同時本研究也發現SlBZR基因并不屬于內含子富集型基因家族,因此推斷在SlBZR基因家族不斷多樣化過程中可能導致內含子丟失情況發生[17]。圖4顯示所鑒定9個SlBZR基因啟動子上游順勢作用元件功能分析,發現其均含有豐富順式作用元件,如CAAT-box、TATA-box、ABRE、MYC和ERE等。順式作用元件按照功能大體分為三大類:生長發育相關順式作用元件(如G-box)[18]、激素反應相關順式作用元件(如ABRE)[19]和應激反應相關順式作用元件(如LTR)[20]。在SlBZR基因家族中均檢測到該元件存在,表明SlBZR基因家族在抗逆中發揮功能原因之一可能是家族順式作用元件的豐富性。本研究揭示SlBZR基因對低溫脅迫、干旱脅迫、高溫脅迫和鹽脅迫響應。如圖6所示,SlBZR對4種處理均有響應,但不同SlBZR成員表達水平存在差異。另有小麥研究表明,將過表達的TaBZR2轉入小麥(Triticum aestivumL.)可提高其植株抗旱性[15]。如圖5所示,SlBZR基因在干旱組和高溫組表達模式相近,但也有個別基因呈現較大差異。SlBZR8在高溫組未表達,而在干旱處理4 d時呈顯著上調趨勢,5 d后其表達量又下降。隨后將這9個SlBZR基因作qRT-PCR試驗,結果表明大部分基因表達與轉錄數據分析結果一致。Chen和Li等發現在擬南芥中,轉錄因子CBF、WRKY6及脫落酸受體PYL6編碼抗寒基因表達,而BZR1對此調控過程起促進作用[21-22]。另外本研究發現,SlBZR3在高溫和鹽脅迫下表達量顯著上調;Sl-BZR8在冷處理下表達量顯著上調(特別是24 h后上調近4倍)。而SlBZR8在鹽處理前期尤其是6 h后表達量上調明顯,可能在鹽脅迫早期反應中發揮作用。在擬南芥中,bes1-D突變體與野生型植株相比在鹽脅迫條件下葉片萎蔫程度比野生型植株葉片更小[23],本研究在番茄中同樣驗證BZR基因響應鹽脅迫。
綜上所述,本研究首次在番茄中鑒定BZR基因家族成員,通過生物信息學分析及非生物脅迫下qRT-PCR分析,揭示番茄BZR基因家族成員,在番茄生長發育、逆境脅迫與激素響應方面可能發揮重要作用,為研究SlBZR基因在番茄響應逆境脅迫過程提供思路,也為進一步研究SlBZR基因家族在番茄育種和抗性改良中作用提供基礎。

