HIFU聯合清蛋白結合型紫杉醇治療胰腺癌的臨床觀察
楊小琴,冉立峰,金成兵△,楊 煒,張 俊,馬玉虹,周 崑,朱 輝
(1.重慶醫科大學研究生院 400016;2.重慶醫科大學附屬第二醫院腫瘤中心 400010)
胰腺癌是一種惡性程度極高、侵襲性很強的消化系統腫瘤,目前在全球范圍內的發病率和病死率均呈上升趨勢[1]。手術聯合化療為主的全身藥物治療是目前早期胰腺癌的最佳治療方法。然而,多數胰腺癌臨床發現時已為不可手術切除的中晚期,對于不可切除胰腺癌,多采用局部放療聯合化療治療,但療效仍不滿意。近年來,一種將低能量超聲波體外聚焦,通過高溫為主的生物學效應消融深部腫瘤的新技術——高強度聚焦超聲(HIFU),已用于不可切除胰腺癌的臨床治療[2]。HIFU能有效消融局部病灶,緩解癌性疼痛[3-5]。與手術、放療等比較,HIFU具有體外、非侵襲性、創傷小、恢復快、無放射污染等優點,可能是不可切除胰腺癌的一種有效、值得期待的微無創治療方法。由于胰腺癌鄰近器官的復雜性及侵襲性很強的特點,HIFU難以完整、超范圍、徹底消融腫瘤,往往會出現肉眼或鏡下殘留。如何減少、滅活殘留病灶是提高HIFU局部療效、延長患者生存期的關鍵問題。且目前少有HIFU聯合清蛋白結合型紫杉醇治療胰腺癌的報道。為此,本研究采用HIFU聯合一種新型的靶向化療藥物——清蛋白結合型紫杉醇,治療不可切除胰腺癌,探討其安全性及有效性,以期為不可切除胰腺癌提供一種新的、安全有效的綜合治療方法。
1 資料與方法
1.1 一般資料
選取2017年7月至2020年6月重慶醫科大學附屬第二醫院腫瘤中心收治的不可切除胰腺癌患者48例,將其分為觀察組和對照組,每組24例。納入標準:(1)經過病理確診為胰腺癌,或經多學科討論符合臨床診斷;(2)局部晚期或遠處轉移而不能手術切除;(3)體力狀況(ECOG)評分0~2分;(4)膽道梗阻者有效減黃后;(5)預計生存期大于或等于3個月;(6)無重要臟器功能障礙及骨髓造血功能衰竭;(7)具有可測量的病灶;(8)無對清蛋白或紫杉醇等化療藥物過敏;(9)局部治療區皮膚完整。排除標準:(1)超聲不能清晰顯示預治療靶區;(2)顱內轉移;(3)脊柱轉移且合并病理性骨折;(4)腫瘤侵犯腸系膜上動脈且伴有腸道缺血性臨床表現。本研究獲得中國注冊臨床試驗倫理委員會及本院倫理委員會批準(倫理審查文號:ChiECRCT20190087),所有入組患者均簽署知情及治療同意書。兩組患者一般資料比較,差異均無統計學意義(P>0.05),見表1。
1.2 方法
1.2.1HIFU治療
所有患者均接受HIFU治療。HIFU設備是由中國重慶海扶醫療科技股份有限公司提供的JC型HIFU腫瘤治療系統,主要包括超聲發生器、聚焦超聲換能器、運動系統、控制系統、B超實時引導系統。治療參數:治療頻率 0.85 MHz,焦距135 mm,最大治療功率400 W。治療介質為脫氣水。治療前10 h禁食禁飲行腸道準備,治療區皮膚脫脂脫氣,完善術前常規檢查。治療中結合治療前影像資料確定治療體位,使用機載超聲評估聲通道并定位,根據病灶大小、深度、鄰近臟器等情況制訂治療次數及時間,按照點-線-面-體的輻照方式對病灶實施三維立體適形消融。治療后禁食禁飲24 h以上至患者肛門排氣;常規給予抗生素預防感染、質子泵抑制劑(PPI)預防胰腺炎,并于術后1、3~5、7 d復查胰腺炎酶學監測有無胰腺炎發生。HIFU治療后15、30 d及以后每3個月隨訪影像學變化,若病灶有殘留,可行第2次或多次HIFU治療。
1.2.2化療方法
(1)觀察組患者HIFU治療后,給予清蛋白結合型紫杉醇(購自石藥集團歐意藥業有限公司,規格:100 mg)125 mg/m2靜脈滴注30 min,于第1、8、15天應用,28 d為1個周期;聯合吉西他濱(購自希臘VIanex SA Plantc公司,規格:200 mg)1 000 mg/m2靜脈滴注,>30 min,于第1、8、15天應用,28 d為1個周期(n=22),或聯合替吉奧(購自江蘇恒瑞醫藥股份有限公司,規格:替加氟20 mg,吉美嘧啶5.8 mg,奧替拉西鉀19.6 mg)40 mg口服,每天2次,連續服用14 d,每3周重復化療(n=2)。(2)對照組中14例患者接受單純HIFU治療,10例患者在HIFU治療后給予非清蛋白結合型紫杉醇的化療,具體方案:吉西他濱單藥(n=2)、替吉奧單藥(n=4)、吉西他濱聯合替吉奧(n=4),相應藥物用法均同觀察組。其中,輸注清蛋白結合型紫杉醇均不做抗過敏預處理,化療前常規給予5-羥色胺3受體拮抗劑預防嘔吐,≥65歲患者化療藥物減少25%,化療6~8周期,或持續至疾病進展或出現不能耐受的不良反應或拒絕繼續化療或無進展情況下任何原因死亡。
1.2.3療效評價
(1)客觀療效:治療后每3個月行上腹部磁共振成像(MRI)/CT增強檢查,根據實體腫瘤評價標準(RECIST)1.1對腫瘤病灶進行評估,分為完全緩解(CR)、部分緩解(PR)、疾病穩定(SD)和疾病進展(PD),以(CR+PR)/總例數×100%計算客觀緩解率(ORR),以(CR+PR+SD)/總例數×100%計算疾病控制率(DCR)。胰腫瘤消融率為消融體積/治療前病灶體積×100%。(2)記錄兩組患者治療前和治療后3個月的ECOG評分、疼痛評分、糖類抗原(CA)19-9與CA125水平變化。疼痛評分使用數字評估法(NRS)。(3)生存分析:以首次接受HIFU治療日期為起點,以死亡日期、失訪日期或隨訪截止日期為終點。計算兩組患者中位生存期(MST)及1、3、6、12個月總生存率(OSR)。(4)不良反應:參照常見不良事件評價標準(CTCAE)5.0版進行分級。
1.3 統計學處理
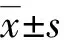

表1 兩組患者一般資料比較(n=24)
2 結 果
2.1 兩組患者客觀療效比較
兩組均無CR病例,觀察組PR 8例,SD 14例,PD 2例,ORR為33.33%,DCR為91.67%;對照組PR 6例,SD 12例,PD 6例,ORR為25.00%,DCR為75.00%,觀察組的ORR、DCR均高于對照組,但差異均無統計學意義(χ2=0.403、2.400,P=0.525、0.245)。觀察組胰腫瘤消融率為(98.33±22.10)%,對照組為(90.35±32.90)%,兩組患者胰腫瘤消融率比較差異無統計學意義(t=-0.986,P=0.329)。
2.2 兩組患者治療前后ECOG、NRS評分比較
觀察組、對照組疼痛緩解率分別為83.33%(20/24)、75.00%(18/24),兩組比較差異無統計學意義(χ2=0.505,P=0.477)。治療后3個月,兩組患者ECOG、NRS評分均較治療前明顯下降(P<0.05),且觀察組NRS評分明顯低于對照組(t=2.323,P=0.025);而兩組患者ECOG評分比較差異無統計學意義(Z=-0.876,P=0.381),見表2。
2.3 兩組患者CA19-9、CA125水平比較
治療后3個月,兩組CA19-9、CA125水平均較治療前明顯下降(P<0.05),且觀察組CA19-9水平明顯低于對照組(Z=-2.092,P=0.036);而兩組CA125水平比較差異無統計學意義(Z=-0.990,P=0.322),見表3。

表2 兩組患者治療前后ECOG、NRS評分比較(n=24,分)
2.4 兩組患者MST及OSR比較
至隨訪結束,觀察組MST較對照組明顯延長(15個月vs.10個月,χ2=4.128,P=0.042)。觀察組1、3、6、12個月OSR分別為100%、100%、79.17%、62.50%,對照組分別為91.67%、79.17%、66.67%、33.33%,兩組患者12個月OSR比較差異有統計學意義(χ2=4.090,P=0.043)。兩組患者生存曲線圖見圖1。

表3 兩組患者CA19-9、CA125水平比較[M(P25,P75),n=24,U/mL]

圖1 兩組胰腺癌患者生存曲線圖
2.5 兩組患者不良反應比較
HIFU治療后兩組均未出現Ⅲ~Ⅳ級不良反應。對照組與觀察組患者出現的Ⅰ~Ⅱ級不良反應包括治療區皮膚橘皮樣改變(0/1)、治療區皮下軟組織水腫(14/12)、治療區疼痛(20/21)、胰腺炎(4/2)、惡心嘔吐(7/4)、腹瀉(3/3)、發熱(2/3)。其中隨訪復查胰腺炎酶學發現觀察組血淀粉酶為54.00(24.00,88.00)U/L,有2例患者血淀粉酶明顯升高,并發了胰腺炎,對照組血淀粉酶為48.00(28.75,77.99)U/L,4例患者血淀粉酶輕度升高,并發了胰腺炎。各不良反應比較差異均無統計學意義(P>0.05)。上述不良反應經對癥處理后可逐漸恢復正常。化療后觀察組、對照組分別有24、10例患者發生常見不良反應,包括血液學毒性、消化道反應、外周感覺神經障礙、皮膚過敏、心律失常、脫發和乏力。僅在觀察組發生的不良反應為外周感覺神經障礙(Ⅱ級)和心律失常(心房顫動,Ⅲ級),發生率依次為8.33%和4.17%。兩組各不良反應構成比比較,差異均無統計學意義(P>0.05),見表4。

表4 兩組患者化療后不良反應比較[n(%)]
2.6 典型病例HIFU治療前后CT圖像
患者,男,50歲,胰腺體部癌HIFU術前增強CT顯示,病灶不均勻強化;HIFU術后增強CT顯示,病灶內血液供應消失,病灶區凝固性壞死,見圖2。

箭頭所指為壞死病灶。
3 討 論
目前,手術切除依然是胰腺癌的最佳治療方式,但胰腺癌起病隱匿,易發生早期遠處轉移和周圍血管侵犯,大多數患者在確診時已失去手術治療機會。多年來不可切除胰腺癌的一線治療方案總體療效差強人意,迫切需要新的、有效的治療方法致力于不可切除胰腺癌的治療。
清蛋白結合型紫杉醇是紫杉醇和清蛋白結合成納米級無溶劑的膠體懸浮顆粒,通過活性的gp60受體介導的跨膜轉運及與富含半胱氨酸的酸性分泌蛋白(SPARC)的結合來增加紫杉醇藥物蓄積。相比溶劑型紫杉醇,清蛋白結合型紫杉醇不需要助溶劑和預處理,毒性低、輸注時間短[6-7]。有研究發現,清蛋白結合型紫杉醇可以使腫瘤間質耗竭、減少細胞中胞苷脫氨酶(吉西他濱代謝酶)蛋白水平,從而提高血中和組織中的化療藥物濃度、增強化療療效[8-9]。
HIFU治療是一種局部消融腫瘤的非侵入性手術,基本原理是將體外低能量的超聲波聚焦于體內腫瘤靶組織處產生生物學效應(熱效應、空化效應、機械效應),使靶組織發生凝固性壞死,從而消融腫瘤。HIFU治療不僅可直接破壞原發腫瘤,還可以引起腫瘤相關抗原的釋放、腫瘤細胞分泌免疫抑制因子及誘導細胞毒性T淋巴細胞活性,從而激活宿主抗腫瘤免疫,增強抗腫瘤效果,還有助于控制腫瘤微轉移[10]。有大量研究證實,HIFU治療晚期胰腺癌可有效緩解疼痛、延長生存期,且具有獨特的無創性、實時監控、適形消融、對周圍組織血管影響小、并發癥輕等優點[3-4,11-13]。盡管如此,由于胰腺癌鄰近胃腸道、膽道、脊柱等重要器官和腸系膜上動脈、腹腔干等重要血管,HIFU消融過程中可能對其造成損傷,產生如胃腸道穿孔等嚴重并發癥;且胰腺癌具有很強的神經、血管侵襲性特點,而CT、磁共振成像(MRI)等影像學難以完全發現微小的侵襲性病灶,導致HIFU難以完整、超范圍、徹底消融腫瘤,往往會出現肉眼或鏡下殘留。因此,如何減少、滅活殘留病灶,提高HIFU局部療效、延長患者生存,是目前重要的研究熱點。
為此,本研究通過聯合高效的新型靶向化療藥物——清蛋白結合型紫杉醇,來增加療效。生存分析顯示,觀察組MST、12個月OSR較對照組明顯提高,且優于晚期胰腺癌的一線治療[14-15]與NING等[16]報道的HIFU聯合吉西他濱治療(MST為7.4個月,6個月OSR為66.3%,12個月OSR為21.32%)。此外,治療后兩組患者的ECOG評分、疼痛程度、腫瘤標志物水平均較治療前改善,且在疼痛程度與CA19-9下降方面觀察組較對照組更明顯(P<0.05)。以上結果表明,與其他聯合治療方法比較,HIFU聯合含清蛋白結合型紫杉醇化療,可能在改善患者生存、提高疼痛控制與減輕腫瘤負荷等方面更有優勢。其可能機制是清蛋白結合型紫杉醇有去腫瘤間質化作用,以及HIFU治療后改變了腫瘤局部的微環境(熱消融后周邊組織充血水腫更明顯,血流增加,藥物聚集增加),導致局部化療藥物濃度增加,化療藥物療效增強,能更加有效殺滅殘留的腫瘤病灶,增加了治療效果,單一的HIFU治療或HIFU聯合其他藥物無法實現[8,13]。具體的作用機制仍需要進一步的基礎研究。
本研究中HIFU治療后出現的不良反應均可耐受。治療區皮下軟組織水腫、疼痛可能由于聲通道上的衰減能量對局部組織造成熱損傷所致,出現橘皮樣改變的患者考慮可能是功率過大導致(該患者HIFU治療平均功率為400 W,治療時間為992 s),上述不良反應經過間斷冷敷、藥物止痛、改善微循環即可好轉。兩組均出現了無癥狀的胰腺炎,原因可能是HIFU治療中超聲波通過正常胰腺或腫瘤熱消融后的熱擴散引起周邊正常胰腺組織的無菌性輕微炎性反應,使得胰酶釋放,進而通過周圍的血管入血,導致胰酶升高。出現發熱的患者均為中、低度熱,無病原學證據,可能與HIFU治療后病灶產生凝固性壞死,壞死組織產生吸收熱所致。未發現消化道出血、胃腸穿孔、血管損傷等嚴重并發癥。化療后,觀察組的Ⅲ~Ⅳ級不良反應發生率更高,但未增加危及生命的毒副反應發生率,此外,觀察到有外周感覺神經障礙和心律失常這兩種并發癥僅發生在觀察組,但發生率較低,經對癥處理可緩解,不影響后續治療。未出現因不良反應停止治療或相關死亡者。
綜上所述,HIFU聯合含清蛋白結合型紫杉醇的化療治療不可切除胰腺癌安全可行,能明顯緩解疼痛、降低腫瘤負荷、提高生存率和延長生存期,且毒副反應小。但本研究樣本量少,隨訪時間較短,其結論尚待大樣本量、足夠隨訪時間的隨機對照研究進一步驗證。

