胃蛋白酶原、促胃液素-17在胃癌癌前病變篩查中的應用價值
費麗紅,冀子中
(1.蚌埠醫學院研究生院,安徽 蚌埠 233030; 2.嘉興市第一醫院消化科,浙江 嘉興 314000)
胃癌是常見的消化道惡性腫瘤之一。世界癌癥分析報告指出,2018年世界胃癌的新發病例近100萬,胃癌已成為第五大常見惡性腫瘤,并成為癌癥致死的第三大原因[1]。由于早期就診率低,約50%的胃癌確診患者處于疾病進展期,治療效果差、復發率高、死亡率高[2]。胃癌的發生是一個連續性過程,即經歷了正常胃黏膜、淺表性胃炎、萎縮性胃炎、腸上皮化生、異型增生的過程,直至發生胃癌[3-4]。研究發現,胃癌患者多數伴有胃黏膜萎縮,因此胃黏膜萎縮的早期診斷和治療對防止胃癌的發生具有重要意義[5]。目前胃鏡結合胃黏膜活檢組織學檢查是篩查和診斷胃癌的金標準,但胃鏡檢查成本高,患者依從性差,難以進行大規模普查,而血清胃蛋白酶原(pepsinogen,PG)和促胃液素-17被稱為“血清學活檢”,在胃黏膜萎縮時通常會發生變化,故可用于篩查胃黏膜萎縮[6-7]。血清學篩查相對于內鏡檢查更容易被大眾接受,且推廣度更高,診斷效率高,具有較高的臨床價值。本研究通過檢測不同病變階段胃黏膜血清PG-Ⅰ、PG-Ⅱ、PG-Ⅰ/PG-Ⅱ比值(pepsinogen-Ⅰ/pepsinogen-Ⅱ,PGR)和促胃液素-17水平,探討其在篩查胃癌癌前病變中的應用價值。
1 資料與方法
1.1一般資料 回顧性分析2017年12月至2019年7月在嘉興市第一醫院消化科就診并行胃鏡檢查的472例消化道疾病患者的病歷資料。所有受試者在胃鏡檢查前均行血清學檢測。納入標準:①年齡40~79周歲,性別不限。②胃癌高危人群[胃癌高發區人群、既往有幽門螺桿菌感染者、既往有癌前疾病或癌前病變者,特別是有胃癌家族史、慢性萎縮性胃炎(含腸化、瘤變等)、胃潰瘍病史,胃癌患者一級親屬(包括父母和兄弟姐妹)及其他危險因素(高鹽飲食、喜食煙熏煎炸食品、吸煙、重度飲酒)]。排除標準:①有嚴重的心、肝、腎功能不全;②嚴重精神疾患;③胃部手術史(包括外科手術、內鏡黏膜下剝離術、內鏡黏膜下剝離術)。④正在使用或就診前2周內使用過質子泵抑制劑等藥物。⑤研究人員認為不適合參加本研究者。本研究經嘉興市第一醫院倫理委員會批準,受試者均簽署了知情同意書。
1.2胃鏡檢查與病理診斷 按照1990年悉尼系統標準活檢[8],分別于胃竇小彎側距幽門3 cm處以及胃體小彎側距賁門8 cm處標準活檢,活檢組織分別保存并標記取材部位。疑似萎縮、腸化的部位另取活檢。病理醫師以“慢性胃炎的病理診斷直觀模擬評分法”標準判斷病理結果[9]。
1.3血清學檢測 所有受檢者空腹采血5 mL,取離心后血清檢測或置于-80 ℃冰箱保存待檢。采用酶聯免疫法檢測血清PG-Ⅰ、PG-Ⅱ、PGR、促胃液素-17(試劑盒購于芬蘭必歐瀚集團)。

2 結 果
2.1一般情況 472例病檢者中,淺表性胃炎347例,其中男164例、女183例,年齡40~78歲,平均(52.8±12.9)歲;萎縮性胃炎108例,其中男60例、女48例,年齡41~77歲,平均(55.8±10.8)歲,其中胃竇萎縮73例,胃體萎縮14例,胃竇、胃體均萎縮21例;異型增生17例,男15例、女2例,年齡48~77歲,平均(60.7±8.7)歲。鑒于異型增生組病例數較少,本研究以萎縮性胃炎組+異型增生組作為胃癌癌前病變檢出情況。三組性別、年齡比較差異有統計學意義(χ2=6.175,P=0.002;F=5.403,P=0.006)。
2.2不同病理分型患者PG-Ⅰ、PG-Ⅱ、PGR及促胃液素-17比較 淺表性胃炎組、萎縮性胃炎組和異型增生組患者血清PG-Ⅰ和PGR水平比較差異有統計學意義(P<0.05)。與淺表性胃炎組相比,萎縮性胃炎組和異型增生組患者的血清PG-Ⅰ和PGR水平明顯降低(P<0.05);萎縮性胃炎組和異型增生組患者血清PG-Ⅰ、PGR水平差異無統計學意義(P>0.05)。淺表性胃炎組、萎縮性胃炎組和異型增生組患者血清促胃液素-17和PG-Ⅱ水平比較差異無統計學意義(P>0.05)。見表1。
2.3不同萎縮部位萎縮性胃炎患者PG-Ⅰ、PG-Ⅱ、PGR及促胃液素-17比較 各組PG-Ⅱ水平比較差異無統計學意義(P>0.05)。胃體萎縮組、胃竇萎縮組和胃體+胃竇萎縮組患者血清PG-Ⅰ、PGR和促胃液素-17水平比較差異有統計學意義(P<0.05)。與胃體萎縮組相比,胃竇萎縮組、胃竇+胃體萎縮組血清促胃液素-17水平降低,胃竇萎縮組血清PG-Ⅰ、PGR水平升高(P<0.05);胃竇萎縮組和胃竇+胃體萎縮組血清PG-Ⅰ、PGR和促胃液素-17水平比較差異無統計學意義(P>0.05)。見表2。
2.4PG和促胃液素-17對萎縮性胃炎的診斷價值分析 采用ROC曲線分析各項指標對萎縮性胃炎的診斷價值,以PGR≤10.95為臨界值,其靈敏度和特異度分別為98.6%、68.7%,以促胃液素-17≥9.95 pmol/L為臨界值,其靈敏度和特異度分別為86.1%、64.1%,而兩者聯合診斷的靈敏度和特異度分別為89.6%、68.5%。見表3、圖1。
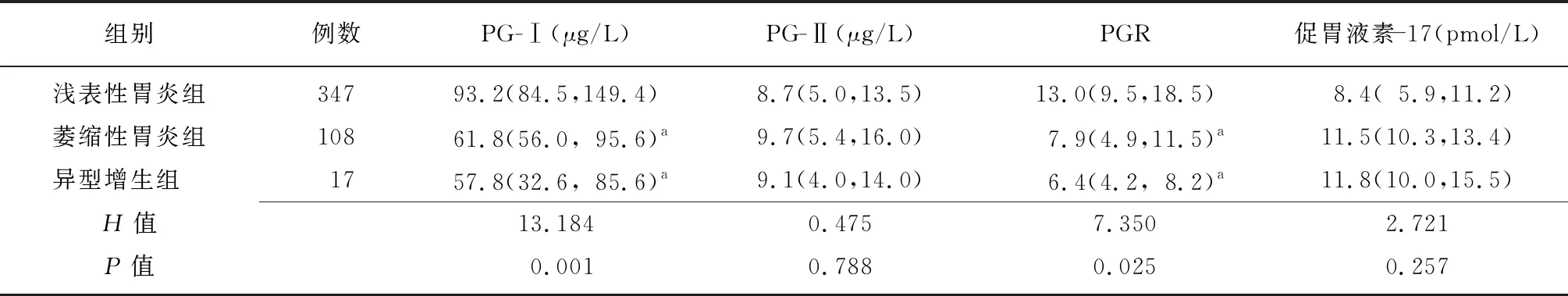
表1 不同病理分型患者PG-Ⅰ、PG-Ⅱ、PGR及促胃液素-17比較 [M(P25,P75)]

表2 不同萎縮部位萎縮性胃炎患者PG-Ⅰ、PG-Ⅱ、PGR及促胃液素-17比較 [M(P25,P75)]
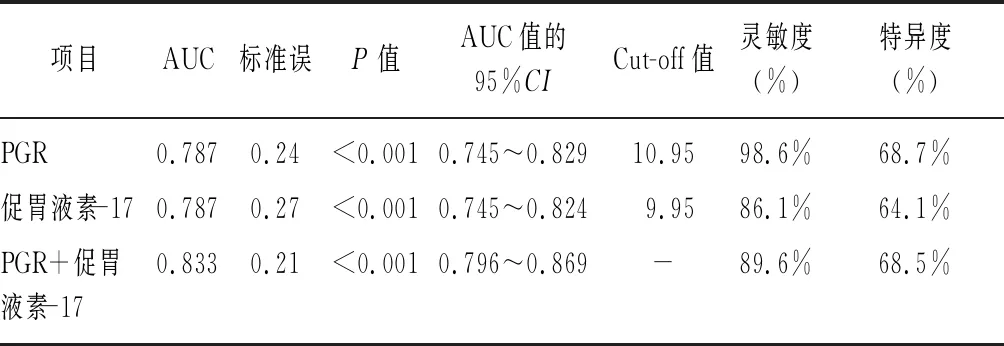
表3 PG和促胃液素-17診斷萎縮性胃炎的ROC曲線分析
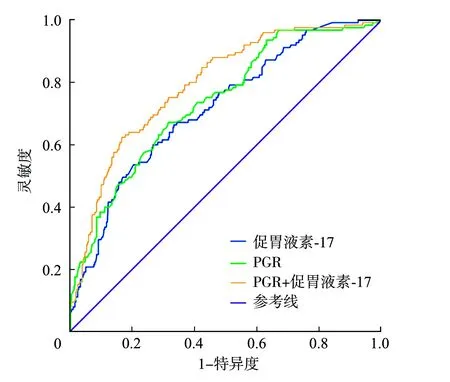
PGR:胃蛋白酶原-Ⅰ/胃蛋白酶原-Ⅱ比值;ROC:受試者工作特征曲線
2.5淺表性胃炎組與胃癌癌前病變組血清學指標異常檢出率比較 兩組血清PGR≤10.95和促胃液素-17≥9.95 pmol/L的檢出率比較差異無統計學意義(P>0.05),胃癌癌前病變組PGR與促胃液素-17聯合檢測檢出率高于淺表性胃炎組(P<0.05)。見表4。
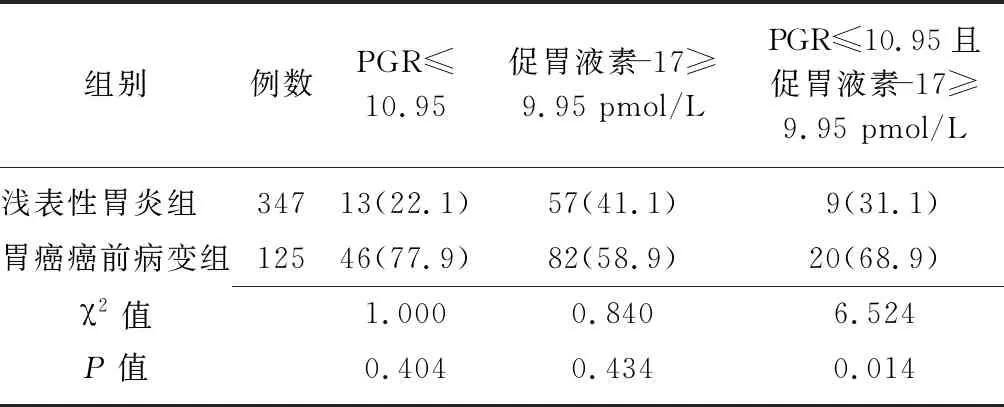
表4 淺表性胃炎組與胃癌癌前病變組血清學指標異常檢出率比較 [例(%)]
3 討 論
據統計,全球近半數新增和死亡的胃癌病例發生在中國,我國作為胃癌的高發國,如何降低胃癌的發病率和死亡率是亟須解決的重大問題[10-11]。萎縮性胃炎、腸上皮化生、異型增生是胃癌發展過程中重要的癌前病變。荷蘭的一項大規模回顧性研究發現,萎縮性胃炎患者5年內的胃癌年發生率為0.1%,腸上皮化生發生率為0.25%,輕度至中度不典型增生的發生率為0.6%,重度不典型增生的發生率高達6%[12]。因此,胃癌癌前病變的早期診斷成為目前研究的熱點。我國2017年“中國早期胃癌篩查流程專家共識意見”中,將血清PG和促胃液素-17納入早期胃癌篩查的重要指標[13]。
PG是起源于胃黏膜消化酶的前體酶,在生化和免疫學上分為PG-Ⅰ和PG-Ⅱ兩大類。血清PG-Ⅰ水平降低提示胃黏膜腺體萎縮;PG-Ⅱ由胃底腺、胃竇幽門腺和近端十二指腸Brunner腺分泌,PGR可很好地反映胃黏膜的形態和功能狀態[14-15]。血清PG在我國胃癌癌前病變的篩查中有一定的應用價值,本研究結果顯示,萎縮性胃炎組和異型增生組患者血清PG-Ⅰ、PGR水平明顯低于淺表性胃炎患者(P<0.05)。李夢穎等[15]研究發現,與非萎縮性胃炎組相比,胃癌癌前病變組和胃癌組血清PG-Ⅰ、PGR水平明顯降低。一項基于時間和胃癌癌前病變進展的縱向研究發現,血清PG水平降低與胃癌癌前病變的進展密切相關[11]。由此可見,在萎縮、腸化、異型增生等胃黏膜改變過程中,腺體細胞萎縮導致腺體分泌功能下降,血清PG水平發生變化,提示胃黏膜的不同病變狀態,臨床上可通過分析PG表達水平以評估胃癌癌前病變發生的可能性,為深入研究胃癌癌前病變的進展、探索早期臨床診斷方法以及易感人群篩查及后續追蹤提供一定依據。
促胃液素-17是胃竇和十二指腸G細胞分泌的一種重要的胃腸激素,是反映胃竇內分泌功能的敏感指標之一,可提示胃竇黏膜是否存在異常增殖[16-17]。王冬梅等[18]通過胃癌組織體外研究發現,促胃液素可激活細胞增殖和炎癥反應等信號通路,增強胃癌細胞體外增殖能力。血清促胃液素-17可作為判斷胃黏膜病變的重要指標。張玲霞等[19]分析不同萎縮部位萎縮性胃炎患者血清學變化的研究發現,胃竇萎縮和全胃萎縮患者血清促胃液素-17水平明顯降低。國外一項觀察性病例對照研究發現,無論是胃竇萎縮性胃炎患者還是已切除胃竇部位的患者,血清促胃液素-17水平均降低[20]。本研究結果顯示,胃竇萎縮和胃竇與胃體均萎縮患者血清促胃液素-17水平明顯低于胃體萎縮者,與上述研究一致。血清促胃液素-17主要由胃竇G細胞產生,當胃竇萎縮時,G細胞數量明顯減少,進而血清促胃液素-17水平明顯降低。不同病變部位促胃液素-17水平變化不同,促胃液素-17可間接反映胃黏膜病變。由于本研究樣本量有限、取材部位不一致等,不同病理分型患者的促胃液素-17水平比較差異無統計學意義。
本研究對血清PGR和促胃液素-17進行ROC曲線分析發現,兩者聯合檢測萎縮性胃炎的預測效能高于單獨檢測。不同研究有關胃癌和萎縮性胃炎等篩查值的差異較大,可能與患者所在地域文化差異、衛生習慣、年齡、性別構成等因素相關。由于本研究樣本來源較單一、樣本量較少、取材部位有限,仍需進一步分析研究。
綜上所述,血清PG、促胃液素-17可用于胃癌癌前病變篩查,促胃液素-17水平下降提示胃竇萎縮有獨特優勢,兩者聯合檢測對萎縮性胃炎的預測效能高于單獨檢測;且PGR和促胃液素-17可作為胃癌癌前病變的篩查指標,對異常人群進一步行胃鏡檢查,有助于更準確地識別胃癌癌前病變,并為研發新的早期干預手段提供依據。

