不同途徑注射腫瘤RNA 納米脂質體疫苗對結腸癌生長的影響
盧光照,張 翮,樊 莉,孫治國,魯 瑩 (海軍軍醫大學藥學系藥劑學教研室, 上海 200433)
腫瘤RNA 是目前已知腫瘤疫苗的來源之一[1-2]。先前的研究表明,從CT26 結腸癌細胞提取的腫瘤RNA 可以通過增強機體抗腫瘤免疫來抑制腫瘤生長[3],但由于腫瘤RNA 易降解、不穩定等特性,需要載體對其包裹后實施注射,從而發揮其抗腫瘤作用[4]。研究證實,納米脂質體載體具有較強的穩定性,可有效地包裹RNA,并在體內和體外遞送核酸,發揮核酸誘導或抑制細胞表達的作用[5-7]。然而,機體不同部位對藥物的吸收情況不同,因此,導致藥物吸收轉化的效果產生差異。為了比較不同部位注射對藥物治療效果的影響,本研究從CT26結腸癌細胞中提取腫瘤RNA,并使用納米脂質體對其進行包裹制備成納米脂質體疫苗,分析了不同部位注射腫瘤RNA 納米脂質體疫苗所產生的增強機體抗腫瘤反應的情況。
1 材料和方法
1.1 材料
1.1.1 主要儀器
R205B 旋轉蒸發器(上海申科科技有限公司);610000-1EA 型薄膜擠出器(美國Avanti 公司);必能信Sonifier?450D 超聲波粉碎儀(美國必能信公司);馬爾文粒徑儀(英國馬爾文儀器公司);透射電子顯微鏡 JEM2100F(日本JEOL 公司);染色封片工作一體機(膠帶)Prisma+ Film(日本櫻花公司)。
1.1.2 主要試劑
(2,3-二油酰基-丙基)-三甲胺硫酸鹽((N-1-(2, 3-dioleoyloxy) propyl)-N,N,N-trimethylammoniumethyl sulfate, DOTAP)(美國Avanti Polar Lipids 公司);二硬脂酰基磷脂酰乙醇胺-聚乙二醇-羧基(1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-(carboxy(polyethylene glycol)-2000) (sodium salt),DSPE-PEG(2000) Carboxylic Acid)(美國Avanti 公司);魚精蛋白、小牛胸腺DNA(美國Sigma 公司);膽固醇(上海麥克林生化科技有限公司);氯仿(中國醫藥集團有限公司);DEPC 水(碧云天生物技術有限公司);TRIzol RNA 分離試劑(美國Thermo 公司);CT26 小鼠結腸癌細胞系(中國科學院典型培養物保藏委員會細胞庫),SPF 級 BALB/c 雄性小鼠(上海吉輝實驗動物飼養有限公司),飼養于屏障系統中。
1.2 方法
1.2.1 薄膜水化法(lipid-film method)制備DOTAP/Chol 納米脂質體
首先取膽固醇、DOTAP 兩種材料的氯仿溶液,將二者以1∶1 (m∶m)的比例加入到250 ml 的茄型瓶中,隨后再加入4 ml 氯仿溶液。在真空、45 ℃及100 r/min 條件下旋轉蒸發45 min,再加入3 ml DEPC 水,在45 ℃及100 r/min 條件下旋轉蒸發45 min,獲得脂質體混懸液。先進行超聲20 min,再先后通過聚碳酸酯膜(100、50 nm),反復擠出各20 次,即得DOTAP/Chol 納米脂質體。
1.2.2 CT26 腫瘤細胞RNA 提取
取長滿培養皿的CT26 細胞,倒去培養基,加入3 ml 無菌PBS 溶液,并輕晃幾下進行清洗,然后按照TRIzol? Reagent 操作說明提取RNA。提取完成后,將核酸溶液用NanoDrop 2000 測A值、濃度和純度。將檢測完成后的核酸溶液分裝至1.5 ml EP 管中,隨后放入液氮中保存。
1.2.3 腫瘤RNA 納米脂質體疫苗的制備
準備DOTAP/Chol 脂質體疫苗63 μl,魚精蛋白12 μl(2 μg/μl)和DEPC 水10 μl,將上述材料混合,于室溫放置 10 min,得到DOTAP/Chol 脂質體和魚精蛋白的混合物,在45~50 ℃的范圍內水浴加熱1~2 min。準備腫瘤RNA 45 μl(0.5 μg/μl),小牛胸腺 DNA 1.2 μl(10 μg/μl)和DEPC 處理水30 μl,將以上材料混合,并室溫放置10 min,得到腫瘤RNA 與小牛胸腺DNA 的核酸聚合物,將DSPEPEG(2000) Carboxylic Acid 3.2 μl(10 μg/μl)加入到RNA/DNA 聚合物中,在45~50 ℃的范圍內水浴加熱1~2 min,得到RNA/DNA/PEG 復合物。將納米脂質體/魚精蛋白復合物加入到 RNA/DNA/PEG復合物中,常溫放置 10 min。最后將混合物放入55 ℃的環境中靜置10 min,然后在常溫環境中靜置 10 min,即可得腫瘤RNA 納米脂質體疫苗。
1.2.4 馬爾文激光粒徑儀檢測
稀釋腫瘤RNA 納米脂質體疫苗至適當濃度,取1 ml 進行粒徑檢測。選擇干凈的樣品池,取腫瘤RNA 納米脂質體疫苗溶液小心加入,在加入的同時避免氣泡產生。把樣品池放入進樣樣品槽中,然后進行粒徑檢測。對于脂質體放置穩定性試驗,將脂質體放置于4 ℃,在第1、3、5、7 天取樣測量粒徑。
1.2.5 透射電鏡檢測
將10 μl 的脂質體疫苗溶液緩慢滴加在銅網上,在室溫下徹底風干。隨后滴加2%磷鎢酸溶液,并使用濾紙吸干多余液體,后在室溫下徹底干燥。之后將檢測銅網放置在透射電鏡下進行觀察。
1.2.6 荷瘤小鼠模型的建立、給藥和分組
實驗開始后,取對數生長期的CT26 細胞,計數為1×106/ml,在小鼠右側背部近腋窩處接種,每只小鼠皮下接種CT26 細胞100 μl(1×105個/只),構建小鼠結腸癌移植瘤模型。接種1 周后按照實驗方案接種相應脂質體疫苗溶液,頻率為每7 天一次,一共3 次。其中,PBS 組(n=5)的小鼠進行常規飼養,每只小鼠腹腔注射200 μl 的 PBS 作為空白對照。腫瘤RNA 納米脂質體疫苗腹腔注射組(n=5)的小鼠進行常規飼養,每只小鼠腹腔注射200 μl 的腫瘤RNA 納米脂質體疫苗,注射頻率為每7 天一次,共注射 3 次;腫瘤RNA 納米脂質體疫苗皮下注射組(n=5)的小鼠進行常規飼養,每只小鼠左側皮下注射200 μl 的腫瘤RNA 納米脂質體疫苗,頻率為每7 天一次,共注射3 次;當腫瘤體積達到2 000 mm3時處死小鼠,并提取實驗小鼠各項指標進行分析。
1.2.7 組織冰凍切片的制備
動物實驗結束后,將小鼠處死,之后將移植瘤腫瘤團塊完全剝離,小心去除腫瘤周圍的結締組織和血管,使用PBS 浸泡清洗干凈后,使用干凈濾紙將水吸干,浸沒置于4%多聚甲醛中以4 ℃保持。同時,將各組實驗小鼠處死后,將心、肝、脾、肺、腎完整剝離,去除結締組織和血管,使用PBS 浸泡清洗干凈后,使用干凈濾紙將水吸干,浸沒置于4%多聚甲醛中以4 ℃保持。將需要處理的組織塊放入合適的耐液氮的冰凍小盒中,將冰凍小盒緩緩放入液氮中,使其徹底浸沒在液氮中,浸沒約20 s左右,使組織塊能夠徹底冰凍成塊。組織塊冰凍成塊后,取出冰凍塊,快速使用已涂抹有冰凍包埋劑的塑料薄膜進行包封,然后將已經包封好的組織塊和切片凍頭放入冰箱進行保存備用,冰箱溫度設置為-80 ℃。按照冰凍切片機器操縱要求進行冰凍切片,切片厚度控制在20~30 μm 左右,然后,將切片樣品放入-20 ℃的冰箱進行保存。使用染色封片工作一體機(膠帶)Prisma+ Film,按照操作說明進行染色及封片操作。使用數字切片掃描系統PRECICE 500 進行圖像采集分析。
1.2.8 統計學處理方法
2 結果
2.1 腫瘤RNA 納米脂質體疫苗的表征
將從CT26 細胞中提取的RNA 使用NanoDrop 2000 進行檢測,OD260/OD280 為2.04(圖1A),OD260/OD230 為1.96,符合RNA 需達到OD260/OD280>2.0,1.8<OD260/OD230<2.2 的要求,且濃度達到1 762.1 ng/ml,滿足后續實驗需要。制備腫瘤RNA 納米脂質體疫苗,通過馬爾文激光粒度測定儀對腫瘤RNA 納米脂質體疫苗進行了電位檢測,結果顯示其Zeta 電位為(3.39±0.56)mV(圖1B),可以降低脂質體疫苗的聚合從而增加其穩定性。通過透射電子顯微鏡檢測發現,我們制備的腫瘤RNA 納米脂質體疫苗形態規則、呈球形、分布均勻,且粒徑大小為(120.0±12.1)nm (圖1C)。通過測量不同時間的脂質體疫苗的粒徑大小,結果發現放置在4 ℃冰箱的脂質體在7 d 內粒徑基本維持在120 nm,脂質體放置穩定性良好(圖1D)。
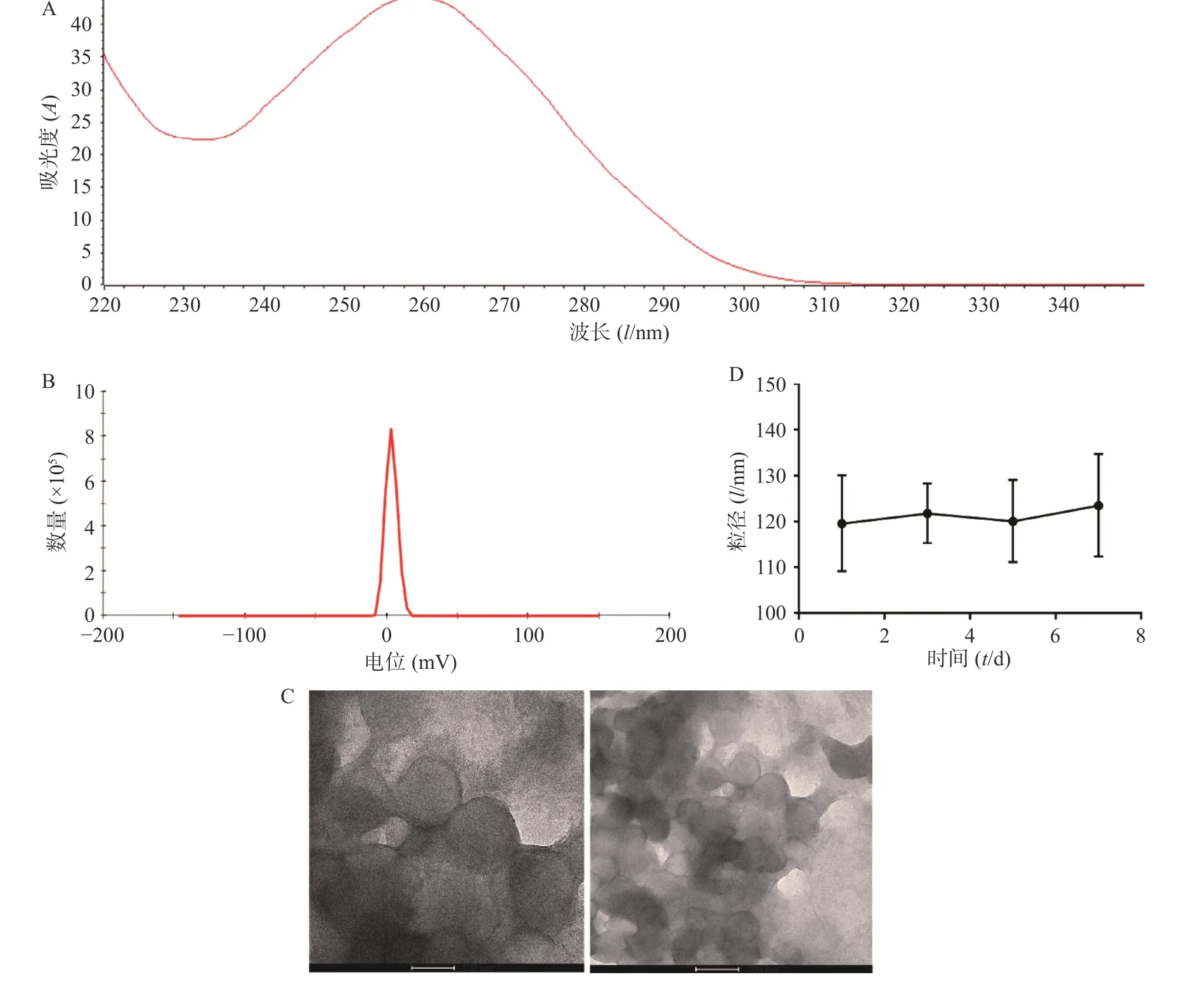
圖1 腫瘤RNA 納米脂質體疫苗的表征
2.2 腫瘤RNA 納米脂質體疫苗不同途徑注射對小鼠結腸癌生長的影響
通過完整剝離各組織移植瘤,我們可以直觀看到,腹腔注射組比PBS 空白對照組、皮下注射組其腫瘤體積更小(圖2A)。同時,對各組移植瘤進行稱重測量比較(P<0.01,圖2B),腹腔注射組比PBS 組及皮下注射組平均移植瘤重量更小,腫瘤生長抑制更加明顯。由于結腸癌的大小與腫瘤微血管密度呈正相關性,通過對各組移植瘤H&E 染色(圖2C),發現與PBS 組相比,腹腔注射組和皮下注射組在同一視野下腫瘤微血管密度更小,其中,腹腔注射組微血管密度最小。
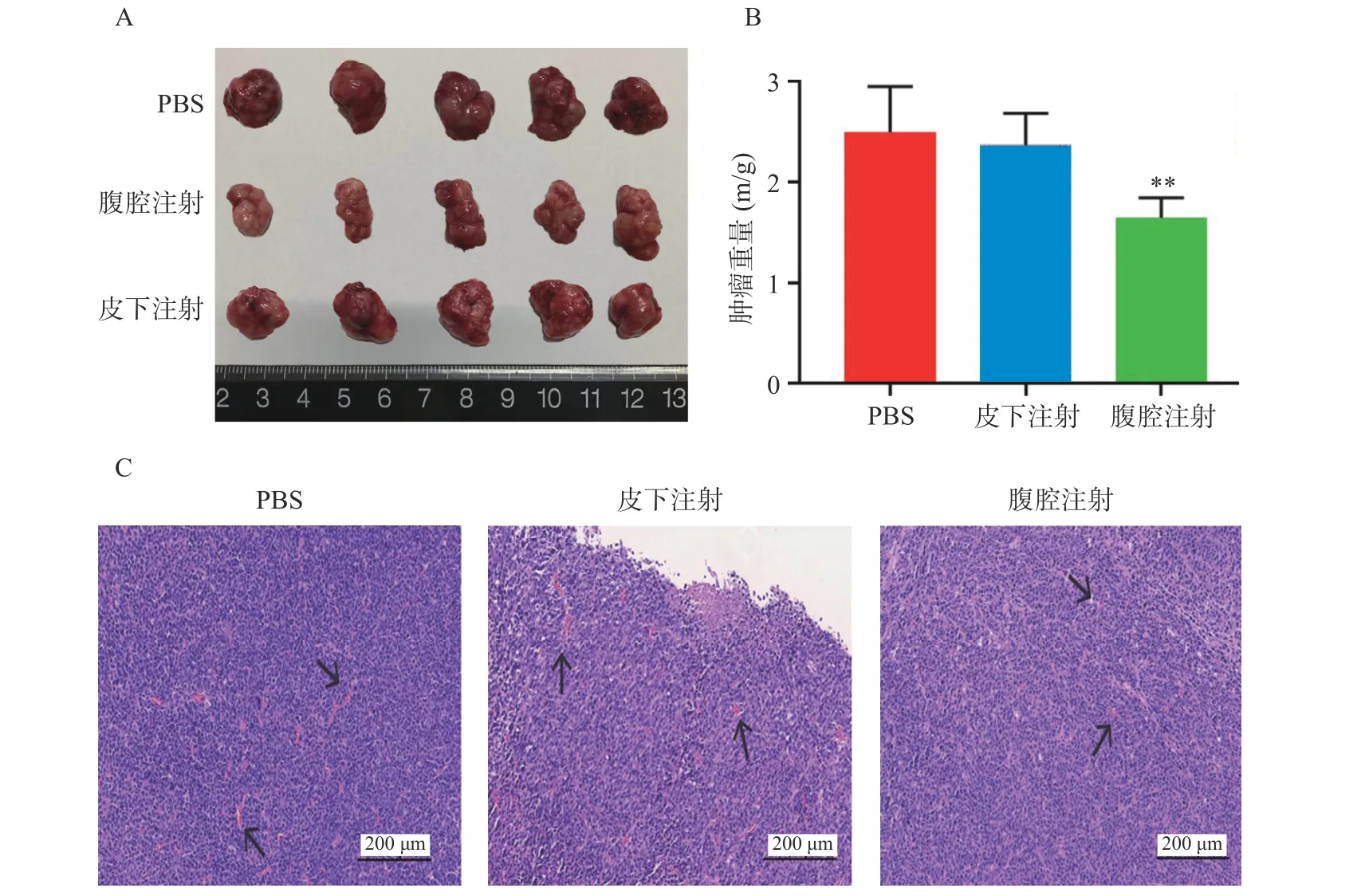
圖2 腫瘤RNA 納米脂質體疫苗不同途徑注射對小鼠結腸癌生長的影響
2.3 腫瘤RNA 納米脂質體疫苗不同部位注射對小鼠免疫情況影響
通過完整剝離各組脾臟,我們發現腹腔注射組小鼠的脾臟大于PBS 組和皮下注射組(圖3)。脾臟是機體重要的免疫器官,在機體抗腫瘤免疫反應中,其大小在一定程度上反應了機體抗腫瘤免疫反應應答強度和免疫水平。因此腹腔注射增強腫瘤RNA 的機體抗腫瘤免疫反應的效果更加明顯。

圖3 腫瘤RNA 納米脂質體疫苗不同部位注射對小鼠脾臟大小的影響(n=5)
2.4 腫瘤RNA 納米脂質體疫苗對各臟器毒性影響的變化情況
實驗結束后,完整剝離小鼠的心、肝、脾、肺、腎等主要臟器并進行H&E 染色(圖4),結果顯示,各組的主要臟器中沒有出現異常的組織學改變,腫瘤RNA 對機體毒性影響很小,安全性較高。
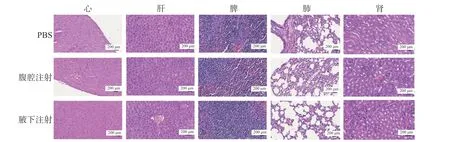
圖4 腫瘤RNA 納米脂質體疫苗注射后小鼠各臟器的H&E 染色(10×)
3 討論
根據2020 年全球統計的數據,1930 萬新增癌癥病例中,結腸直腸癌占10.0%,位居第三。在近1 000萬癌癥死亡相關病例中,結腸直腸癌占了9.4%,排在第二位[8]。同時,近10 年間,結直腸癌的發病率在我國呈直線上升趨勢。因此,我們迫切需要制訂新的策略以治療結直腸癌[9]。研究表明,腫瘤RNA攜帶有特異性腫瘤抗原,其腫瘤抗原無需檢查,并且RNA 序列進入宿主基因組內的危險性很小,是優質的腫瘤疫苗來源。此外,有進一步的研究證明,從CT26 結腸癌細胞提取的腫瘤RNA 可通過增強生物體抗腫瘤免疫來抑制結腸癌生長[1-3]。因此,不同部位注射負載腫瘤RNA 的納米脂質體疫苗的抗腫瘤效果值得進一步探討,為其后續的進一步應用提供理論基礎。
納米脂質體疫苗注射途徑種類較多,如靜脈注射、動脈注射、肌內注射、皮下注射、腹腔注射等方式[10-13],研究證明,通過不同部位注射藥物,其生物利用度也不同。本研究對移植瘤小鼠進行了不同部位腫瘤RNA 納米脂質體疫苗注射,并分析比較不同部位注射所產生的影響,結果顯示,腹腔注射可以抑制腫瘤生長,值得注意的是,腹腔注射后的腫瘤更小、腫瘤微血管密度最低[14-15],因此,腹腔注射抑制腫瘤生長的效果更加顯著。根據相關研究,如果藥物注射部位周圍血液循環及淋巴液循環豐富,那么藥物吸收路徑較短,較少受到各種影響因素的干擾,會表現出更好的治療效果,而腹腔中血液循環和淋巴循環分布較皮下更為豐富,因此腹腔注射表現出更好的治療效果[16-18]。
此外,在本研究中,負載腫瘤RNA 的納米脂質體疫苗的形狀為球型體,粒徑大小為(120.0±12.1)nm,Zeta 電位為(3.39±0.36)mV。實驗提示,腫瘤RNA納米脂質體疫苗組能夠引起機體免疫器官脾臟增大[19],并和治療效果呈正相關。同時在各治療組及對照組的實驗結束后,小鼠各個重要臟器未發生病理改變。所以腹腔注射是更適合腫瘤RNA 納米脂質體疫苗藥物注射的途徑,這與腹腔血液循環和淋巴循環更加豐富有關,使納米級的腫瘤RNA 納米脂質體疫苗能夠更好更高效地被機體自身吸收利用,進而能夠更有效地增強機體自身抗腫瘤免疫反應,并更有力地抑制腫瘤生長及發展。
綜上,本研究對同等大小移植瘤小鼠進行了不同部位負載腫瘤RNA 的納米脂質體疫苗注射的動物治療實驗。實驗結果顯示,相較于皮下注射,腹腔注射能夠更加有效地提高機體抗腫瘤免疫反應并抑制腫瘤生長。

