基于表面等離子體共振技術篩選STAT3 小分子抑制劑的研究
蘇曉薇,張華林,張 寧,楊 犇,許維恒,張俊平 (. 福建中醫藥大學藥學院 福建 福州 5008;. 陸軍第八十一集團軍醫院 河北 張家口 07500;. 海軍軍醫大學藥學院 上海 004)
STAT3 是一種重要的轉錄因子,參與眾多細胞因子和生長因子受體的信號轉導,在細胞生長和細胞凋亡等多種細胞過程中發揮著關鍵作用[1-2]。STAT3 的活化可以通過刺激白介素-6 受體(IL-6R)、Janus 酪氨酸激酶、BCR-ABL 和SRC 家族激酶等來啟動[3]。STAT3 經磷酸化活化后形成同源和異源二聚體,并易位至細胞核,發揮轉錄激活因子的作用[4-6]。目前,越來越多的證據顯示,多種惡性腫瘤存在STAT3 的過度激活,包括前列腺癌、肺癌、乳腺癌、皮膚癌和宮頸癌等,抑制STAT3 的磷酸化成為一種很有前景的治療策略。此外,STAT3還與肝損傷、纖維化、風濕性關節炎、心肌缺血等疾病有關[7]。盡管一些STAT3 抑制劑正在進行臨床試驗,但迄今為止尚未批準STAT3 抑制劑用于癌癥的治療。因此,仍然迫切需要發現潛在的STAT3 抑制劑[8]。
SPR 是一種光學生物傳感技術,該技術利用光學測量的折射率變化,分析樣品與固定在SPR 傳感器上的分子的結合情況。因其無需標記樣品,具有高靈敏度,能實時檢測生物分子間的相互作用而被廣泛運用于醫療檢測、藥物篩選、環境監測和食品檢測等領域[9]。
本課題采用SPR 技術從中藥單體中篩選能與STAT3 特異性結合的小分子化合物,通過蛋白免疫印跡技術和雙熒光素酶報告基因考察小分子對STAT3 的抑制作用,采用分子對接技術擬合化合物與STAT3 的結合模式,明確其可能的作用位點,從而為STAT3 抑制劑的發現提供理論指導和實踐經驗。
1 材料與方法
1.1 實驗材料
1.1.1 實驗試劑
DMSO(美國Sigma 公司);EDC/NHS(GE 公司);胰酶(美國Gibco 公司);DMEM 培養基(美國Corning 公司);胎牛血清(美國Gibco 公司);細胞裂解液、PMSF、30%丙烯酰胺溶液、1.5 mol/L Tris(pH=8.8)、1.0 mol/L Tris(pH=6.8)、10%SDS、TEMED、BCA 試劑盒、雙熒光素酶報告基因檢測試劑盒(上海碧云天生物技術有限公司);硝酸纖維素膜(德國Sartorius Stedim 公司);轉染試劑(美國Life Technology 公司)
1.1.2 實驗儀器
Biacore T2000(GE 醫療生命科學公司);電子天平(上海天平儀器廠);電泳儀(美國Bio-Rad 公司);制冰機(德國Eppendorf 公司);-80℃低溫冰箱(美國Thermo 公司);CO2細胞培養箱(美國Thermo 公司);離心管(美國Corning 公司);低溫高速臺式離心機(美國Thermo 公司);移液槍(德國Eppendorf 公司);超純水儀(美國Millipore 公司);多功能酶標儀(美國Thermo 公司)。
1.1.3 實驗細胞
HeLa 細胞(購自上海碧云天生物科技有限公司,由本實驗室凍存、培養);HeLa-STAT3-Luc 細胞(由本實驗室構建、培養、凍存)。
1.2 實驗方法
1.2.1 Biacore 鑒定STAT3 特異性結合小分子(1)STAT3 預富集
將STAT3 純化蛋白用去離子水溶解并配成1 g/L的蛋白母液,用4 種不同pH 的醋酸鹽緩沖液(pH4.0、pH4.5、pH5.0、pH5.5)稀釋蛋白母液至50 mg/L,進樣,于Biacore 預富集系統檢測不同pH 條件下蛋白STAT3 的響應值,確定最佳蛋白偶聯條件。
(2) STAT3 偶聯
在預富集實驗中所得最佳pH 條件下,將STAT3稀釋至50 mg/L,通過EDC/NHS 活化CM5 芯片表面羧基,然后通過羧基氨基縮合反應將STAT3 鍵合到CM5 芯片上,乙醇胺封閉未結合的羧基,從而實現STAT3 偶聯到CM5 芯片上的目的。
(3)親和力分子
將中藥小分子單體化合物用DMSO 溶解,然后用PBS 稀釋成32 μmol/L (DMSO 終濃度為5%)的樣品后進樣,流動相為5%DMSO 的PBS 溶液,通過Biacore 系統分析其流過STAT3 蛋白表面的響應值,篩選出對STAT3 響應值較高(高于陽性對照或與其相當)的單體化合物作為候選化合物。
(4)動力學分析
將候選化合物濃度以二倍比進行梯度稀釋,濃度范圍為0.062 5~64 μmol/L(DMSO 終濃度均為5%),通過Biacore 系統分析獲得結合響應值,根據響應值與候選化合物濃度之間的量效關系繪制動力學曲線,根據曲線擬合情況判斷候選化合物與STAT3 的結合特異性,從而找到能與STAT3 蛋白特異性結合的小分子單體。
1.2.2 蛋白免疫印跡(Western-blot)檢測化合物對STAT3 磷酸化的抑制情況
HeLa 細胞以5×105個/孔接種于6 孔板,于37 ℃、5%CO2細胞培養箱中培養過夜。次日,加入不同濃度的化合物,作用24 h 后,加入100 μl Western及IP 細胞裂解液(含1 mmol/L PMSF),冰上裂解25 min,收集蛋白于1.5 ml 離心管,12 000 r/min,4 ℃離心10 min,吸取上清液,使用BCA 蛋白定量試劑盒進行總蛋白定量。蛋白樣品中加入5×蛋白上樣緩沖液,煮沸5 min,進行SDS-PAGE 凝膠電泳。電泳結束后,在250 mA 恒流電下將蛋白從凝膠轉移到NC 膜上,5%脫脂牛奶封閉,進行一抗(p-STAT3/STAT3)、二抗孵育,結束后在紅外雙色激光成像系統(Odyssey)上掃膜檢測700 和800 通道激發的熒光信號,觀察各泳道中蛋白表達情況。
1.3 雙熒光素酶報告基因鑒定化合物抑制STAT3磷酸化的作用
HeLa-STAT3-Luc 細胞計數后按1×105個/孔接種于24 孔板,置于37 ℃、5%CO2細胞培養箱中培養24 h,加入不同濃度化合物孵育4 h,然后加入IL-6(100 ng/ml)和IL-6R(100 ng/ml)共同刺激24 h,棄上清液,每孔加入120 μl 細胞裂解液,離心后取5 μl 上清液轉移至新的384 孔板,每孔加入25 μl 熒光素酶1 液,使用多功能酶標儀檢測熒光值,然后加入25 μl 熒光素酶2 液,再次測熒光值,定內參。
1.4 分子對接技術
分子對接以Protein Preparation Wizard 模塊處理蛋白,選擇STAT3 蛋白與小分子抑制劑的晶體復合物6NUQ,依次去水、加氫,以LigPrep 模塊處理配體,力場優化均采用OPLS2005 模式,其余參數均使用默認;以Grid 模塊建立蛋白對接坐標,范德華力半徑設置為1.0;采用精確對接模式(XP)的方法進行對接,對接結果用PyMol 軟件作圖。
1.5 統計學分析
2 實驗結果
2.1 Biacore 系統預富集STAT3 蛋白
為了研究STAT3 蛋白的最佳偶聯條件,采用不同pH 的醋酸鹽緩沖液稀釋蛋白,進行預富集分析,結果顯示STAT3 在pH4.0 的條件下響應值最高(圖1)。因此,后續實驗選擇pH4.0 的緩沖液進行偶聯。

圖1 不同pH 條件下STAT3 芯片富集情況
2.2 Biacore 系統偶聯STAT3 蛋白
取市售的STAT3 蛋白用pH4.0 醋酸鹽緩沖液稀釋至50 mg/L,通過Biacore 系統的內置程序偶聯到CM5 芯片上,結果顯示STAT3 偶聯量為8 000 RU,達到預計偶聯水平(圖2)。
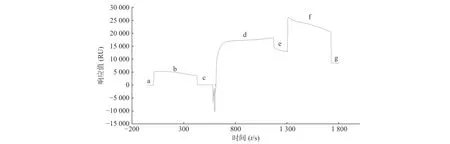
圖2 Biacore 系統STAT3 蛋白偶聯情況
2.3 篩選中藥單體小分子化合物
為了篩選能夠結合STAT3 蛋白的小分子化合物,我們將50 種中藥單體統一稀釋到32 μmol/L,利用Biacore 系統檢測結合情況,通過響應值觀察小分子與STAT3 蛋白的結合強度。結果發現,不同小分子化合物與STAT3 蛋白的結合存在差異(圖3),我們以陽性對照(C188-9)為標準,篩選響應值不低于陽性對照響應值的化合物,得到了梓醇(catalpol)、黃芩素(baicalein)、芹黃素(apigenin)、槲皮素(quercitrin)、人參皂苷(ginsenoside)、京尼平苷酸(geniposidic acid)、桑辛素(morusin)等10 多種小分子作為候選化合物,接著進行動力學分析以確定它們與STAT3 蛋白的結合特異性。

圖3 50 種中藥單體在Biacore 系統中與STAT3 蛋白結合響應的情況
2.4 候選化合物的動力學分析
為了驗證候選化合物與STAT3 蛋白的結合是否為特異性結合,我們將候選化合物進行梯度稀釋,通過Biacore 系統分析獲得結合響應值,繪制動力學結合曲線。對10 多種化合物均進行動力學分析,發現只有芹黃素與STAT3 的結合具有特異性。芹黃素與STAT3 的結合響應值隨著藥物濃度的增大而升高,當濃度增大到一定值時響應值呈水平趨勢不再變化,說明高濃度芹黃素同STAT3 的結合存在飽和現象,即芹黃素與STAT3的結合為特異性結合(圖4)。因此,選擇芹黃素作為可能的STAT3 抑制劑進行生物學驗證。

圖4 特異性結合動力學曲線
2.5 Western-blot 檢測結果
動力學分析結果證實芹黃素可以特異性結合STAT3,為了確證芹黃素對STAT3 磷酸化的抑制作用,我們利用IL-6 誘導活化STAT3,通過Western-blot 檢測芹黃素對STAT3 磷酸化的抑制作用。結果發現,IL-6 可以顯著刺激HeLa 細胞STAT3 的活化,而芹黃素能劑量依賴地抑制IL-6 誘導的STAT3 磷酸化,表明芹黃素可能是STAT3的抑制劑(圖5)。

圖5 Western-blot 檢測芹黃素抑制STAT3 磷酸化效果
2.6 雙熒光素酶報告基因檢測結果
為了進一步確證芹黃素對STAT3 的抑制作用,我們采用雙熒光素酶報告基因系統研究芹黃素對STAT3 轉錄活性的影響。結果顯示,IL-6 刺激可以顯著促進STAT3 的轉錄活性,10μmol/L、20 μmol/L芹黃素能夠抑制IL-6 誘導的STAT3 轉錄活性的增加(圖6)。以上結果表明芹黃素能夠抑制STAT3的轉錄活性,進一步證實芹黃素是STAT3 的小分子抑制劑。

圖6 雙熒光素酶報告基因檢測芹黃素抑制STAT3 活化的能力
2.7 分子對接結果
為了明確STAT3 與芹黃素的相互作用情況,我們采用分子對接技術分析STAT3 與芹黃素的結合位點。結果顯示,芹黃素結合于STAT3 蛋白的SH2 結構域,占據了STAT3 磷酸絡氨酸的結合口袋。與關鍵殘基Glu638、Gln644、Gly656、Lys658形成氫鍵相互作用,與Tyr657 殘基形成π-π 相互作用(圖7)。

圖7 芹菜素與STAT3 蛋白(PDB: 6NUQ)的結合模式擬合圖
3 討論
STAT3 在腫瘤中的持續激活和過度表達與腫瘤細胞的多種惡性生物學特征密切相關。STAT3的活化受多種細胞因子、生長因子,生長因子受體,非受體蛋白酪氨酸激酶等多重信號分子的調控,目前已成為腫瘤治療領域的研究熱點之一[10]。 STAT3存在6 個結構域,包括氨基末端結構域(NTD)、卷曲螺旋結構域(CCD)、DNA 結合結構域(DBD)、接頭結構域、Src 同源結構域(SH2)和羧基末端反式激活(TAD)結構域。目前,對STAT3 的直接抑制作用可以通過破壞SH2、DBD 或NTD 結構域來阻止功能性STAT3 二聚體的形成。STAT3 的直接抑制劑主要分為三類:肽,小分子抑制劑和寡核苷酸。間接抑制劑則通過靶向STAT3 信號通路阻斷上游信號通路(如IL-6 和JAK 通路)間接抑制STAT3[11-12]。目前,STAT3 抑制劑的研發已成為腫瘤治療領域的研究熱點之一。
芹黃素是一種天然黃酮類化合物,具有抗炎、抗氧化和抗癌作用[13],其在多種癌癥中(如乳腺癌、肺癌、肝癌、前列腺癌等)表現出對細胞的生長抑制與促凋亡作用。芹黃素不僅能夠通過內源性與外源性凋亡途徑促進細胞凋亡,也能通過降低基質金屬蛋白酶-2,-9 的表達抑制腫瘤細胞侵襲[14]。但是,芹黃素與STAT3 的關系尚未研究,其對STAT3的抑制作用也沒有報道。
本研究利用表面等離子體共振技術,從50 個中藥單體中篩選出能與STAT3 特異性結合的小分子化合物芹黃素,然后運用Western-blot、雙熒光素酶報告基因實驗證實了芹黃素對STAT3 的抑制作用。采用分子對接技術分析STAT3 與芹黃素的結合位點,結果揭示芹黃素主要通過結合STAT3 的SH2 結構域抑制其磷酸化。本研究為芹黃素抗癌作用提供了理論基礎,同時,也為發現STAT3 及其他藥物靶點的小分子抑制劑提供了研究經驗。

