原發性人腦膠質瘤的預后影響因素:基于SEER數據庫的分析
李新宇 尚洵杰 夏 彤 郭智霖
膠質瘤是一種來自神經上皮組織的腫瘤,發病率在(4.67~5.73)/10 萬人年[1],是中樞神經系統最常見的原發性腫瘤[2]。膠質瘤具有侵襲性生長和對放化療敏感性差的特性,與正常組織缺乏明顯分界,手術難以全切除。目前,膠質瘤缺乏根治手段,在常規治療下,膠質瘤的生存期較短,5年總體生存率約為4%[3],高級別腦膠質瘤術后平均生存期仍不到1.5年[4]。雖然膠質瘤的治療已取得長足的進步,但延長生存期仍面臨巨大挑戰[4]。美國國立癌癥研究所監測、流行病學及結局項目數據庫(Surveillance,Epidemiology and EndResultsProgram,https://seer.cancer.gov),簡稱SEER 數據庫,記錄了1975~2017年美國多種腫瘤病人的臨床信息、病理特點及預后。本文通過檢索SEER 數據庫,分析膠質瘤病人預后影響因素,為臨床診治提供參考。
1 資料與方法
1.1 計算機檢索 通過SEER*Stat(8.3.8版本)軟件搜集SEER 數據庫2004~2015 年膠質瘤病人資料。根據《國際腫瘤分類法》第三版(ICD-O-3:9380)的標號,收集膠質瘤病人的臨床數據。收錄標準:①病理診斷為膠質瘤;②臨床治療信息無缺失;③隨訪數據完整;④婚姻信息完整;⑤手術信息包括再次或多次手術;⑥既往無顱內腫瘤治療史。排除標準為:①缺乏病理診斷;②死亡后確診為膠質瘤;③生存信息未知;⑤死于其他疾病。最終納入18 523 例膠質瘤病人的數據。
1.2 影響因素的收集①年齡,分為<30 歲,30~60歲,>60歲三個年齡階段;②性別,分為男性和女性;③人種,分為白人、黑人和其它人種;④放療與手術的順序,分為無放療、術后放療、術前放療以及術前術后均放療;⑤是否化療;⑥是否手術;⑦病理分級,分為Ⅰ、Ⅱ、Ⅲ、Ⅳ級;⑧腫瘤大小(直徑),分為≤2 cm,2~4 cm 和≥4 cm;⑨病灶部位,分為額葉、顳葉、頂葉、枕葉、小腦、腦干和多發病灶;⑩婚姻狀態,分為結婚、未婚、分居、喪偶。
1.3 統計學方法 采用R(4.0.2 版本)軟件進行單因素與多因素Cox回歸分析,將單因素Cox回歸分析有統計學意義的因素納入多因素Cox回歸分析;使用R軟件survminer 等程序繪制生存曲線;P<0.05 為差異有統計學意義。
2 結果
2.1 病人基本資料SEER 數據庫2004~2015 年確診并登記的膠質瘤共58 537例,根據納入標準,最終納入18 523 例,其中男10 567 例,女7 956 例;年齡<30歲2 657 例,30~60 歲8 017 例,年齡>60 歲7 849 例;白種人占88.3%;高級別膠質瘤15 453 例;病灶位于額葉6 487例、顳葉4 387例、頂葉2 764例,多發病灶2 680 例;化療10 915 例,未化療7 608 例;未手術4 229例,腫瘤部分切除7 443例,腫瘤全切除6 851例;術后放療9 948 例,未放療7 608 例;結婚10 817 例,離婚1 398例,單身4 689例,喪偶1 453例。
2.2 膠質瘤預后的影響因素 單因素Cox回歸分析顯示,年齡、腫瘤大小、腫瘤病理級別、性別、腫瘤部位、腫瘤切除程度、化療、放療、婚姻狀態與膠質瘤的預后相關(P<0.05,表1),而種族與預后無關(P>0.05,見表1)。多因素Cox 回歸分析結果顯示,年齡≥30歲、腫瘤直徑≥2 cm、病理級別高、腫瘤位于額葉以外部位、離婚、喪偶為膠質瘤預后不良的獨立危險因素(P<0.05,表1),手術治療、術后放療、化療是膠質瘤預后的獨立保護因素(P<0.05,表1)。

表1 采用Cox比例回歸風險模型分析原發性人腦膠質瘤預后影響因素
2.3 不同治療方式和婚姻狀態與膠質瘤預后的關系手術治療(全切除或部分切除腫瘤)、術后放療、化療均明顯延長膠質瘤病人生存期(P<0.05,圖1A~D)。同時,婚姻狀態為結婚的病人預后明顯好于喪偶的病人(P<0.05,圖1E)。
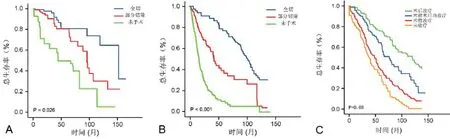
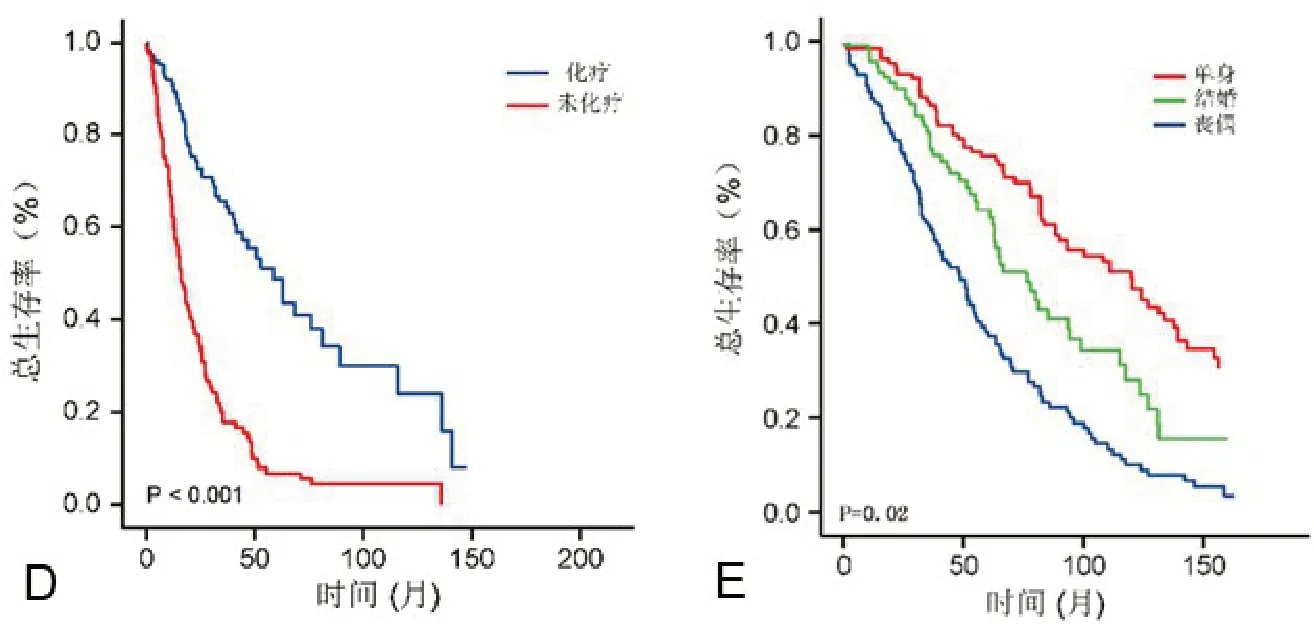
圖1 生存曲線分析不同治療方式和婚姻狀態與膠質瘤預后的關系
3 討論
人腦膠質瘤具有惡性程度高、侵襲性強、易復發的特點[5]。目前,手術切除仍是膠質瘤治療的首選。但由于膠質瘤具有較強的侵襲性,手術難以完全切除,常常需要輔助放療及同步化療[6,7]。目前,膠質瘤治療效果并不令人滿意,5年總體存活率不到5%[8]。膠質瘤的復發率較高,并且復發可發生在術后任何時間,術后6 個月發生率達36.7%[9]。所以準確評估影響膠質瘤病人預后的影響因素非常重要,可為后續治療提供指導。本文從SEER 數據庫檢索膠質瘤病例,獲得了一個大樣本量數據,以進行準確和多種形式的分析,結果顯示年齡、腫瘤大小、腫瘤病理分級、手術、化療和放療、婚姻狀態是影響膠質瘤病人的獨立預后影響因素。
本文結果顯示年齡是膠質瘤病人重要的預后影響因素,特別對于年齡在60 歲以上的病人,預后不良風險較年輕病人更高,說明隨著年齡的增長,病人的預后不良危險越大。因此,臨床上,應注意高齡病人的護理和隨訪。結合我國實際,應注重膠質瘤病人的早期診斷和早期治療,因為隨著年齡的增長,病人的預后狀況會逐漸惡化。另外,本文發現,不同部位膠質瘤病人的預后也不一樣,其中多發病灶和腦干膠質瘤病人預后相對較差。這可能是由于腫瘤病灶多發和腦干病灶,會明顯增加膠質瘤手術切除的難度,往往導致手術切除效果不理想,常導致腫瘤復發[10]。對于這類膠質瘤病人,及時進行術后放療和化療可能有利于病人的預后。
手術切除是膠質瘤治療的主要手段,其中盡可能地完全切除腫瘤是治療的關鍵[11]。本文結果顯示手術治療有利于改善病人的預后,其中治療全切除的效果優于腫瘤部分切除。這與之前的研究一致[12~14]。另有研究發現異檸檬酸脫氫酶突變型膠質瘤病人,手術全切除率較高[14]。但對于高齡和病灶位于功能區膠質瘤病人手術方式的選擇,目前仍然存在分歧。相關研究根據病人年齡、臨床表現和病灶部位分為高、中、低危三組,發現高危病人不適合采用激進手術治療方式[15]。
本文結果顯示化療為膠質瘤病人預后的保護因素。化療是膠質瘤治療的重要手段,特別是那些無法接受手術,放療效果不佳的病人。化療可以殺滅術后仍然殘留的腫瘤細胞,從而盡可能的延長病人無進展生存期及總生存期[16]。
本文通過對放療與手術順序之間的分析,結果顯示術后進行放療是膠質瘤病人的保護因素。這與大部分的研究相符合。但對術后放療開始的時間,目前仍有爭議,一般認為在術后6 周內進行放療[17],但也有研究認為延遲放療對病人預后沒有影響,術后8周放療也不影響病人生存率[18]。本文分析顯示,術前放療和術前術后都進行放療則與病人的預后沒有明顯關系,提示在臨床治療過程中,應更加注重術后放療的時機和劑量的選擇,單純增加放療次數并不能改善病人的預后。
另外,我們通過對病人的婚姻狀態進行分析,發現離婚與喪偶是膠質瘤病人預后不良的獨立危險因素。這與之前的研究結果相符[19,20]。但婚姻狀態對預后影響的具體機制,目前還不清楚,可能與婚姻為病人提供精神支持與情感寄托,有助于病人在疾病治療過程中消極情況的宣泄[21],而喪偶會增加病人的心理壓力,往往使病人出現消極行為和心態,不利于病人的預后[22]。因此,在臨床實踐中,除了常規治療方式,也要考慮病人的情感需要,及時解決病人心理問題。
本文也有一些局限性。首先,這是一項基于SEER數據庫的回顧性研究,降低了研究結果應用于我國病人的臨床質量。其次,2016 年版WHO 中樞神經系統腫瘤分類方法首次增加分子分型,標志著分子病理學在膠質瘤分類中發揮著越來越重要的作用。江濤等[14]研究發現異檸檬酸脫氫酶突變及染色體1p/19q 聯合缺失是膠質瘤生存預后的影響因素。由于分子病理指導下的診療模式在2012 年后才逐漸推廣,目前SEER 數據庫還無法提供膠質瘤病人的分子病理相關數據,相關指標在診斷預后方面的作用值得進一步研究。
總之,對原發性人腦膠質瘤,盡可能手術全切除腫瘤,同時術后輔助放化療,能夠延長病人的生存時間。同時,臨床應加強病人心理干預。

