2015-2019年上海某三級綜合醫院臨床試驗嚴重不良事件特征分析*
孫秀秀,袁素維,李 恒,龔軼鈺
(1.上海市第六人民醫院科教處 200233;2.上海市兒童醫院/上海交通大學附屬兒童醫院院長辦公室 200062;3.華東政法大學公共衛生治理研究中心,上海 201620)
根據我國《藥物臨床試驗質量管理規范》(2020版)的相關定義,嚴重不良事件(serious adverse event,SAE)指受試者接受試驗用藥品后出現死亡、危及生命、永久或者嚴重的殘疾或者功能喪失、受試者需要住院治療或者延長住院時間,以及先天性異常或者出生缺陷等不良醫學事件。臨床試驗SAE的監控是臨床試驗中的關鍵環節之一,也是藥物臨床試驗機構關注的重要指標[1]。不良事件的記錄、處理及隨訪問題已成為我國臨床試驗實施中的主要問題[2],已有不少學者從SAE報告的流程和內容的規范性進行了相應研究[3-5],但關于SAE的特點分析的實證研究數量仍然偏少。本研究以上海地區為例,對某三級綜合醫院的臨床試驗SAE數據進行回顧性分析,并與國內其他地區所報告的臨床試驗SAE特點進行比較,在此基礎上,對進一步降低醫院臨床試驗SAE發生風險,保護受試者安全提供參考建議。
1 資料與方法
1.1 一般資料
上海某三級綜合醫院2015年1月至2019年12月間在研臨床試驗項目共194項,接收到的所有臨床試驗SAE報告為168 例,其中2015年報告10例,2016年報告38例,2017年報告26例,2018年報告28例,2019年報告66例。性別方面,男95例(56.5%)、女73例(43.5%)。年齡分布方面,以40~<60歲的人群最為集中,占比39.1%,其次為60~<70歲人群,占35.1%。合并癥方面,119例(70.8%)SAE受試者有合并癥。具體情況見表1。
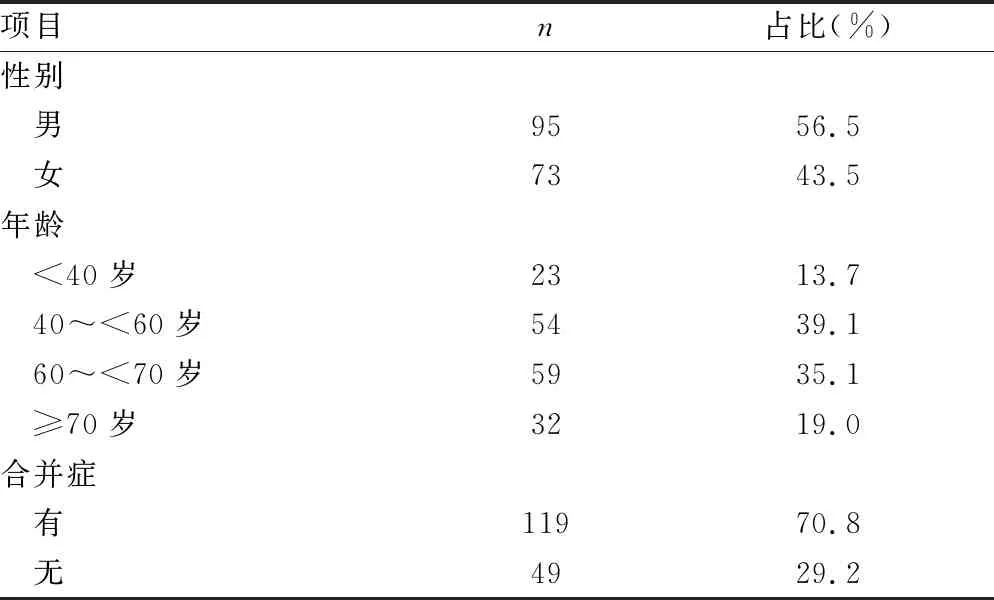
表1 發生SAE的受試者的一般信息(n=168)
1.2 方法
采用回顧性資料調查,對所納入的168例SAE報告進行信息采集,所納入的指標包括受試者性別、年齡、合并疾病情況、試驗項目名稱、上報科室、項目類別、SAE類型等信息。SAE與試驗藥物/器械的關系判定采用李博等[6]制訂的五級分類標準:肯定無關、可能無關、可能有關、肯定有關和無法判定。
1.3 統計學處理
采用SPSS22.0軟件分析數據,計數資料采用例數和百分率(%)表示,比較采用χ2檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1 SAE事件的臨床特征分析
納入的168例SAE事件中,按照注冊類型,化學藥品相關SAE有72例,占42.9%;生物制品相關的有39例,占23.2%;醫療器械相關57例,占33.9%。從科室的分布看,168例SAE分布在全院12個科室。其中,心內科、腫瘤科和血液科最為集中,分別有50例、49例和23例,占比29.8%、29.2%和13.7%。從臨床試驗的分期看,Ⅱ期臨床試驗最為集中,共82例,占48.8%。在所有SAE中,導致住院是最主要的類型,共有131例,占78.0%;另有18例為延長住院時間,占10.7%。所有SAE中,共86例(51.2%)為預期事件,另82例(48.8%)為非預期事件;71.4%的SAE發生后,相關臨床實驗繼續進行。39.3%的受試者SAE轉歸達到癥狀消失。從與藥物/器械的關系判定結果看,與所開展的藥物/器械“肯定無關”占比最大,為49.4%,另有26.8%判定為“可能無關”;判定為“肯定有關”的共6例,占3.6%。見表2。
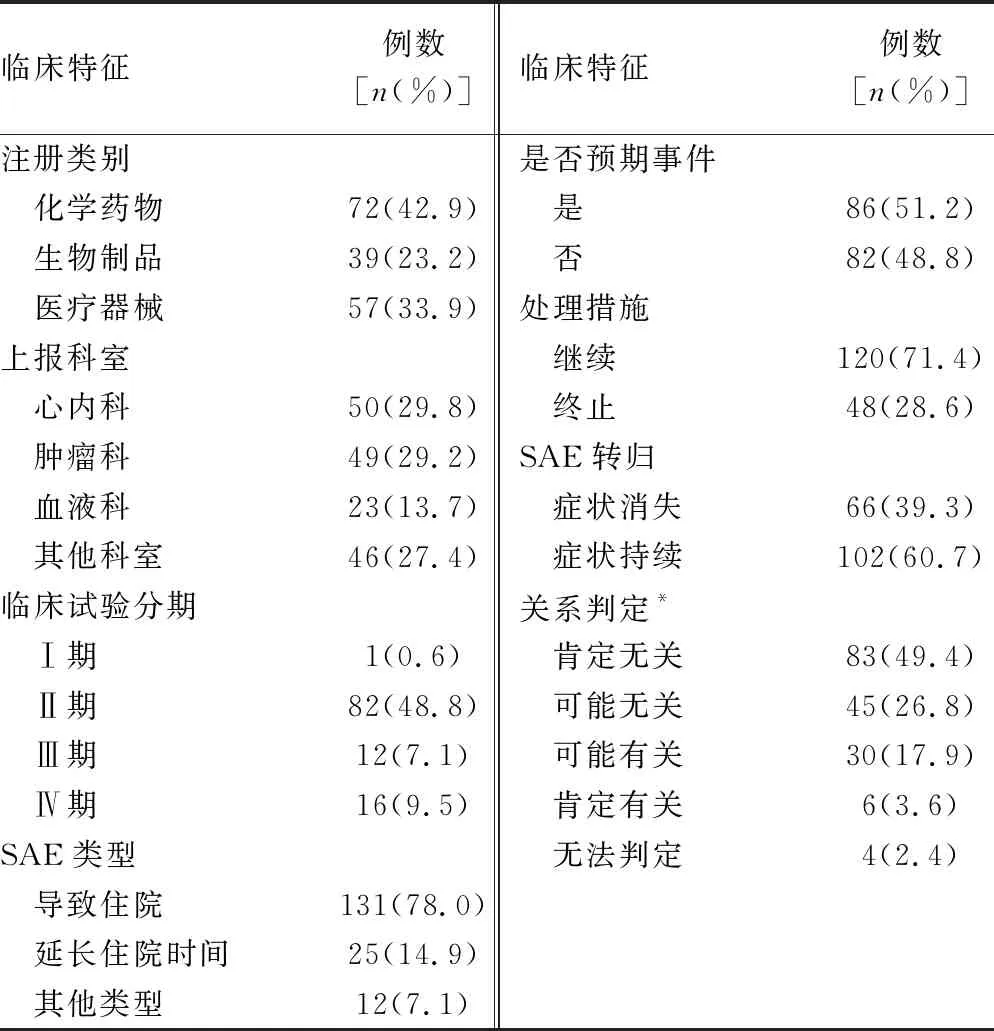
表2 SAE的臨床特征分析(n=168)
2.2 不同SAE注冊類型的影響因素分析
在上述描述性分析的基礎上,進一步對不同注冊類型發生SAE的特點進行分析,結果顯示,不同注冊類型發生SAE的受試者年齡、上報科室、試驗分期、是否為預期事件及與藥物/器械的關系判定結果存在顯著差異(表3)。從受試者年齡看,化學藥物臨床試驗的SAE受試者年齡主要集中在60~<70歲(30.6%),而生物制品和醫療器械的SAE受試者年齡分布在40~<60歲及60~<70歲的區間比例較為均衡;從上報科室看,化學藥物SAE散發于多個科室,而生物制品和醫療器械SAE則分別集中在腫瘤科(66.7%)和心內科(54.4%);從試驗分期看,化學藥物(76.4%)和生物制品(69.2%)SAE均集中在臨床Ⅱ期,此外,化學藥物Ⅳ期(20.8%)和生物制品Ⅲ期(25.6%)也是SAE的高發階段;同時,化學藥物(58.3%)和醫療器械(54.4%)發生非預期SAE事件的比例顯著高于生物制品(23.1%);從關系判定結果看,化學藥物(50.0%)和醫療器械(54.4%)項目SAE的發生與試驗本身“肯定無關”的比例顯著高于生物制品(41.0%)。見表3。
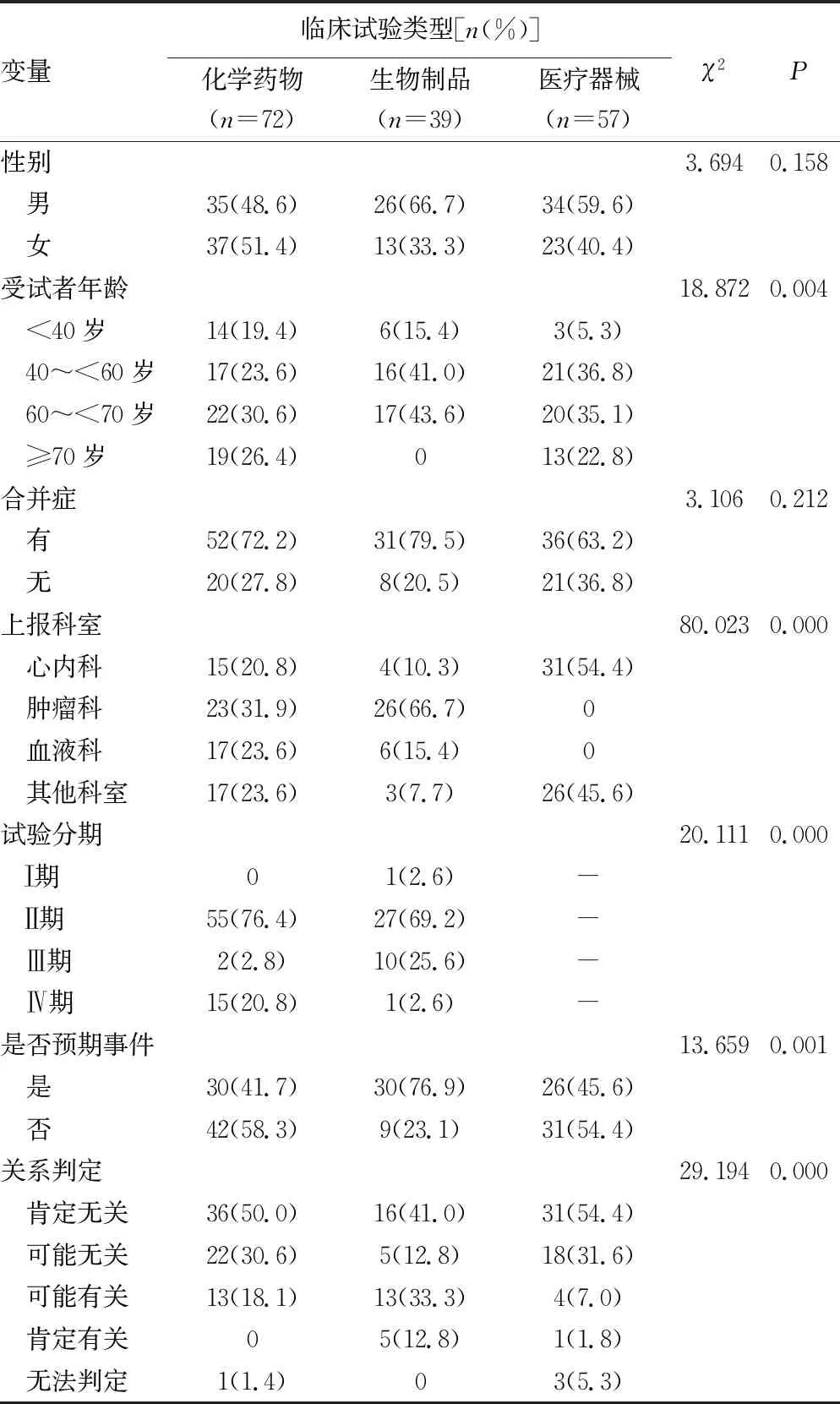
表3 不同項目注冊類型發生SAE的特點(n=168)
3 討 論
3.1 不同地區醫療機構SAE臨床試驗特點比較
本研究結果顯示,SAE受試者中,40~<70歲的中老年人群為主要群體,占67.3%,70.8%的受試者自身伴有合并癥;78.0%的SAE導致受試者住院,49.4%的SAE與研究藥物/器械“肯定無關”,這些特點與國內其他地區大型醫院的報道結果類似[7-9]。對不同注冊類型項目發生SAE特征進行進一步分析,發現受試者年齡、試驗分期會對不同注冊類型項目發生SAE存在顯著影響,同時不同注冊類型項目發生非預期SAE事件及與藥物/器械的關系判定結果也存在明顯差異。因此,對于SAE的風險管理需要結合受試者情況和項目特點進行精準管控。
與其他研究發現不同的是,在本研究中腫瘤科發生SAE高于心內科,成為SAE發生數量最高的科室。這可能與科室臨床試驗的特點有關。醫院開展的臨床試驗項目中,腫瘤科承接藥物臨床試驗項目較多,心內科承接醫療器械臨床試驗項目較多,兩科室患者的病情通常多變,患者一旦感覺不適,醫生為患者安全考慮,多會收治入院;且腫瘤科入組受試者多為晚期腫瘤患者,即便發生SAE,考慮到患者無其他的治療方法,參加試驗仍可使其受益,在充分知情同意的前提下,患者大多會選擇繼續服藥,直至進展。
3.2 老年群體是臨床試驗風險管理的重要領域
隨著人口老齡化程度的不斷加深,老年人群的醫療安全問題日益受到重視。然而,老年人群中目前普遍存在不合理用藥問題,并導致大量藥物不良反應和意外死亡的事件[10]。與此同時,老年群體在藥物臨床試驗中卻普遍表現不足[11],主要原因在于老年人群常常伴隨多種合并癥,試驗藥物與日常治療藥物的混合使用,導致受試者更容易出現意想不到的風險和不良反應。本研究也同樣發現了老年人群和伴隨合并癥是SAE受試者的主要特征。
據統計,老年人群的用藥總量超過了社會總體人群的1/3[11],將老年人群合理納入臨床試驗,提高臨床試驗的證據質量勢在必行。2017年國務院頒布《“十三五”國家藥品安全規劃》,明確鼓勵開展老年人臨床試驗。因此,老年群體的臨床試驗風險管理將成為臨床試驗機構需要重點突破的工作。
3.3 積極引入臨床試驗保險是提升醫院風險管理水平的必要手段
隨著國家對臨床研究的大力支持和推廣,醫院臨床試驗的數量也在快速增長,而臨床試驗中不良事件的發生往往不可避免且難以預料。積極引入臨床試驗保險,健全臨床試驗風險管理,保護申辦方和受試者權益已經成為行業共識[12]。自2015年來,樣本醫院逐步建立臨床試驗保險制度,將保險相關材料作為立項審核的重要依據之一,臨床試驗納保比例由2014年的38.5%上升至2019年的76.3%。本研究涉及的與試驗“肯定相關”的6項SAE中,有5項都購買了相關保險,較大程度上緩解了開展臨床試驗的風險,保證了大型臨床試驗開展的質量。

