微小RNA-30對非小細胞肺癌侵襲、轉移能力的影響及機制研究
崔 凱,支亞男,王壯壯,公孫鑫,白峻峰
(西安國際醫學中心醫院胸腔外科,陜西 西安 710100)
非小細胞肺癌(Non-small cell lung cancer,NSCLC)是呼吸系統常見腫瘤[1]。因高發病率和致死率,NSCLC在世界范圍內成為研究熱點[2-3]。腫瘤細胞的侵襲和轉移能力對腫瘤在體內的遠端轉移具有非常重要的意義[4]。研究[5]顯示NSCLC中肺癌細胞具有較強的遠端轉移和形成新病灶的能力,但是轉移機制尚不清楚。微小RNA(miR)是近些年在腫瘤中研究發現的一類具有重要生物調節功能的小分子RNA,其對腫瘤異常增殖、侵襲和轉移能力都具有直接或者間接的調控作用[6]。研究[7-8]發現,miR-30在多種惡性腫瘤(如胃癌、結腸癌、肝癌等)中發揮促癌作用,但是其在NSCLC中作用如何,是否同樣發揮促癌作用,目前鮮有報道。因此,本研究觀察miR-30對NSCLC侵襲和轉移能力的影響,并分析其作用機制。
1 材料與方法
1.1 病理標本 收集本院收治的30例NSCLC患者的癌組織和癌旁組織,所有患者均經病理確診,患者及其家屬對本研究知情同意。
1.2 主要試劑 人肺癌細胞系A549細胞和正常肺支氣管上皮細胞系HBE細胞購自中科院上海細胞庫;DMEM(No.102432)、胎牛血清(No.542354)、胰酶(No.643421)和青鏈霉素混合液(No.175423)購自Gibco公司;Lipofectamine 2000轉染試劑購自Invitrogen公司;Transwell小室購自Corning公司;白細胞介素-6(IL-6,No.1035332)、信號轉導和轉錄活化因子3(STST3,No.7654543)、p-STAT3(No.2453245)和甘油醛-3-磷酸脫氫酶(GAPDH)抗體(No.7865453)購自Abcam公司;ECL化學發光試劑盒(No.2457)購自上海碧云天公司。
1.3 細胞培養及轉染 將細胞隨機分配到不同組,用小干擾RNA(siRNA)和相應的陰性對照(siNC)轉染它們。每組包含3×105個細胞,用Lipofectamin 2000進行細胞轉染。在轉染前24 h將細胞接種在6孔板中,融合30%~40%。每次轉染使用siRNA和siNC各20 nmol/L。
1.4 實時定量反轉錄PCR(qRT-PCR)檢測RNA表達 將臨床肺癌及癌旁組織樣本勻漿后和細胞樣本分別加入1 ml TRIzol裂解液提取總RNA,隨后采用Takara公司5×Prime Script RT Master Mix反轉錄試劑盒獲得總cDNA,基因相對表達量根據2-ΔΔCT法進行計算。qRT-PCR引物序列見表1。

表1 qRT-PCR引物序列
1.5 CCK-8細胞增殖實驗 取對數生長期A549細胞轉染miR-30 mimic和miR-30 inhibitor,8 h后換完全DMEM培養基繼續培養24 h。細胞密度1×104接種至96孔板,分別于接種后1~5 d每孔加入10 μl CCK-8溶液,37 ℃、5% CO2條件下繼續孵育1~4 h。酶聯免疫檢測儀在450 nm處讀取吸光值(OD)并繪制細胞生長曲線。
1.6 Transwell遷移與侵襲實驗 細胞基質膠用預冷的無血清DMEM培養基以1∶9稀釋,每孔加40 μl,37 ℃孵育5 h后水化基底膜。取對數生長期A549細胞轉染miR-30 mimic和miR-30 inhibitor, 8 h后換完全DMEM培養基繼續培養24 h。采用0.25%胰蛋白酶消化、中和,離心并重懸細胞于無血清DMEM培養基,每孔接種5×104個細胞于24孔培養板內的Transwell小室上室中,下室加入600 μl含10% 胎牛血清的完全DMEM培養基,37 ℃、5%CO2條件下于孵箱中培養,每種細胞設置3個復孔。待細胞遷移14 h和侵襲20 h后取出培養板并棄上清,PBS清洗后分別加入600 μl 4%多聚甲醛和0.1%結晶紫染液于室溫下固定和染色15 min,PBS清洗后用棉簽輕輕擦去Transwell小室上室中未遷移和侵襲細胞。倒置相差顯微鏡下隨機選擇5個視野觀察被染成紫色的穿過膜的細胞,拍照記錄細胞遷移和侵襲情況。
1.7 Western blot檢測蛋白表達 取對數生長期A549細胞轉染miR-30 mimic和miR-30 inhibitor, 8 h后換完全DMEM培養基繼續培養24 h。采用0.25%胰蛋白酶消化、中和,離心并重懸細胞后加入100 μl PIPA裂解液和0.15 μl PMSF裂解液于室溫下裂解細胞5 min,4 ℃離心15 min,吸取上清,進行SDS-PAGE蛋白凝膠電泳和轉膜,一抗IL-6、STAT3和p-STAT3避光孵育,4 ℃冰箱過夜。次日孵育二抗,ECL發光儀檢測。

2 結 果
2.1 miR-30在癌組織與癌旁組織、A549細胞與HBE細胞中的表達比較 見圖1。miR-30在癌組織中表達顯著高于癌旁組織,在A549細胞中表達顯著高于HBE細胞(均P<0.05)。

注:圖A中,與癌旁組織比較,*P<0.05,**P<0.01;圖B中,與HBE細胞比較,**P<0.01
2.2 miR-30 mimic和miR-30 inhibitor轉染后miR-30表達變化 見圖2。qRT-PCR結果顯示,A549細胞轉染miR-30 mimic后miR-30表達上調4.142倍,miR-30 inhibitor轉染后miR-30表達降低76%(均P<0.05)。
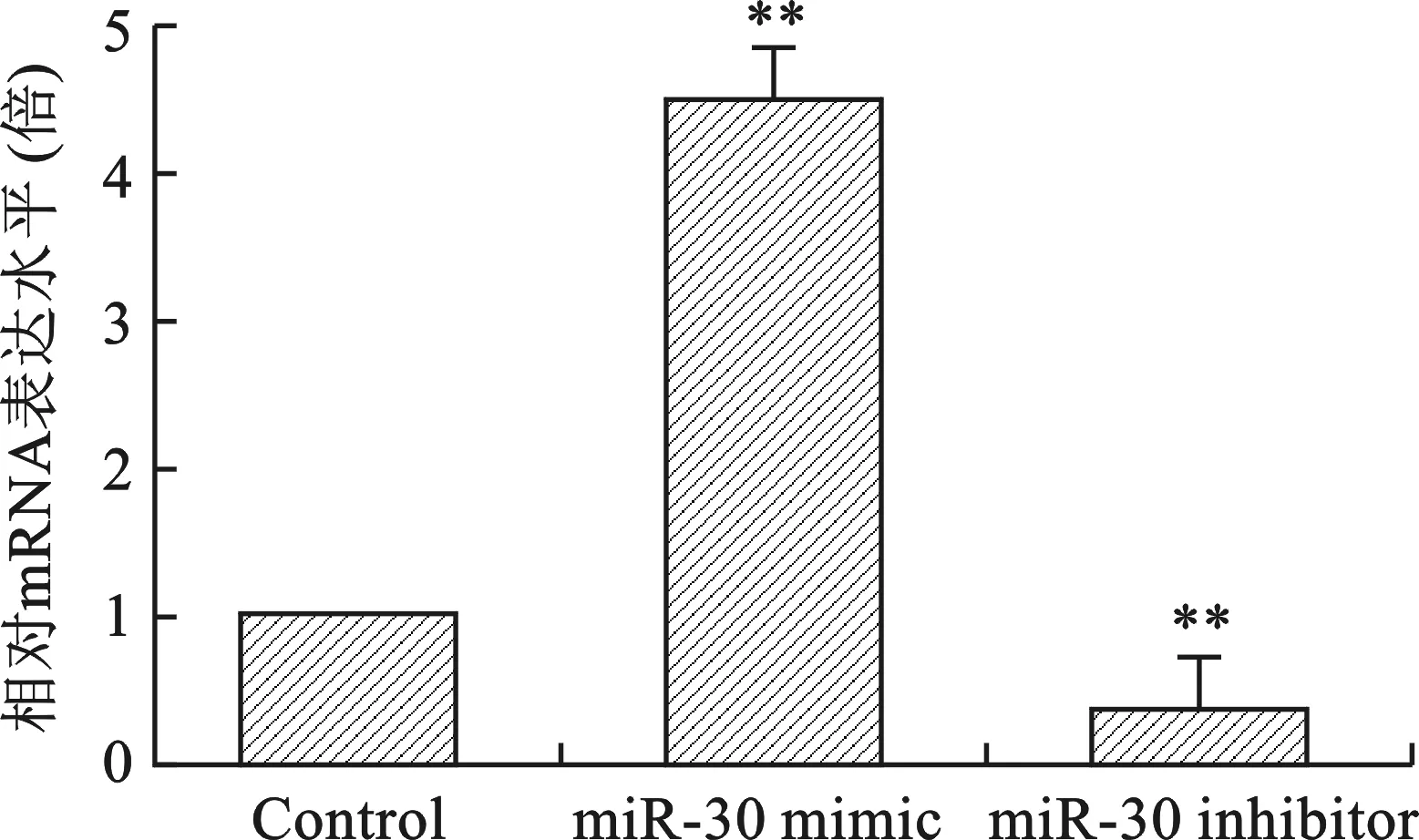
注:與Control組比較,**P<0.01
2.3 miR-30對A549細胞遷移能力的影響 見圖3。
Transwell結果顯示,miR-30 mimic轉染后穿膜細胞數顯著多于對照組,而miR-30 inhibitor轉染后穿膜細胞數顯著少于對照組(均P<0.05)。
2.4 miR-30對A549細胞侵襲能力的影響 見圖4。Transwell結果顯示,miR-30 mimic轉染后細胞侵襲能力顯著強于對照組,而miR-30 inhibitor轉染后細胞侵襲能力顯著弱于對照組(均P<0.05)。
2.5 miR-30對IL-6和STAT3 mRNA表達的影響 見圖5。qRT-PCR檢測結果顯示,miR-30 mimic轉染后A549細胞中IL-6和STAT3的mRNA表達顯著增加,miR-30 inhibitor轉染后IL-6和STAT3的mRNA表達隨之降低(均P<0.05)。
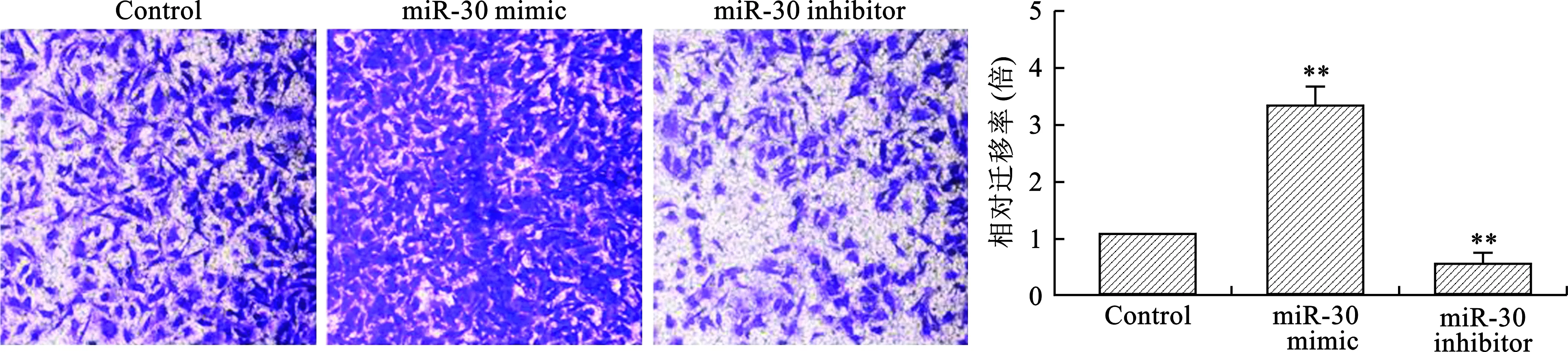
注:與Control組比較,**P<0.01
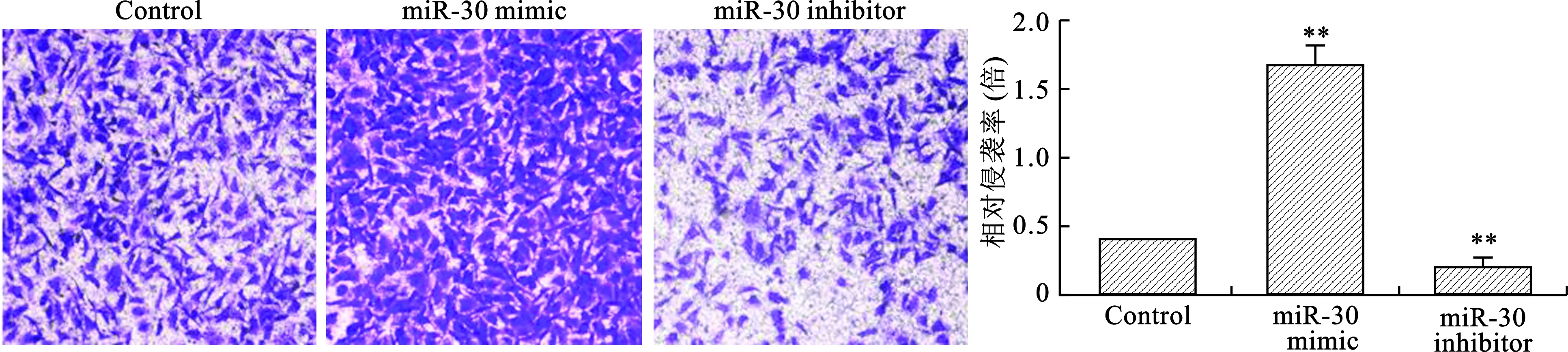
注:與Control組比較,**P<0.01
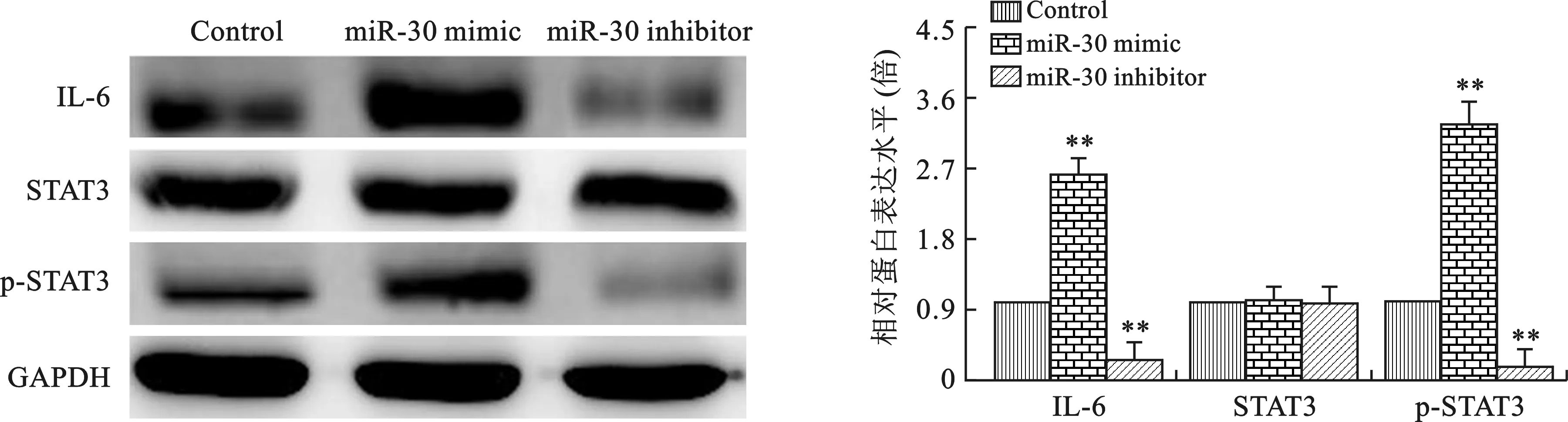
2.6 miR-30對IL-6和STAT3蛋白表達的影響 見圖6。Western blot結果表明,miR-30 mimic轉染后A549細胞中IL-6和STAT3蛋白表達顯著增加,而miR-30 inhibitor轉染后IL-6和STAT3蛋白表達隨之降低(均P<0.05)。
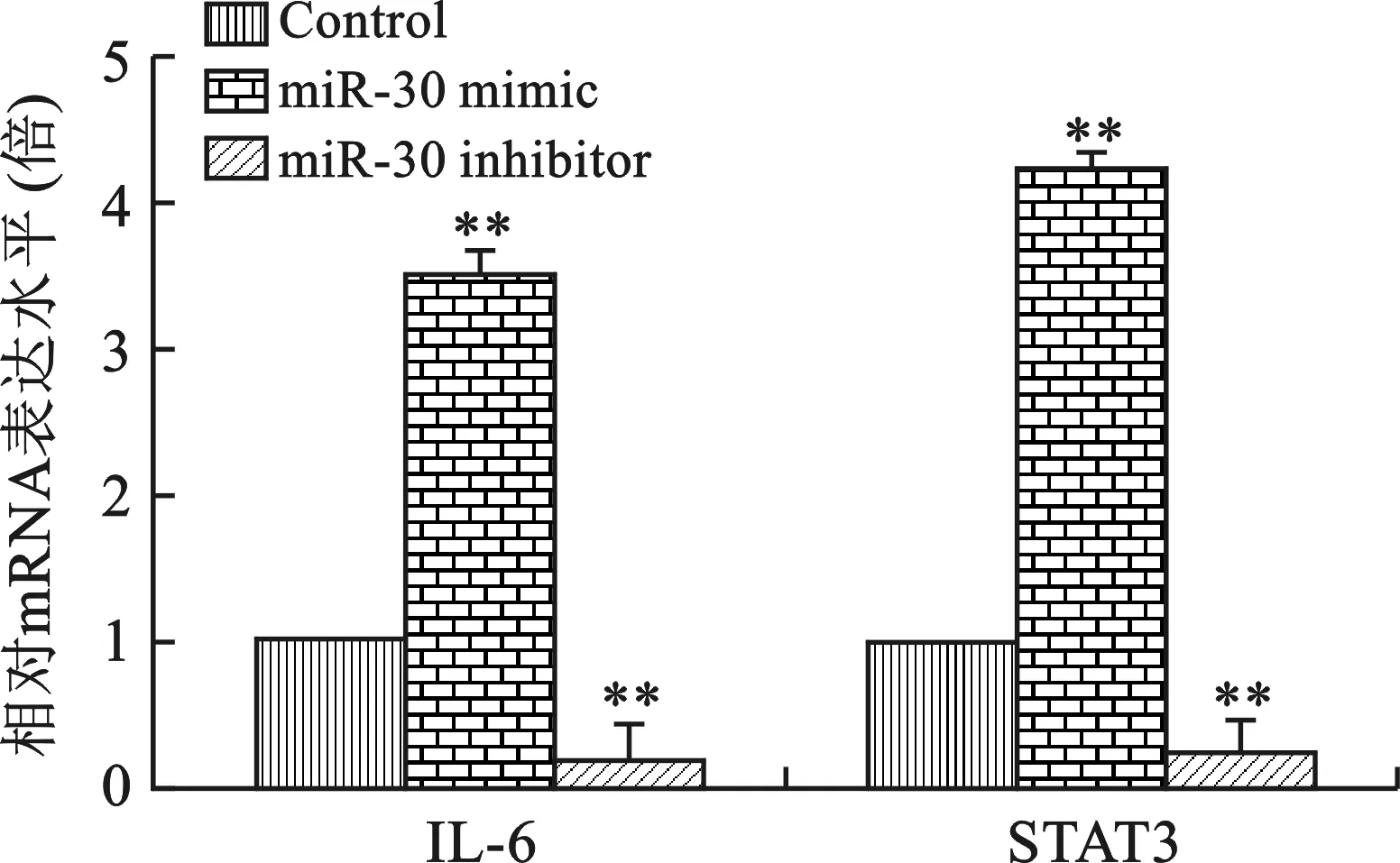
注:與Control組比較,**P<0.01
3 討 論
肺癌是全球范圍內導致死亡的主要癌癥之一,多數肺癌患者即使經過手術及放化療等聯合治療,術后總體5年生存率仍低于20%[9]。肺癌患者中NSCLC約占80%[10]。目前針對NSCLC的治療雖然已經取得一定的進展,但是NSCLC具有較高的侵襲和遠端轉移能力,可在患者體內形成新的病灶,導致患者術后恢復較差且生存率低[11-13]。因此,探究NSCLC發生、發展的原因并進一步揭示其高侵襲和轉移能力的分子機制具有重要臨床意義。
miR-30是一種具有多種細胞功能的調節因子[14]。研究[15]發現miR-30參與了人體多種生物學過程。例如,miR-30促進惡性膠質瘤患者內源性神經干細胞(NSC)的大量增殖和遷移,且這種增殖和遷移在患者臨床進程中隨著腫瘤惡化程度達到高峰,隨后是一段較長的分化、存活和整合期[16]。此外,miR-30過表達抑制導致NSC增殖率下降的機制及其伴隨的代謝變化取得一定進展[17]。最近的研究[18]表明,miR-30異常表達能夠介導缺血缺氧后胃癌和膀胱癌的發生與發展。同時,研究證實miR-30過表達通過介導腫瘤細胞的有氧糖酵解進而促進乳腺癌的惡性發展。
注:與Control組比較,**P<0.01
IL-6/STAT3信號通路被證實與多種腫瘤的異常激活密切相關,其與腫瘤微環境中的多種炎癥因子相關,并且激活腫瘤微環境中炎癥因子的表達,從而促進腫瘤的異常增殖和侵襲等惡性生物學行為。IL-6作為一種促炎因子,在多種腫瘤中呈異常高表達,現有研究證實其不僅可以促進炎性因子的表達,同時會導致腫瘤相關mRNA的異常表達,在結腸癌中IL-6促進miR-31的分泌從而激活結腸癌細胞的異常增殖。同時,IL-6可以激活STAT3的磷酸化,激活STAT3信號通路,從而抑制腫瘤細胞凋亡。STAT3激活不僅會使基因轉錄失調,促進細胞增殖、血管生成和腫瘤轉移,而且還影響調控細胞凋亡的小分子RNA的表達變化[19]。但是目前在NSCLC中關于miR-30與IL-6/STAT3信號通路相互關系的研究較少。
本研究通過比較30例臨床不同病理分期NSCLC患者的癌組織與癌旁組織、人肺癌細胞系A549細胞與正常肺支氣管上皮細胞系HBE中miR-30的表達,分析miR-30對IL-6/STAT3信號通路活性的影響,揭示NSCLC發生與發展的新機制。結果表明,miR-30在NSCLC患者癌組織和A549細胞中的表達較癌旁組織和HBE細胞明顯升高。miR-30 mimic轉染后的A549細胞中IL-6/STAT3信號通路顯著激活,同時明顯增強細胞的侵襲和遷移能力,而miR-30 inhibitor轉染后的A549細胞中IL-6、STAT3 mRNA及蛋白表達水平明顯降低,同時細胞的侵襲和遷移能力明顯受到抑制,表明miR-30的異常表達與NSCLC的發生與發展密切相關。
綜上所述,miR-30能促進NSCLC侵襲和轉移能力,其機制可能與激活IL-6/STAT3信號通路有關。因此,靶向miR-30有望成為臨床抗NSCLC轉移治療的新路徑,同時可考慮將血清miRN-30作為NSCLC患者早期診斷及預后指標。

