腹腔鏡肝切除聯合脾動脈結扎術治療肝癌合并門脈高壓癥的療效分析
蘇汝平,李妮,鐘漓,趙志*
原發性肝細胞肝癌(hepatocellular carcinoma,HCC)是我國最為常見的消化道惡性腫瘤之一,其中>85%的患者合并不同程度的肝硬化,約>30%的患者合并門靜脈高壓癥脾功能亢進[1]。臨床上大部分肝癌合并門靜脈高壓癥的患者肝功能偏差、病情較為復雜,治療上需兼顧肝癌治療及有效地處理門靜脈高壓癥,給外科醫生帶來巨大挑戰[2]。供體的短缺也很大程度上限制了作為理想治療方案的肝移植術在臨床上的廣泛應用。而聯合肝癌切除、脾切除和選擇性賁門周圍血管離斷術的同期外科手術方式,術后容易發生肝功能衰竭、術后大出血等嚴重的并發癥,并不一定適合于所有的患者[3]。近年來,本治療組對于原發性肝癌合并門靜脈高壓癥脾功能亢進且肝功能較差的患者,選擇性地應用腹腔鏡下脾動脈結扎術(splenic artery ligation,SAL)聯合肝切除術(laparoscopic hepatectomy,LH),取得了較為滿意的療效,現總結報告如下。
1 資料與方法
1.1 臨床資料
2018年2月至2020年2月我院診治的28例患者均確診為原發性肝癌合并肝炎后肝硬化、門脈高壓癥脾功能亢進,男19例,女9例,年齡38~78歲,平均(59.9±9.8)歲。肝癌位于肝左葉12例、肝S6段7例、肝S8段3例、肝S4段3例、肝S1段2例、肝S7段1例,直徑1.2~4.8 cm,平均(3.2±0.8)cm,26例為單發,2例為多發。術前血常規:紅細胞數(3.38±0.37)×1012/L、白細胞數(2.32±1.58)×109/L、血小板數(65.17±24.03)×109/L。術前肝功能Child-Pugh分級:A級10例,B級18例,術前吲哚青綠15分鐘滯留率(ICG-R15)為(14.87±7.05)%。術前彩色多普勒超聲檢查脾臟厚度7~13 cm。2例老年患者有明確的黑便史。
1.2 手術方法
本組患者術前常規護肝降酶、糾正低蛋白血癥,備紅細胞、血漿及血小板。術前血小板計數低于30×109/L者,手術開始前30 min給予輸注凝血酶原復合物300 U、血小板1個治療量。全身麻醉成功后,患者取頭高腳低左側稍抬高臥位。首先臍下建立氣腹,置入30°腹腔鏡,分別為于左側肋緣下與左鎖骨中線交點、左側和右側肋緣下腹直肌旁取4點Trocar穿刺,建立操作孔。探查腹腔內無明顯種植轉移灶,打開胃結腸韌帶,暴露胰腺,打開胃胰襞,于胰頸體部上緣尋找脾動脈主干,7號絲線、Hammlock夾結扎脾動脈主干(圖1)。根據肝臟腫物位置及肝切除需要調整體位,術中B超再次確定肝腫瘤位置、界定肝切除面,不阻斷入肝血流下,行肝臟腫瘤局部切除、切緣距離腫瘤>1.0 cm(圖2)。行左肝外葉切除者:用超聲刀于肝圓韌帶及鐮狀韌帶左側1 cm處肝緣由淺入深、由前向后離斷肝實質。接近肝Ⅱ、Ⅲ段Glisson鞘時,將其前方及上下肝組織稍加分離后,直接采用血管切割閉合器夾閉。繼續向頭側肝實質深部分離,暴露肝左靜脈后,直接采用血管切割閉合器離斷肝左靜脈及肝實質(圖3、圖4),裝標本入塑料袋,肝斷面旁放置引流管。
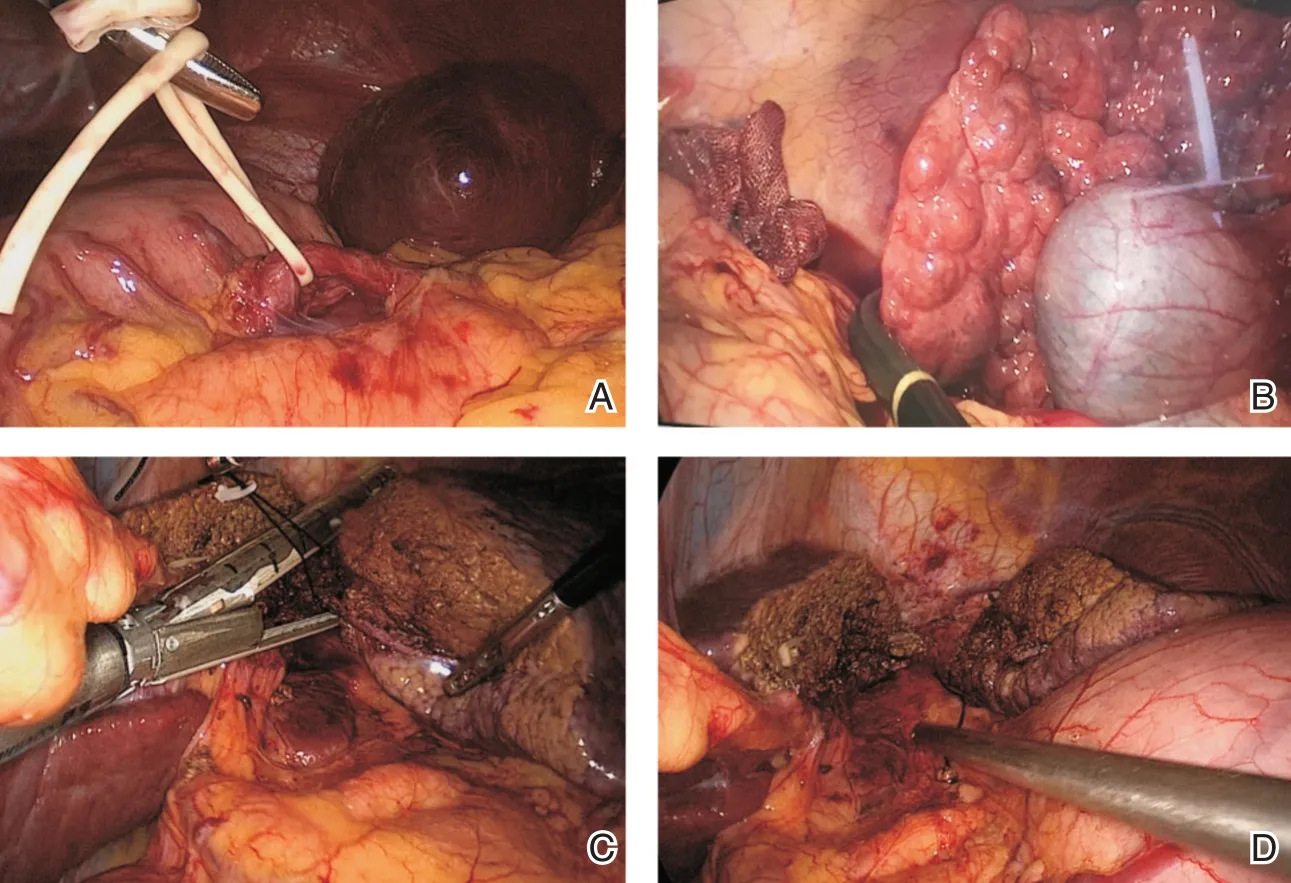
圖1 A:術中情況,胰腺體部上緣結扎脾動脈主干;B:術中情況,B超定位肝腫物;C:術中情況,合并左肝外葉切除時離斷左肝靜脈;D:術中情況,左肝外葉切除后術野
1.3 觀察指標
觀察手術時間及出血量、術后并發癥,統計術后住院日,手術前及手術后第1周、1個月、3個月、12個月血常規(LH750全自動血液分析儀,美國Beckman Coulter公司)及外周血淋巴細胞亞群(Gallios流式細胞儀,美國Beckman Coulter公司)變化,彩色多普勒超聲(阿洛卡ProsoundF37彩超,日本株式會社日立制作所)測量脾厚度。
1.4 統計學處理
采用SPSS 22.0軟件分析,計量資料采用均數±標準差的方式表示,組間比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
28例手術均獲成功,手術平均時間(102±40)min,術中出血量(71±79)mL,術后平均住院日(6.93±2.90)d。圍手術期無死亡病例。術后無脾膿腫及肝衰竭等并發癥發生,有5例腹水、2例胸腔積液、1例膽瘺、1例肺炎,均經非手術治療后好轉出院。白細胞及血小板計數術后1周恢復正常,至術后12個月仍維持在正常范圍。B超測定的脾臟厚度結果說明:與術前相比,至術后12個月脾臟仍有不同程度的萎縮。循環血淋巴細胞亞群比值(CD4+/CD8+)的測定結果也一定程度上反映了保留脾臟的免疫功能(表1)。截至2021年2月,門診及電話隨訪12~36月,肝臟腫瘤再發3例次行射頻消融治療,多發肝內外轉移死亡1例,上消化道出血死亡1例,失訪1例。
表1 患者手術前后觀察指標的變化(±s)
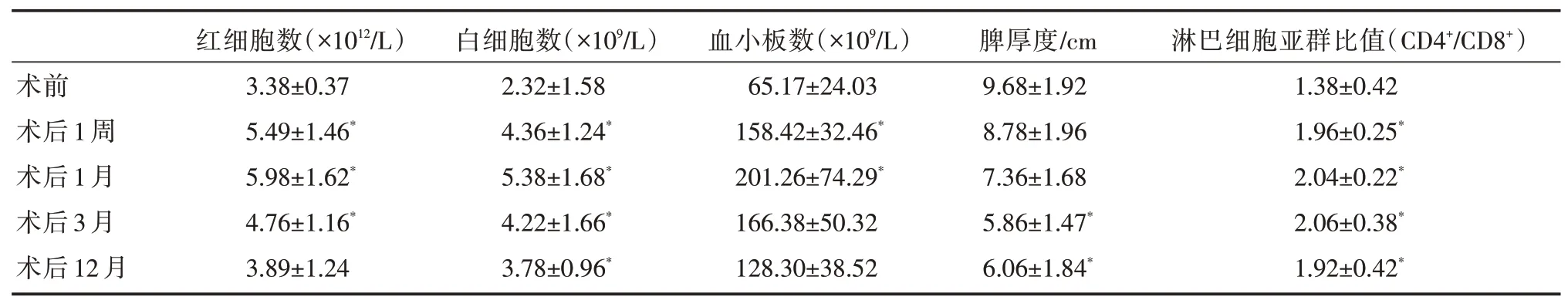
表1 患者手術前后觀察指標的變化(±s)
?
3 討論
原發性肝癌合并門靜脈高壓癥患者的臨床治療較為復雜,目前尚無統一的臨床實踐標準,我國最新版的《原發性肝癌診療規范》中建議,符合UCSF標準的肝功能失代償的肝癌患者首選的治療方法是肝移植,但供體的短缺、患者經濟負擔重以及肝癌肝移植后一旦術后復發則進展迅速等諸多因素構成了其應用瓶頸[4]。既往的一些臨床研究結果提示:經過選擇的合并門靜脈高壓癥的肝癌病人,接受肝切除手術者的術后長期生存仍然是明顯優于接受其他治療者[5,6]。但此類患者在經歷了長期的慢性肝硬化過程后,往往術前肝功能儲備明顯不足,合并門脈高壓癥脾功能亢進時導致血小板減少、白細胞降低、凝血功能不同程度地下降,傳統的聯合肝癌切除脾切除門奇斷流手術術后出血、感染繼發肝功能衰竭的致死風險仍然是臨床醫生面臨的重大挑戰[7,8]。
另外,肝切除術后的小肝綜合征(SFSS)是與門靜脈血流量過多和肝容量不足之間的不平衡有關,可能進一步加重門脈高壓、腹水形成、膽汁淤積和肝功能不全。既往的一些報道如脾動脈結扎術(SAL)、脾切除術和門體分流術通過對門靜脈流入調節,旨在支持降低上述并發癥發生[9-12]。Sato等[13]調查了6例肝細胞癌伴肝硬化患者,研究肝切除術+脾動脈結扎術降低門靜脈高壓是否可以預防肝細胞癌肝硬化患者的肝損傷,結果顯示門靜脈壓力(PVP)從肝切除前的26±7 cmH2O增加到肝切除后的29±6 cmH2O,脾動脈結扎后降至24.5±6.3 cmH2O。脾組織血流量由16.8±5.6 mL/min/100 g下降到7.2±2.2 mL/min/100 g;術后肝功能的峰值水平:T.Bil 2.6±1.5 mg/dL、GOT 165±59 IU/L、GPT 107±49 IU/L;術后除1例由于手術技術問題出現膽漏外所有患者均未發生并發癥而影響出院。因此其結論為肝切除術中結扎脾動脈可有效的預防肝切除術后肝損傷以降低術后死亡率。然而,Sainz-Barriga等[14]針對肝移植的高血流和門靜脈高壓(PHT)前瞻性地評估門靜脈血流(PVF)、門靜脈壓(PVP)和肝靜脈壓力梯度(HVPG)之間的關系,結果是沒有觀察到PVF和PVP之間的相關性,認為PVP對PHT嚴重程度的評估可能具有誤導性。PVF和PVP不應單獨用于評估PHT。由于肝切除術后肝血流動力學變化中反映的PVF、肝動脈血流和PVP之間的關系比較復雜[15],尚需更多的臨床數據和基礎研究來支持。作者的理解是,嚴重PHT與高PVF和肝功能損害存在關聯,脾動脈結扎能降低PVF,且操作簡單、創傷小,對于伴有門靜脈高壓癥脾功能亢進的患者實施外科處理時,結扎脾動脈是較好的選擇。從本組28例病例手術臨床觀察,術后沒有發生脾梗死的發生,可能是源于我們結扎脾動脈主干是靠近其腹腔干分叉處,而胃網膜左動脈、胃短動脈以及脾結腸韌帶及脾膈韌帶間的交通血管仍保障了保留脾臟的血液供應。因此僅行脾動脈結扎不僅有利于肝切除術的安全進行,又避免了不必要的手術創傷有利于患者術后快速康復。本組病例的實踐經驗充分說明:腹腔鏡下肝癌局部切除(或左肝外葉切除)+脾動脈結扎術安全性高,手術時間短、出血少,術后平均住院日僅(6.93±2.90)d,較好地體現了其微創性。
另外,脾切除后易發生不同程度感染其中最嚴重類型如脾切除術后兇險性感染(OPSI)證實了脾臟的免疫功能,保留脾臟的免疫功能可預術后暴發性感染甚至可能延緩肝癌的發生及術后復發[16,17]。通過本組病例資料的回顧性分析:腹腔鏡肝癌切除+脾動脈結扎術后1周,血小板計數和白細胞計數明顯高于術前,基本恢復到正常值,而且患者循環血淋巴細胞亞群比值(CD4+/CD8+)的測定結果也初步說明了僅行脾動脈結扎而保留脾臟能很好的改善患者的免疫功能。本組病例隨訪期間,肝癌再發2人4例次,比例較低,初步說明了保留脾臟的免疫功能對改善肝癌患者長期預后可能有重要意義。
總之,對于肝癌合并肝硬化門靜脈高壓癥的患者,應根據患者綜合評估情況制定個體化的治療方案。腹腔鏡肝切除聯合脾動脈結扎術能以較小創傷達到較為滿意的治療效果。

