EPO干預后人臍帶間充質干細胞對人腎小管上皮細胞纖維化及歸巢能力的影響
蔣紅櫻,張春秀,李晶,賀婷,李萌,雷蕾,白彝華
昆明醫科大學第二附屬醫院腎內科,昆明650101
腎小管間質纖維化(RIF)是慢性腎臟病進展的最終病理表現,其主要特征是腎小管上皮細胞在致纖維化因子特別是轉化生長因子β1(TGF-β1)的誘導下發生轉化,失去其上皮細胞表型,轉變為肌成纖維細胞表型如α平滑肌肌動蛋白(α-SMA)等,導致細胞外基質如纖維連接蛋白(FN)和Ⅳ型膠原(ColⅣ)表達增加,腎組織逐漸纖維化[1]。研究表明,干細胞治療有助于修復受損的腎臟[2]。臨床研究顯示,對腹膜透析患者給予人臍帶間充質干細胞(HUMSCs)治療后,血紅蛋白、血清白蛋白及血清促紅細胞生成素(EPO)水平顯著提高,血清肌酐和尿素氮雖然無明顯改善,但血清胱抑素C明顯下降,部分透析齡超過2年的無尿患者尿量增加[3-4]。動物實驗表明,RIF大鼠給予間充質干細胞(MSC)治療后,血清肌酐和尿素氮有所改善,但并不理想,推測可能與MSC進入體內后趨向多個受損組織,導致歸巢到腎臟的MSC數量減少有關[5]。EPO主要由腎臟皮質及外髓部腎小管周圍的毛細血管內皮細胞生成,具有改善腎小球毛細血管內皮功能的作用。EPO有向腎臟遷徙的特性,是較為理想的MSC動員劑[6]。使用EPO對MSC進行干預后,MSC的增殖分化能力有所增加[6]。我們的前期研究顯示,對RIF大鼠使用EPO干預的MSC進行移植治療后,大鼠腎功能明顯改善,氧化應激指標血清丙二醛(MDA)下降,血清超氧化物歧化酶(SOD)增高,降低了氧化應激水平,抑制了腎臟纖維化[7]。目前的研究報道大多數是使用動物來源的干細胞[7-8],使用HUMSCs干預人腎小管上皮細胞的研究較少。2019年1月—2020年6月,我們采用TGF-β1誘導人腎小管上皮細胞HK-2纖維化,觀察EPO干預后的HUMSCs對HK-2細胞纖維化及歸巢能力的影響,并探討其可能的作用機制。
1 材料與方法
1.1 細胞、試劑與儀器HUMSCs(江陰齊式生物),HK-2細胞(美國ATCC細胞庫)。人重組EPO(沈陽三生),Transwell小室(美國Corning),基質細胞衍生因子1(SDF-1)及其受體CXCR4抗體(美國Abcam),干細胞因子(SCF)抗體(美國Sigma)及SCF受體c-Kit抗體(美國Santa Cruz),DMEM/F12、高糖DMEM培養基(Gibco)和胎牛血清FBS(美國Hy?Clone)。CO2細胞培養箱(美國NAPCO 5410),熒光定量PCR儀(美國ABI Prism 7300),倒置熒光顯微鏡(日本Nikon),酶標儀(美國Bio-Tek),電泳儀(美國Bio-rad)。
1.2 HUMSCs和HK-2細胞的培養將HUMSCs加入含胎牛血清的DMEM/F12培養液、5% CO2、37%飽和濕度的培養箱中培養。培養24 h后,顯微鏡下觀察,細胞基本全部貼壁。在無菌工作臺內,用移液器棄去培養容器內的培養液,更換為新鮮、37℃預熱的完全細胞培養液。培養48~72 h后,進行消化和傳代培養,按1∶2傳代,取第3代細胞用于后續實驗。取凍存的HK-2細胞,加入含牛血清的DMEM/F12培養基,置于37℃、5%CO2培養箱中培養,待細胞生長后更換為無血清培養基繼續培養24 h,顯微鏡下觀察細胞融合至80%時進行傳代接種。
1.3 EPO干預HUMSCs的最佳濃度篩選①Tran?swell檢測細胞遷移能力:取第3代HUMSCs,按4×104/孔接種到6孔的Transwell小室底面,小室置于含10%胎牛血清的DMEM培養液內,分別加入0、1、10、100、500 IU/mL EPO培養72 h。培養結束后,用棉球擦去小室表面未移行的細胞,使用結晶紫溶液染色,倒置顯微鏡下觀察,隨機取6個視野拍照、計數。②MTT法檢測細胞增殖能力:取HUMSCs接種于6孔板,分別加入0、1、10、100、500 IU/mL EPO培養72 h。加入20 μL MTT溶液,培養箱中孵育4 h。測定各孔光密度(OD)值。結果顯示,與加入0 IU/mL EPO的HUMSCs比 較,加 入10、100、500 IU/mL EPO的HUMSCs細胞遷移數量和細胞增殖活力均增加(P均<0.01),且100、500 IU/mL高于1、10 IU/mL,100 IU/mL與500 IU/mL間比較差異無統計學意義(P均>0.05),見表1。故將100 IU/mL EPO作為最佳濃度用于后續實驗。
表1 不同濃度EPO對HUMSCs遷移和增殖能力的影響(±s)

表1 不同濃度EPO對HUMSCs遷移和增殖能力的影響(±s)
注:與0 IU/mL組比較,*P<0.01;與10 IU/mL組比較,△P<0.01。
EPO濃度(IU/mL)0 1 10 100 500細胞遷移數量(個)18.47±2.04 18.78±1.82 28.65±1.74*37.07±2.06*△46.31±2.83*△細胞增殖OD值1.17±0.02 1.24±0.02 1.39±0.06*1.65±0.07*△1.73±0.03*△
1.4 TGF-β1誘導HK-2細胞纖維化的最佳濃度篩選取培養后的HK-2細胞,分別加入0、2、5、10、15、20 μg/L TGF-β1,置于37℃、5% CO2培養箱中培養48 h。收集細胞,采用RT-PCR法檢測TGF-β1、FN、ColⅣ、α-SMA mRNA表 達,Western blotting法檢測TGF-β1、FN、ColⅣ、α-SMA蛋白表達。結果顯示,與加入0 μg/L TGF-β1的細胞相比,加入10、15、20 μg/L TGF-β1的細胞TGF-β1、FN、ColⅣ、α-SMA mRNA和蛋白 表達量均增加(P均<0.01),且三者之間比較差異無統計學意義(P均>0.05)。見表2。考慮到細胞毒性,故將10 μg/L作為TGF-β1的最佳誘導濃度用于后續實驗。
表2 不同濃度TGF-β1對HK-2細胞TGF-β1、FN、ColⅣ、α-SMA mRNA及蛋白表達的影響(±s)

表2 不同濃度TGF-β1對HK-2細胞TGF-β1、FN、ColⅣ、α-SMA mRNA及蛋白表達的影響(±s)
注:與0μg/L組比較,*P<0.05,**P<0.01。
TGF-β1濃度(μg/L)0 2 5 10 15 20 TGF-β1 mRNA 1.03±0.04 1.94±0.25 2.61±0.22 8.25±0.28**10.13±1.02**20.44±1.31**蛋白0.65±0.01 1.32±0.03**1.56±0.04**1.55±0.03**1.71±0.05**1.62±0.04**FN mRNA 1.04±0.03 2.02±0.25 1.93±0.10 5.43±0.13*8.68±1.22**15.34±1.55**蛋白1.03±0.03 1.19±0.03 1.57±0.05**1.62±0.05**1.58±0.04**1.52±0.04**ColⅣmRNA 1.05±0.01 1.66±0.07 3.14±0.20 6.74±0.10**7.50±1.08**15.19±0.74**蛋白0.56±0.01 1.17±0.05**1.45±0.05**1.69±0.07**1.60±0.07**1.57±0.06**α-SMA mRNA 1.06±0.02 1.19±0.13 1.80±0.04 4.19±0.17*8.09±0.74**14.69±0.91**蛋白0.45±0.01 1.13±0.05**1.55±0.05**1.44±0.05**1.55±0.05**1.61±0.04**
1.5 HK-2細胞分組與干預采用Transwell體系進行細胞共培養。Transwell小室中嵌入6孔培養板,將HUMSCs置于上層,加入DMEM/F12培養基;HK-2細胞置于下室,加入DMEM高糖培養基。將細胞分為4組:①對照組:上室內為單純培養基,下室內為HK-2細胞和培養基;②TGF-β1組:上室內為單純培養基,下室內為HK-2細胞加入含10μg/L TGF-β1的培養基;③HUMSCs干預組:上室內為HUMSCs和培養基,下室內為HK-2細胞加入含10μg/L TGF-β1的培養基;④EPO+HUMSCs干預組:上室內為HUMSCs加入含100 IU/mL EPO的培養基,下室內為HK-2細胞加入含10 μg/L TGF-β1的培養基。各組均培養72 h。
1.6 HK-2細胞形態變化與遷移能力觀察取出Transwell小室,PBS沖洗,加入4%甲醛室溫固定30 min。加入0.1%結晶紫染色20 min,清水沖洗3遍以上,將小室底部的膜輕輕取下,將膜的底面朝上,在顯微鏡下觀察細胞的形態和生長情況,比較細胞形態是否發生改變,HK-2是否失去了原有表型分化形成上皮樣細胞和(或)肌成纖維細胞,記數并拍照。
1.7 HK-2細胞纖維化因子及歸巢因子mRNA表達檢測采用RT-PCR法。收集各組共培養后的細胞,加入TRIzol試劑提取細胞總RNA。檢測RNA濃度,取總RNA 1.5 μg進 行逆轉錄,合成cDNA。cDNA 2 μL作用于2×EasyTaq PCR SuperMix擴增目標基因(以人β-actin為內參照)。通過GenBank基因數據庫搜索大鼠TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF基因CDS序列,使用Primer5軟件設計引物,目的基因及內參引物序列見表3。使用Real Time PCR擴增儀進行擴增,擴增條件:95℃預變性5 min;95℃15 s,60℃60 s,共40個循環。衡量結果的參數主要是觀察熔解曲線和擴增曲線,以GAPDH為內參基因,采用2-ΔΔCt法計算纖維化因子TGF-β1、FN、ColⅣ、α-SMA和歸巢因子CXCR4、SDF-1、c-Kit、SCF mRNA的相對表達量。ΔΔCt=實驗組(Ct目的基因-Ct管家基因)-對照組(Ct目的基因-Ct管家基因)。

表3 目的基因及內參引物序列
1.8 HK-2細胞纖維化因子和歸巢因子蛋白表達檢測采用Western blotting法測定TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-kit、SCF蛋白表達。收集各組細胞,加入裂解液裂解細胞,離心15 min,取上清,采用BCA法測定蛋白濃度。取蛋白樣品,每個泳道添加30 μg蛋白樣品進行蛋白電泳。配制SDS-PAGE分離膠,行10%凝膠電泳,將PVDF膜在100%的甲醇溶液中浸潤,然后轉移至清水中浸泡,20 V電壓轉膜,將蛋白固定在PVDF膜上,5%脫脂奶粉封閉。加入稀釋后的一抗(1∶1 000),4℃孵育過夜;TBST溶液洗膜,加入稀釋后的二抗(1∶5 000),室溫孵育1 h。TBST溶液洗膜。加入ECL Plus顯色試劑,曝光,使用Quantity One4.6軟件對蛋白條帶進行半定量,分析其讀數,于Bio-Rad膜成像系統下顯色成像,掃描后用Ultraviolet Transilluminator系統軟件分析。以β-actin為內參,計算目的蛋白的相對表達量。
1.9 統計學方法采用SPSS25.0統計軟件。計量資料以±s表示,多組間比較采用單因素方差分析,組間兩兩比較采用配對t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞形態變化與遷移能力比較顯微鏡下觀察發現,TGF-β1組細胞失去了原有上皮細胞的形態,形成了具有遷移的能力的上皮樣細胞和肌成纖維細胞。對照組、TGF-β1組、HUMSCs干預組、EPO+HUMSCs干預組細胞遷移數量分別為(1.66±1.27)、(9.78±0.73)、(8.95±1.23)、(6.75±0.78)個。與對照組比較,TGF-β1組、HUMSCs干預組、EPO+HUMSCs干預組細胞遷移數量均增加;EPO+HUMSCs干預組細胞遷移數量較HUMSCs干預組和TGF-β1組減少(P均<0.01)。
2.2 各組細胞纖維化因子和歸巢因子mRNA表達比較與對照組比較,TGF-β1組纖維化因子TGF-β1、FN、ColⅣ、α-SMA mRNA表達水平最高,HUMSCs干預組次之,EPO+HUMSCs干預組最低(P<0.05或<0.01)。與對照組比較,TGF-β1組的歸巢因子CXCR4、SDF-1、c-Kit、SCF mRNA表達水平最高,HUMSCs干預組次之,EPO+HUMSCs干預組最低(P<0.05或<0.01)。見表4。
表4 各組細胞TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF mRNA表達比較(±s)

表4 各組細胞TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF mRNA表達比較(±s)
注:與對照組比較,*P<0.05,**P<0.01;與TGF-β1組比較,#P<0.05,##P<0.01。
組別對照組TGF-β1組HUMSCs干預組EPO+HUMSCs干預組TGF-β1 mRNA 1.02±0.01 4.76±0.44**3.72±0.14**1.79±0.06##FN mRNA 1.03±0.01 4.12±0.06**3.46±0.11**##1.76±0.09**##ColⅣmRNA 1.02±0.01 3.35±0.22**3.18±0.31**1.61±0.11##α-SMA mRNA 1.03±0.01 4.13±0.03**3.78±0.22**2.04±0.10**##CXCR4 mRNA 1.03±0.01 4.02±0.25**3.44±0.16**1.90±0.03*##SDF-1 mRNA 1.02±0.01 5.33±0.05**4.19±0.31**#2.05±0.07*##c-Kit mRNA 1.03±0.01 4.93±0.16**4.07±0.01**##1.90±0.03**##SCF mRNA 1.05±0.01 5.70±0.45**4.55±0.06**2.14±0.13##
2.3 各組細胞纖維化因子和歸巢因子蛋白表達比較與對照組比較,TGF-β1組纖維化因子TGF-β1、FN、ColⅣ、α-SMA蛋白表達水平最高,HUMSCs干預組次之,EPO+HUMSCs干預組最低(P<0.05或<0.01)。與對照組比較,TGF-β1組的歸巢因子CXCR4、SDF-1、c-Kit、SCF蛋白表達水平最高,HUMSCs干預組次之,EPO+HUMSCs干預組最低(P<0.05或< 0.01)。見表5。
表5 各組細胞TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF蛋白表達比較(±s)
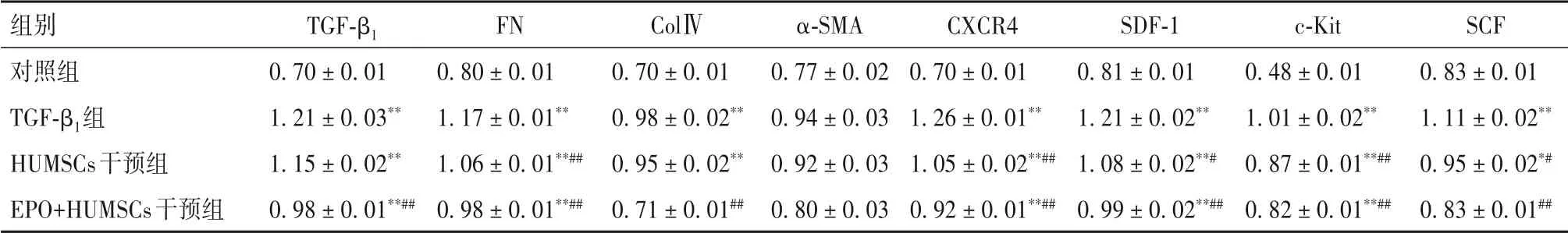
表5 各組細胞TGF-β1、FN、ColⅣ、α-SMA、CXCR4、SDF-1、c-Kit、SCF蛋白表達比較(±s)
注:與對照組比較,*P<0.05,**P<0.01;與TGF-β1組比較,#P<0.05,##P<0.01。
組別對照組TGF-β1組HUMSCs干預組EPO+HUMSCs干預組TGF-β1 0.70±0.01 1.21±0.03**1.15±0.02**0.98±0.01**##FN 0.80±0.01 1.17±0.01**1.06±0.01**##0.98±0.01**##ColⅣ0.70±0.01 0.98±0.02**0.95±0.02**0.71±0.01##α-SMA 0.77±0.02 0.94±0.03 0.92±0.03 0.80±0.03 CXCR4 0.70±0.01 1.26±0.01**1.05±0.02**##0.92±0.01**##SDF-1 0.81±0.01 1.21±0.02**1.08±0.02**#0.99±0.02**##c-Kit 0.48±0.01 1.01±0.02**0.87±0.01**##0.82±0.01**##SCF 0.83±0.01 1.11±0.02**0.95±0.02*#0.83±0.01##
3 討論
RIF在形態學上是因為上皮細胞失去了原有表型和黏附性而分化成具有遷徙和轉移的能力的上皮樣細胞,最終形成肌成纖維細胞,HK-2細胞損傷和功能不全是RIF的關鍵因素和中心環節[9]。α-SMA是一種提示存在纖維化的因子的細胞骨架蛋白,是肌成纖維細胞的特征標志蛋白,FN是細胞外基質的主要成分,其含量可以作為反映組織纖維化程度的主要指標[9-10]。纖維化的腎間質中主要由ColⅣ組成,α-SMA和ColⅣ表達上調說明腎間質纖維化模型成功。本研究發現,體外培養的HK-2在TGF-β1的誘導下,細胞形態由上皮細胞的鋪路石狀變為具有侵襲的能力的長梭形上皮樣細胞,此時纖維化因子α-SMA、FN和ColⅣ的mRNA和蛋白的表達明顯上調,符合肌成纖維細胞的特征。
有學者認為,減少TGF-β1的合成或抑制其受體的活性,可改善纖維化[10]。本研究發現,HUMSCs抑制TGF-β1誘導的HK-2纖維化,其TGF-β1、α-SMA、FN、ColⅣ的mRNA和蛋白的表達都有不同程度下調,細胞的侵襲能力減弱,提示外源性HUMSCs有拮抗TGF-β1的作用,能改善RIF的發生和發展;還發現HUMSCs遷移數量增加,證實了干細胞優先向損傷組織遷移的特征。我們的前期研究發現,干細胞修復慢性腎衰竭時有旁分泌途徑的參與,但是修復能力不是非常理想[4,11],只有少數腎組織結構修復而大部分腎組織無明顯改善,推測其原因可能是歸巢到腎臟的干細胞數量較少,不能滿足腎臟修復的需要。由于RIF過程中受到激活的促炎癥細胞因子如α-SMA、FN、ColⅣ表達增加的影響,干細胞隨血循環進入腎臟后發生凋亡,分裂增殖能力減弱,因此單純的靶向移植細胞修復腎臟的能力是有限的。如果能夠使用某種物質促進干細胞在腎臟的增殖,動員干細胞向腎組織遷徙,抑制其凋亡,增加干細胞歸巢到腎臟的數量,就有希望較好改善受損的腎組織。
目前有多種方法可以促進干細胞增殖,但是由于體系較為復雜,設備條件要求較高而不利于廣泛應用。EPO是一種糖蛋白激素,成人80%的EPO由腎皮質的成纖維細胞生成,20%由肝星狀細胞生成,EPO可通過抗氧化應激、抑制轉分化、抗凋亡等的作用來延緩RIF[6]。CHEN等[12]報道,EPO可阻止TGFβ1誘導HK-2向肌成纖維樣細胞轉分化的作用,這種作用可能是通過調節依賴絲裂原活化的蛋白激酶機制,阻斷Smad信號通路轉導發揮作用。EPO是一種抗凋亡因子,能抑制腎小管上皮細胞凋亡,促進腎小球毛細血管內皮功能的修復、減輕腎臟的病理改變和改善腎功能。EPO誘導MSC增殖修復受損的腎組織,可能是EPO與靶細胞表面的EPO受體結合后激活MSC的JAK2/STAT5信號通路轉導進入細胞核,發揮調節MSC增殖的作用,促進血管再生,阻止細胞凋亡[13]。
本研究結果顯示,不同濃度EPO均可促進HUMSCs的增殖和遷移,且隨著EPO濃度增加,HUMSCs的增殖活力和遷移能力增強。在模擬RIF微環境中,移植EPO處理過的HUMSCs,發現EPO+HUMSCs干預組的纖維化因子FN、ColⅣ、α-SMA表達下降,表明EPO可通過增加干細胞的增殖能力,趨化干細胞向受損的腎組織遷移,抑制腎小管上皮細胞分化成無功能的上皮樣細胞,延緩RIF進展。
歸巢因子具有誘導其受體的細胞定向趨化的能力。SDF-1是CXC趨化因子家族成員,目前多認為CXCR4是SDF-1惟一的受體。SDF-1/CXCR4軸在調控MSC遷移和歸巢中起著必不可少的作用,當SDF-1被分泌后,干細胞遷移至損傷的組織[14],干細胞的趨化和歸巢是未來的研究方向。NEUSS等[15]研究發現,EPO-EPOR在低氧條件下可增強SDF的表達,促進循環中CXCR4的增加,誘導內皮祖細胞定向遷移并參與新血管的形成。動物實驗顯示,急性腎衰竭大鼠腎臟組織中SDF-1表達增強,誘導MSC向靶器官定向遷移[16-17]。SDF-1對MSC表面的CXCR4有極強的化學吸引力,SDF-1與CXCR4的結合有利于MSC的定向遷移和歸巢,可促進MSC的增殖及血管新生[5,14]。c-Kit是SCF的特異性受體,二者結合后能夠調控細胞的生物學作用。細胞遷徙到特定的組織需要SCF和c-Kit的相互作用。有研究發現,增加血管內皮細胞歸巢至損傷組織,是通過SCF增強血管內皮細胞的黏附能力達到的,SCF能誘導CXCR4在造血干細胞上的表達[17]。SDF-1濃度升高后激活MMP-9,促進c-Kit釋放,反過來,c-Kit又可以上調SDF-1來增加細胞動員[5,10]。
本研究結果顯示,TGF-β1刺激HK-2細胞后,細胞中的歸巢因子SDF-1、CXCR4、SCF、c-Kit mRNA和蛋白表達增加,而EPO和HUMSCs干預后歸巢因子mRNA和蛋白表達顯著下調;同時發現代表HUMSCs的綠色熒光在EPO+HUMSCs組明顯增加。可能是TGF-β1上調了SDF-1在HK-2的表達,促進了c-Kit的釋放,c-Kit又刺激SDF-1動員細胞。使用EPO和(或)HUMSCs后降低了SDF-1、CXCR4、SCF和c-Kit的表達,由于損傷的HK-2尚未完全恢復,所以EPO+HUMSCs組的歸巢因子mRNA和蛋白表達仍高于對照組。LOU等[18]認為,SDF-1/CXCR4通路雖然不能促進MSC的分化,但能夠誘導MSC的增殖和遷移。本研究結果與其一致。
綜上所述,在體外使用EPO處理HUMSCs作用于纖維化的人HK-2細胞,發現EPO可促進HUMSCs的增殖和遷移,將HUMSCs定向遷移至受損的HK-2細胞,抑制HK-2細胞分化成具有遷徙能力的無功能的上皮樣細胞,從而延緩HK-2細胞的纖維化進程。本研究對于指導臨床使用EPO干預MSC治療RIF患者提供了較好的實驗依據。

