原發性肝癌患者肝切除術后腸道菌群變化與復發的相關性
王憲紅 高志峰
手術是原發性肝癌(hepatocellular carcinoma,HCC)的主要治療手段,但部分HCC患者術后仍有復發風險,復發后將增加治療難度,提高病死率[1]。因此,早期、準確預測HCC患者肝切除術后復發風險,并盡早干預,對減少術后復發,促進良性預后較重要。近年來,越來越多的研究探討分析HCC的微環境與腸道菌群在肝腸循環中的作用,以期為HCC的治療提供新思路、新想法[2]。腸道菌群是指寄居于人體腸道內的所有微生物。目前,已有研究證實,腸道菌群失調不僅與腸道疾病密切相關,也可影響肝、心、造血等多個系統功能[3]。另有研究指出,腸道菌群可利用調節宿主代謝和免疫功能等方面參與疾病、腫瘤的發生、發展,尤其在肝臟疾病、肝臟腫瘤中可見腸道菌群存在明顯變化[4]。本研究主要觀察HCC患者肝切除術后腸道菌群變化與復發的關系,旨在分析腸道菌群變化能否作為HCC患者術后復發的預測指標。現報告如下。
1 資料與方法
1.1 一般資料
研究的實施獲得醫院倫理委員會批準同意,前瞻選取2017年1月至2018年1月醫院收治符合條件的92例HCC患者作為研究對象,患者及家屬對研究知情,并自愿參加研究,簽署研究知情同意書。92例患者中男性61例,女性31例;年齡40~58歲,平均年齡(49.13±1.63)歲;惡性腫瘤國際臨床病期分期(TNM)[5]:Ⅰ期33例、Ⅱ期59例。
1.2 入選標準
納入標準:①符合《原發性肝癌診療規范(2017版)》[6]中HCC相關診斷標準,且經病理學、影像學等檢查確診;②符合肝切除術手術指征,并接受手術治療;③預計生存時間>3個月;④首次接受手術治療。排除標準:①合并肝內或向其他遠處轉移的患者;②伴菌血癥、感染性休克的患者;③合并其他腫瘤的患者;④因自身問題難以耐受手術的患者;⑤合并其他胃腸道疾病可能影響腸道菌群水平的患者。
1.3 方法
1.3.1 復發判定及分組方法 全部患者術后均隨訪2年,術后每個月定期回院復查肝功能并接受胸部X片檢查,觀察有無復發病灶,且可依據患者主訴進行特殊檢查。隨訪結束時,將全部復發患者納入復發組,剩余患者納入未復發組。
1.3.2 基線資料調查方法 自制基線資料調查問卷,詳細詢問并記錄患者一般情況,內容包括:①年齡;②性別;③吸煙史:一生連續或累計吸煙6個月或以上;④飲酒史:一般超過5年,男性飲酒量≥40克、女性飲酒量≥20克;⑤術中出血量。
1.3.3 實驗室指標檢測方法 腸道菌群:分別于患者術后1、3個月來院隨訪時收集其新鮮大便(收集前1 d電話告知患者需要禁酒及用藥),取0.5 g標本后進行稀釋。稀釋完畢后,選用乳酸桿菌、雙歧桿菌、腸球菌及大腸埃希菌等各個菌群的培養基,培養2~3 d后,采用法國梅里埃公司的自動微生物鑒定儀及軟件鑒定,并計算每克糞便濕重中菌落形成單位對數值。
1.4 統計學方法
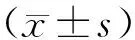
2 結果
2.1 復發情況
隨訪結束時,本研究納入的92例接受肝切除術治療的HCC患者中,有24例患者復發,復發率為26.09%(24/92)。
2.2 2組基線資料對比
2組的基線資料對比,差異無統計學意義(P>0.05)。見表1。

表1 2組的基線資對比(例,%)
2.3 復發組與未復發組的腸道菌群變化情況
術后3個月時,2組的雙歧桿菌、乳酸桿菌數量均較術后1個月時降低,腸球菌和大腸埃希菌數量均較術后1個月時升高,且復發組術后3個月時的雙歧桿菌、乳酸桿菌數量低于未復發組,腸球菌和大腸埃希菌數量高于未復發組,術后1個月與3個月時的各腸道菌群數量差值高于未復發組,差異有統計學意義(P<0.05)。見表2。

表2 復發組與未復發組的腸道菌群變化情況
2.4 術后1個月與3個月時的腸道各菌群數量差值與HCC患者肝切除術后復發關系的回歸分析
將組間基線資料比較結果顯示差異有統計學意義的變量作為自變量納入,均為連續變量,將HCC患者肝切除術后復發情況作為因變量(1=復發,0=未復發),經二元Logistic回歸分析,后將其他全部基線資料納入,建立多元回歸模型,結果顯示,術后1個月與3個月時腸道各菌群數量變化幅度與HCC患者肝切除術后復發有關,變化幅度大可能是HCC患者肝切除術后復發的風險因子(OR>1,P<0.05)。見表3。

表3 術后1個月與3個月時的腸道各菌群數量變化與HCC患者肝切除術后復發關系的回歸分析結果
2.5 HCC患者腸道各菌群數量變化預測肝切除術后復發的效能分析
將術后1個月與3個月時的腸道各菌群數量差值作為檢驗變量,肝切除術后復發情況作為狀態變量(1=復發,0=未復發),經ROC曲線分析結果顯示,術后1個月與3個月時腸道各菌群數量變化差值預測HCC患者肝切除術后復發的AUC分別為0.804、0.768、0.835、0.790,預測價值均理想。見圖1。腸道各菌群數量變化對應最佳閾值、特異度、敏感度及約登指數見表4。

表4 HCC患者腸道各菌群數量變化預測肝切除術后復發的效能分析

圖1 HCC患者腸道各菌群數量變化預測肝切除術后復發的ROC曲線圖
3 討論
HCC患者治療方案較多,包括局部消融治療、放射治療、肝切除術等,其中肝切除術是首選術式,對于符合手術適應證的患者,該治療方案效果確切,但HCC具有高復發率,部分患者即便是接受理想的手術治療,術后仍存在復發風險,長期預后仍較差[7]。因此,探尋與HCC患者肝切除術后復發有關的標志物尤為重要。
文獻指出,HCC術后5年復發率高達60%,且主要集中在術后2年左右[8]。而本研究結果顯示,全部92例HCC患者經肝切除術治療后,隨訪2年期間有24例復發,復發率為26.09%,雖遠低于上述研究結果,但并不能提示患者復發風險降低,且得到該結果也可能與未納入晚期HCC患者、樣本量少有關。肝臟是重要代謝器官之一,具有一定的免疫調節功能。人體腸道在長期進化過程中已形成約有10萬億個的穩定腸道菌群,主要分為以雙歧桿菌為代表的優勢菌群和以大腸埃希菌為代表的次要菌群,上述菌群的代謝產物主要由肝臟門脈系統完成分解及排放,與肝臟關系密切,共同承擔調節代謝、免疫的作用[9-10]。近年來,有大量研究指出,腸道菌群不僅與營養不良、糖尿病等疾病密切相關,且內分泌、飲食習慣等也與腸道菌群的平衡性存在關聯[11-12]。另有研究結果表明,癌癥與腸道菌群也存在一定的關系,癌癥的預防、發生、發展及治療全周期中,均可見腸道微生物參與其中[13]。
因術后復發涉及腫瘤的增殖與轉移,結合腸道菌群與腫瘤的關系,推測腸道菌群變化與HCC患者肝切除術后復發有關。本研究結果顯示,復發組術后1個月與3個月時的雙歧桿菌、乳酸桿菌、腸球菌、大腸埃希菌數量差值高于未復發組,初步提示腸道各菌群數量變化可能與HCC患者肝切除術后復發有關。進一步回歸分析結果顯示,腸道菌群與HCC患者肝切除術后復發有關,術后腸道各菌群數量變化幅度大可能是HCC患者肝切除術后復發的風險因子,證實猜測。簡單分析可能的原因:HCC患者肝切除術后,代謝解毒能力有所下降,將導致腸道菌群多樣性發生變化,優勢菌群減少,而有害菌群數量及代謝產物增加,繼而加重肝臟的炎癥反應,加重損傷,從而為腫瘤細胞的生長提供有利條件,增加復發風險[14-15]。并且,肝癌患者因肝臟不同程度受損,受損肝臟難以有效清除腸道腐敗菌產生的有害物質,將導致腸道菌群發生變化,繼而通過免疫系統、血液循環等途徑進一步加重肝臟受損程度,促進腫瘤細胞生長,進而增加復發風險[16-17]。最后,本研究繪制ROC曲線分析腸道菌群變化預測HCC患者肝切除術后復發的價值結果顯示,術后1個月與3個月時腸道各菌群數量變化差值預測HCC患者肝切除術后復發的AUC分別為0.804、0.768、0.835、0.790,表明腸道菌群變化不僅可能是HCC患者肝切除術后復發的風險因子,也可作為HCC患者肝切除術后復發預測標志物。上述結果也表明,早期可動態檢測HCC患者肝切除術的腸道菌群,若發現異常變化,建議可以為患者實施抗炎、補充維生素C等干預,以幫助腸道菌群平衡狀態恢復,對減少肝切除術后復發可能有一定價值。
綜上所述,HCC患者肝切除術后復發可能與腸道菌群異常變化有關,臨床可考慮通過早期監測HCC患者的腸道菌群變化情況,預測復發風險并指導干預,積極控制腸道菌群變化,可能對減少復發、促進良性預后有積極意義。

