射頻消融術對良性甲狀腺瘤患者甲狀腺功能及HSP70蛋白表達的影響
王 恒 伍 軍
甲狀腺瘤(TT)病因未明確,內分泌及精神壓力等均可能是良性TT發病的常見誘因,據報道,TT多發于青年女性,且約10%~25%患者存在惡變可能[1]。目前,外科手術是治療良性TT的主要手段之一,傳統甲狀腺切除術雖可有效切除病灶,降低惡變可能,但切口較大,且術后易復發,應用受限[2]。隨著醫療技術不斷發展,微創治療逐漸受到醫師及患者青睞,射頻消融術(RFA)因具有操作簡單、創傷小、美觀性佳等優勢,逐漸被應用到TT治療中[3-4]。但消融也可能對患者正常甲狀腺組織造成損傷,RFA在TT中應用安全性及有效性仍待探討;此外,機體自身保護機制在消融過程中是否發揮作用尚未明確[5]。由此可見,RFA在良性TT患者中具體應用價值尚未達成統一共識,仍有待探究。本研究主要觀察RFA應用在良性TT患者中的價值,重點對患者的甲狀腺功能及熱休克蛋白70(HSP70)表達變化進行觀察,旨在指導TT手術方案的優化,具體如下。
1 資料與方法
1.1 一般資料
選取2017年1月至2019年12月本院接收69例良性TT患者為研究對象,通過隨機數字表法分為對照組(n=35)及觀察組(n=34),本研究經醫學倫理委員會批準,患者與家屬知情同意。對照組中女性23例,男性12例;年齡30~41歲,平均年齡(35.63±1.01)歲;體質量指數(BMI)18.2~25.9 kg/m2,平均(22.03±1.21)kg/m2;結節體積2.4~6.3 cm3,平均(4.02±0.52)cm3。觀察組中女性22例,男性12例;年齡29~40歲,平均年齡(35.70±1.03)歲;BMI 18.0~26.3 kg/m2,平均(22.06±1.19)kg/m2;結節體積2.2~6.1 cm3,平均(4.04±0.53)cm3。兩組患者一般資料比較(P>0.05),有可對比性。
1.2 入選標準
1.2.1 納入標準 ①符合相關標準[6]中良性TT診斷標準,且均經術前影像學、穿刺病理檢查及術后病理組織活檢確診為良性;②均在本院完成治療,且術后獲得隨訪結果,預計生存時間>6個月;③均為單發病灶;④精神正常,依從性好,可配合完成本次研究。
1.2.2 排除標準 ①合并惡性腫瘤;②合并心、腎或肝等重要臟器病變;③伴凝血功能異常;④既往有放射治療史;⑤甲狀旁腺穿刺困難,無法徹底消融。
1.3 方法
1.3.1 對照組 傳統甲狀腺切除術,患者取仰臥位,適當墊高肩部,常規消毒鋪巾,利用2%利多卡因局部浸潤麻醉,于胸骨上緣約2 cm處,沿皮紋作約4~7 cm弧形切口,沿喉結至胸鎖關節,切開皮膚、皮下組織,使甲狀腺充分暴露,處理甲狀腺韌帶及血管,利用常規方法進行同側甲狀腺部分切除術(包含腺瘤),過程中仔細辨認并保護喉返神經及甲狀旁腺;徹底止血,經切口放置引流管,逐層縫合,關閉切口。術后給予常規抗感染處理。
1.3.2 觀察組 實施RFA治療,術前可通過超聲(飛利浦IU22型超聲)明確甲狀腺結節部位及大小,確定穿刺點及途徑;患者取仰臥位,將肩部墊高,充分暴露頸部,常規消毒鋪巾,采用2%利多卡因進行局部麻醉,并采用液體隔離帶法保護喉返神經;在超聲引導下對穿刺途徑浸潤麻醉,對皮膚及皮下組織切開1~2 mm切口,將射頻電極針經切口送至靶結節部位,進行RFA治療(邁德S-500L射頻治療儀);利用多點及多面移動方式進行RFA治療,隨著RFA進行,當射頻儀器發出蜂鳴聲提示RFA結束;調整電極至下一個消融區,如此反復,直至整個結節消融完成。術后對消融區進行15 min壓迫止血,并給予止血及補液等治療。
1.4 評價指標
腫瘤縮小情況:采用飛利浦IU22型超聲檢測患者術前、術后6個月結節形態、大小等信息并計算,結節體積=π/6×abc,其中a、b、c分別為結節最大長度、寬度及厚度;通過計算結節縮小率(VRR)比較腫瘤縮小情況,其中VRR=(術前結節體積-術后6個月體積)/術前體積×100%。甲狀腺功能:采集患者術前、術后6個月清晨空腹靜脈血 5 ml,以3000 r/min速率離心10~15 min(日本日立CS150NX),分離血清;采用酶聯免疫吸附法檢測血清游離三碘甲狀原氨酸(FT3)、促甲狀腺激素(TSH)、游離甲狀腺素(FT4)水平;HSP70蛋白表達:每個結節選擇3個觀察區域(中央區、邊緣區、過渡區),術前、術后即刻對3個區域穿刺取材,甲醛固定,采用免疫組化法檢測HSP70蛋白表達;在×400倍視野下,隨機選3個視野觀察,采用半定量法判讀陽性表達,染色強度(0分:無染色;1分:淡黃色;2分:棕黃色;3分棕褐色)與陽性細胞占比(0分:占比≤5%;1分:5%<占比≤25%;2分:25%<占比≤50%;3分:50%<占比≤75%;4分:占比>75%)之和為最終得分;其中總分≤3分為陰性;反之為陽性。并發癥:記錄并比較兩組喉返神經損傷(患者出現聲音嘶啞、飲水嗆咳等癥狀,經喉鏡檢查確診)、放射性牙痛(患者出現牙痛癥狀可判斷)、放射性耳根痛(患者出現耳根痛癥狀可判斷)等并發癥發生情況,并計算發生率=(并發癥發生例數/總例數)×100%。
1.5 統計學方法
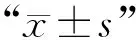
2 結果
2.1 腫瘤縮小情況
觀察組術后6個月結節體積小于對照組,VRR高于對照組,差異有統計學意義(P<0.05)。見表1。
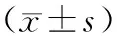
表1 兩組術后6個月腫瘤縮小情況比較
2.2 甲狀腺功能
術后6個月,兩組FT3、FT4、TSH較術前無顯著變化(P>0.05);且兩組間術前、術后6個月比較差異均無統計學意義(P>0.05)。見表2。
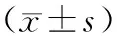
表2 兩組甲狀腺功能比較
2.3 HSP70蛋白表達
對照組術前、術后即刻3個區域HSP70蛋白表達均無明顯變化(P>0.05);觀察組術后即刻中央區、邊緣區HSP70蛋白表達與術前比較無顯著差異(P>0.05),但過渡區HSP70蛋白表達高于術前,且高于對照組(P<0.05)。見表3。

表3 兩組HSP70蛋白表達比較(例,%)
2.4 并發癥
兩組并發癥發生率比較差異無統計學意義(P>0.05),見表4。

表4 兩組并發癥發生率比較(例,%)
3 討論
手術是治療良性TT主要手段之一,與保守治療比較,具有見效快、病灶清除更徹底等優勢,成為TT治療首選[7]。以往傳統甲狀腺切除術多在直視下切除術野內TT組織,雖然可取得理想治療效果,但其創傷大,術中出血量多,術后常留疤痕,不符合美學要求,患者接納度低,且術后易發生一系列并發癥,預后不佳[8-9]。因此,尋求其他安全、有效的手術方式十分必要。
RFA是1種微創治療技術,主要利用射頻電極發出射頻波,使周圍組織中離子及大分子震蕩,相互撞擊,產生摩擦,產生一定熱量將靶區加熱至一定溫度,使細胞失活,進而達到治療效果[10]。RFA具有微創、皮膚無瘢痕、操作簡單、殺滅腫瘤效果好等優勢,目前被廣泛用于治療肝臟、肺、甲狀腺及乳腺等部位良惡性腫瘤[11]。此外,RFA可在一定程度上保留TT患者甲狀腺正常功能,對于多發結節可進行逐個定點消融,避免多次進行手術帶來創傷[12]。但臨床實踐發現,RFA可能會損傷病灶周圍血管及神經,術前在靠近血管或神經的結節與周圍組織被膜間隙注入適當氯化鈉溶液,形成隔離帶,以保護病灶周圍組織[13]。目前,關于RFA應用在良性TT患者中具體獲益情況仍未達成統一共識。
FT3、FT4、TSH均是反映機體甲狀腺功能的重要指標,其中FT3、FT4對蛋白質的合成、能量產生及調節均有一定作用;TSH可在一定程度上促進甲狀腺激素合成及分泌[14]。本研究結果顯示,觀察組術后6個月結節體積小于對照組,VRR高于對照組,術后6個月,兩組FT3、FT4、TSH較術前無明顯變化,且兩組間各時點比差異不顯著,提示RFA應用在TT患者中,療效確切,更利于縮小腫瘤體積,且對患者甲狀腺功能無較大影響,安全性高。這也與雍偉等[15]研究結論一致。分析其原因可能為,RFA屬于微創技術,通過射頻及微波等方式產生一定熱量,可以快速使腫瘤組織凝固、壞死,且在超聲引導下定位較為精準,效果較好[16]。此外,RFA利用液體隔離帶法,可有效預防甲狀腺周圍組織因消融損傷,對甲狀腺功能無影響[17]。
HSP遇熱情況下,可用于保護細胞,HSP70是HAP常見類型之一,不僅具有HSP作用機制,還可在一定程度上減輕機體炎癥反應,調節免疫功能[18]。正常狀態下,HSP70表達量較低,遇到相應刺激后表達顯著升高,進而起到保護細胞的作用[19]。本研究結果顯示,觀察組術后即刻中央區、邊緣區HSP70蛋白表達與術前比無顯著差異,但過渡區HSP70蛋白表達高于術前及對照組,且對照組各時點3個區域HSP70蛋白表達均無顯著差異,提示RFA可有效提高患者過渡區HSP70蛋白表達,進而保護病灶周圍正常細胞,安全性高。分析其原因可能為,過渡區是病灶周圍相應范圍內的正常組織,主要在消融區域之外,該區域細胞仍存在一定活力,受到一定程度熱刺激,HSP70表達顯著高于治療前,進而發揮自我保護作用,證實RFA對消融區域外正常組織損傷小,安全性高[20]。分析中央區及邊緣區HSP表達無顯著升高的原因可能為,射頻熱量生成較快,且強度高,導致HSP70還未合成,組織內細胞便凝固,喪失生成HSP能力[21]。本研究中兩組并發癥發生率并無明顯差異,提示RFA在降低患者并發癥方面無明顯優勢,但因本研究樣本量及隨訪時間有限,具體結論仍待證實。
綜上所述,RFA應用在良性TT患者中,療效確切,可提高結節縮小率,對甲狀腺功能無損傷,利于提高過渡區HSP70蛋白表達,具有較高應用價值。

