氧化還原反應(yīng)五規(guī)律
■侯晨鷂
一、性質(zhì)強(qiáng)弱規(guī)律

具有較強(qiáng)氧化性的氧化劑跟具有較強(qiáng)還原性的還原劑反應(yīng),生成具有較弱還原性的還原產(chǎn)物和具有較弱氧化性的氧化產(chǎn)物。氧化性的強(qiáng)弱順序:氧化劑>氧化產(chǎn)物。還原性的強(qiáng)弱順序:還原劑>還原產(chǎn)物。
該規(guī)律常用于:①判斷物質(zhì)氧化性或還原性的相對(duì)強(qiáng)弱;②判斷某氧化還原反應(yīng)能否正常發(fā)生。
例1根據(jù)反應(yīng)式:①2Fe3++2I-2Fe2++I2,②Br2+2Fe2+2Br-+2Fe3+,可判斷出離子的還原性從強(qiáng)到弱的順序是( )。
A.Br-、Fe2+、I-B.I-、Fe2+、Br-
C.Br-、I-、Fe2+D.Fe2+、I-、Br-
解析
反應(yīng)①中還原劑是I-,還原產(chǎn)物是Fe2+,故還原性I->Fe2+;反應(yīng)②中還原劑是Fe2+,還原產(chǎn)物是Br-,故還原性Fe2+>Br-。綜合起來(lái)可知還原性I->Fe2+>Br-。
答案:B
二、電子守恒規(guī)律
氧化還原反應(yīng)中得電子總數(shù)與失電子總數(shù)相等(即電子轉(zhuǎn)移守恒)。表現(xiàn)在氧化還原反應(yīng)中,氧化劑元素化合價(jià)降低總數(shù)與還原劑元素化合價(jià)升高總數(shù)相等。
該規(guī)律常用于:①氧化還原反應(yīng)方程式的配平;②氧化還原反應(yīng)的相關(guān)計(jì)算。
例2足量銅與一定量濃硝酸反應(yīng),得到硝酸銅溶液和NO2、N2O4、NO 的混合氣體,將這些氣體與1.68LO2(標(biāo)準(zhǔn)狀況)混合后通入水中,所有氣體完全被水吸收生成硝酸。若向所得硝酸銅溶液中加入5mol·L-1NaOH 溶液至Cu2+恰好完全沉淀,則消耗NaOH 溶液的體積是( )。
A.60mL B.45mL
C.30mL D.15mL
解析
由題意可知,Cu 足量則HNO3完全反應(yīng),反應(yīng)中Cu 失去的電子給了 HNO3,生成了還原產(chǎn)物(NO2、N2O4、NO),但最終這些還原產(chǎn)物(NO2、N2O4、NO)又被氧化為HNO3,即相當(dāng)于Cu失去的電子最終給了O2,且Cu失去的電子數(shù)與O2得到的電子數(shù)相等。故n(Cu)=2(O2)=2 ×=0.15mol。又根據(jù)NaOH 和Cu(NO3)2的反應(yīng)可得關(guān)系式n(NaOH)=2n[Cu(NO3)2]=2n(Cu)=0.3mol,則V(NaOH)==0.06L=60mL。
答案:A
三、價(jià)態(tài)性質(zhì)規(guī)律
根據(jù)元素的價(jià)態(tài)可以判斷物質(zhì)的氧化性、還原性。例如N 元素:在中只有還原性,在中只有氧化性,在中既有氧化性又有還原性。同種元素具有多種價(jià)態(tài)時(shí),處于最低價(jià)時(shí)只有還原性,處于最高價(jià)時(shí)只有氧化性,處于中間可變價(jià)時(shí)既有氧化性又有還原性,總結(jié)為“高價(jià)氧化,低價(jià)還,中間價(jià)態(tài)兩邊轉(zhuǎn)”。另外注意元素處于最低價(jià)時(shí)只有還原性,但還原性不一定強(qiáng),如F-的還原性極弱;元素處于最高價(jià)時(shí)只有氧化性,但氧化性不一定強(qiáng),如Na+的氧化性極弱。
該規(guī)律常用于判斷所給微粒的性質(zhì)及其在氧化還原反應(yīng)中所對(duì)應(yīng)的可能產(chǎn)物。
例3下列物質(zhì)中,按只有氧化性、只有還原性、既有氧化性又有還原性的順序排列的一組是( )。
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2D.O2、SO2、H2O
解析
F 元素沒(méi)有正價(jià),所以F2只有氧化性,金屬元素沒(méi)有負(fù)價(jià),所以金屬單質(zhì)(K、Al)只有還原性;HCl中只有氧化性,只有還原性,所以HCl既有氧化性又有還原性;H2O 中只有氧化性,只有還原性,所以H2O 既有氧化性又有還原性;NO2中和SO2中處于中間價(jià)態(tài),既可以得到電子表現(xiàn)氧化性,又可以失去電子表現(xiàn)還原性;H2中、Cl2中和Br2中均處于中間價(jià)態(tài),既可以得到電子表現(xiàn)氧化性,又可以失去電子表現(xiàn)還原性。
答案:A
四、價(jià)態(tài)轉(zhuǎn)化規(guī)律
含同種元素不同價(jià)態(tài)的物質(zhì)間發(fā)生氧化還原反應(yīng)時(shí),該元素價(jià)態(tài)的變化基本都遵循“高價(jià)+低價(jià)→中間價(jià)”的規(guī)律。這里的中間價(jià)可以相同(謂之“靠攏”),也可以不同——但此時(shí)必是高價(jià)轉(zhuǎn)變成較高中間價(jià),低價(jià)轉(zhuǎn)變成較低中間價(jià)(謂之“不交叉”),總結(jié)為“價(jià)態(tài)相鄰能共存,價(jià)態(tài)相間能歸中;歸中價(jià)態(tài)不交錯(cuò),低升高降只靠攏”。另外注意同種元素相鄰價(jià)態(tài)間不發(fā)生氧化還原反應(yīng)。
該規(guī)律常用于:①判斷同種元素不同價(jià)態(tài)的物質(zhì)間發(fā)生氧化還原反應(yīng)的可能性;②根據(jù)化合價(jià)及性質(zhì)判斷某反應(yīng)體系中的氧化劑、還原劑、氧化產(chǎn)物及還原產(chǎn)物。
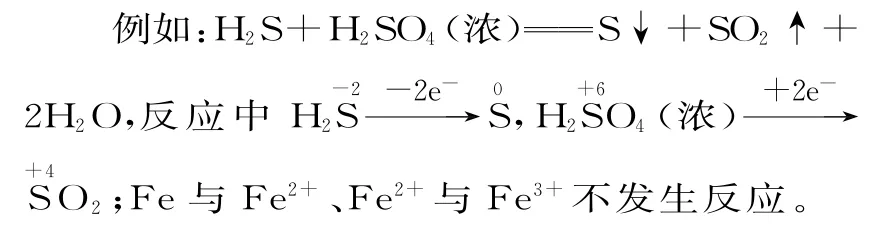
例4下列關(guān)于反應(yīng)HCl+KClO3KCl+Cl2↑+H2O(未配平)的說(shuō)法正確的是( )。
A.反應(yīng)中每生成1 molCl2轉(zhuǎn)移電子6mol
B.Cl2是氧化產(chǎn)物,KCl是還原產(chǎn)物
C.氧化劑和還原劑的物質(zhì)的量之比為1∶5
D.方程式配平的系數(shù)分別為5、1、1、3、3
解析
解本題的關(guān)鍵是找準(zhǔn)氧化劑和還原劑、氧化產(chǎn)物和還原產(chǎn)物,根據(jù)價(jià)態(tài)轉(zhuǎn)化規(guī)律可知KClO3是氧化劑,HCl是還原劑,Cl2既是氧化產(chǎn)物又是還原產(chǎn)物,KCl不是還原產(chǎn)物,B 項(xiàng)錯(cuò);每生成3molCl2轉(zhuǎn)移電子5mol,A 項(xiàng)錯(cuò);方程式配平的系數(shù)分別為6、1、1、3、3,D 項(xiàng)錯(cuò)。由,根據(jù)得失電子守恒可知氧化劑和還原劑的物質(zhì)的量之比為1∶5,C項(xiàng)正確。
答案:C
五、強(qiáng)先弱后規(guī)律
在濃度相差不大的溶液中,同時(shí)含有幾種還原劑時(shí),若加入氧化劑,則它優(yōu)先與溶液中還原性最強(qiáng)的還原劑作用,如Cl2與FeBr2溶液的反應(yīng)先考慮Cl2氧化Fe2+,再考慮Cl2氧化Br-;Cl2與FeI2溶液的反應(yīng)先考慮Cl2氧化I-,再考慮Cl2氧化Fe2+;同理,同時(shí)含有幾種氧化劑時(shí),若加入還原劑,則它優(yōu)先與溶液中氧化性最強(qiáng)的氧化劑作用,如在含有Fe3+、Cu2+、H+的溶液中加入鐵粉,因?yàn)檠趸訤e3+>Cu2+>H+,所以鐵粉先與Fe3+反應(yīng),然后依次與Cu2+、H+反應(yīng)。
該規(guī)律常用于判斷微粒發(fā)生氧化還原反應(yīng)的先后順序和判斷離子方程式書(shū)寫(xiě)的正誤。
例5向含有FeBr2、FeI2的溶液中緩緩?fù)ㄈ胍欢康穆葰夂?再向溶液中滴加KSCN 溶液,溶液變?yōu)榧t色,若只從反應(yīng)順序角度考慮反應(yīng)情況,則下列敘述不正確的是( )。
A.通入氯氣后的溶液中一定不存在I
B.通入氯氣之后原溶液中的Fe2+全部被氧化
C.原溶液中的Br-可能被氧化
D.若取少量所得溶液,再加入CCl4溶液充分振蕩、靜置、分液,下層溶液呈紫紅色
解析
溶液中離子的還原性強(qiáng)弱順序?yàn)镮->Fe2+>Br-。溶液變?yōu)榧t色說(shuō)明Fe2+被氧化成Fe3+,則I-全部被氧化,故溶液中一定不存在I-,A 項(xiàng)正確;Fe2+可能全部被氧化,也可能是部分氧化,B項(xiàng)錯(cuò)誤;溶液變?yōu)榧t色只能說(shuō)明Fe2+被氧化成Fe3+,而B(niǎo)r-可能被氧化,C 項(xiàng)正確;根據(jù)題意知有I2生成,I2易溶于有機(jī)溶劑,則下層溶液呈紫紅色,D 項(xiàng)正確。
答案:B
感悟與提高
1.已知SO2、I-、Fe2+、H2O2、Cl-在酸性溶液中均有還原性,且它們的還原性依次減弱,則下列反應(yīng)不能發(fā)生的是( )。
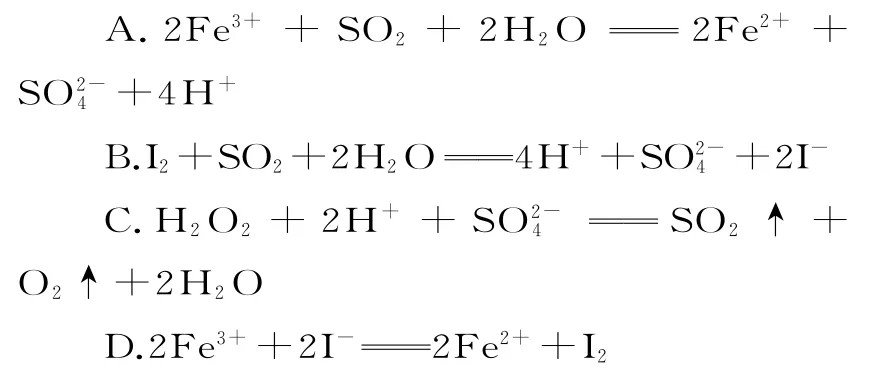
2.硫酸銨在強(qiáng)熱條件下分解,生成氨、二氧化硫、氮?dú)夂退7磻?yīng)中生成的氧化產(chǎn)物和還原產(chǎn)物的物質(zhì)的量之比是( )。
A.1∶3 B.2∶3
C.1∶1 D.4∶3
3.工業(yè)廢水中的NaNO2可用鋁粉除去,已知此體系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O 六種物質(zhì)。該反應(yīng)的化學(xué)方程式為_(kāi)___。
4.已知G、Q、X、Y、Z均為含氯元素的化合物,在一定條件下有下列轉(zhuǎn)化關(guān)系(未配平):

這五種化合物中Cl元素化合價(jià)由低到高的順序是( )。
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
5.今有下列三個(gè)氧化還原反應(yīng):
①2FeCl3+2KI2FeCl2+2KCl+I2
②2FeCl2+Cl22FeCl3
③2KMnO4+16HCl2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而又不除去Fe2+和Cl-,可加入的試劑是( )。
A.Cl2B.KMnO4
C.FeCl3D.HCl
參考答案
1.C 提示:C 項(xiàng)反應(yīng)中氧元素的化合價(jià)升高,硫元素的化合價(jià)降低,則H2O2為還原劑,還原性強(qiáng)弱為H2O2>SO2,與已知的還原性強(qiáng)弱不一致,反應(yīng)不能發(fā)生。

3.2 Al+NaNO2+NaOH+2H2O2NaAlO2+NH3·H2O 提示:分析該體系可知,只有Al和N 元素化合價(jià)發(fā)生變化,金屬鋁只有還原性,在NH3中只有還原性,且還原性Al>N,而亞硝酸鈉具有較強(qiáng)的氧化性,所以發(fā)生的反應(yīng)是亞硝酸鈉和金屬鋁之間的反應(yīng),即2Al+NaNO2+NaOH+2H2O2NaAlO2+NH3·H2O。
4.A 提示:由①得出價(jià)態(tài)Q 高于G,因?yàn)镚 必介于Q 和-1價(jià)的Cl之間,-1價(jià)為氯元素的最低價(jià)。將該結(jié)論引用到③,Y介于Q與G之間,故有價(jià)態(tài)Q高于Y,價(jià)態(tài)Y高于G。分析②:H2O中的H化合價(jià)降低,則Q 中的氯元素轉(zhuǎn)變?yōu)閄 中的氯元素,化合價(jià)必升高,則得出價(jià)態(tài)X 高于Q。最后分析④:Z介于Q、X 之間,則價(jià)態(tài)X 高于Z,價(jià)態(tài)Z高于Q。

