微動力負壓護創對糖尿病大鼠創面血管生成及其受體表達的影響〔1〕
朱艷,宗明,盛霞,江芳芳,胡玲,熊國平,付海燕,秦淑蘭*
(1.南昌大學第三附屬醫院,江西 南昌 330008;2.南昌市第三醫院,江西 南昌 330008)
糖尿病足創面屬于難治性創面,其特點是致殘率高、花費高、病程長,給患者和家庭帶來了沉重負擔。目前研究證實[1],創面的愈合過程大致包括了早期(炎癥反應期)、中期(細胞組織增生期)及晚期(組織結構及功能重塑期)。臨床常見的全身性疾病合并慢性潰瘍、壓瘡等慢性創面時,由于組織的嚴重缺損及反復發作的炎癥常導致創面不能自愈。隨著醫療技術的不斷發展,近年來出現的負壓創面治療技術被證實具有明顯減輕創面水腫、縮短創面愈合時間、增加創面血液供應的作用,被廣泛應用于治療各種慢性創面,并取得了良好的效果。微動力負壓技術是一種全新的臨床封閉治療方法,屬于負壓創面治療技術的一種,但其優點在于治療期間患者的活動更加方便,利用新型材料覆蓋創面后再用醫用透明貼膜完全貼合密封,創造密閉負壓環境達到治療效果。目前微動力負壓護創治療對燒傷創面的作用機制可見少量報道,但對糖尿病足創面血管的分子信號通路影響,國內外尚無深入的研究,本文就此展開研究,報告如下。
1 材料與方法
1.1 實驗動物
選取50 只雄性無特定病原體(SPF)級封閉群級斯潑累格·多雷(SD)大鼠(由南昌大學實驗動物中心提供,8 周齡,體質量200~250 g),進行1周的適應性喂養,飼養環境溫度(25±1) ℃,飼養濕度(50±2)%,符合中國國家技術委員會頒布的《實驗動物管理條例》[2]。采用隨機數字表法將其分為觀察組與對照組,每組25 只。
1.2 實驗主要材料及試劑
多聚甲醛(購自美國Sigma公司);CD31抗體(購自美國R&D公司);反轉錄試劑盒(購自日本TaKaRa公司);SYBR Green熒光定量檢測試劑盒(購自日本TaKaRa公司);微動力負壓護創敷料(購自廣州美捷威通生物科技有限公司);異氟烷(購自中國河北九派制藥公司);戊巴比妥鈉(購自美國Sigma公司)。
1.3 儀器
深低溫冰箱(購自瑞士Nuaire公司);FSX100生物圖像導航儀(購自日本Olympus公司);IQ5TMreal-time PCR儀(購自美國Beckman Coulter公司);穩豪微型血糖儀(購自美國強生公司);千分之一電子天平(購自瑞士Mettle-Toledo公司);激光多普勒血流成像儀(購自瑞典Perimed AB公司);光學顯微照相機(購自日本佳能公司)。
1.4 方法
糖尿病大鼠模型制備:完成1 周的適應性喂養后,采用高糖高脂飼料(蔗糖20%、豬油18%、蛋黃3%、基礎飼料59%)喂養4 周,采用濃度為1%的鏈脲佐菌素(STZ)30 mL/kg腹腔注射構建糖尿病模型,注射后3 d檢測尾靜脈血糖,血糖≥16.67 mmol/L為造模成功;不成功的再次1% STZ 10 mL/kg標準注射。造模成功后,血糖≥30 mmol/L的大鼠皮下注射長效胰島素,隔日2~4 IU,保持大鼠活力,避免出現酮癥酸中毒。
創面大鼠模型制備[3]:腹腔注射濃度為1%的巴比妥鈉全麻,劑量為50 mg/kg。用剃毛機將大鼠背部毛發完全剃除,采用濃度為10%的硫化鈉進一步脫毛,然后復蘇備用。脫毛后1 d大鼠吸入濃度為體積分數3%的異氟烷全身麻醉,俯臥位,75%的乙醇消毒脫毛區,在大鼠背部正中切除2 cm×2 cm全層皮膚制備創面,壓迫止血。創面處理:對照組大鼠創面隔日給予普通常規換藥,每兩天1次;觀察組給予微動力負壓護創治療,根據創面大小及形狀剪裁覆膜,每周更換1次,連續14 d。
1.5 觀察指標
比較兩組大鼠治療后每周的血糖、創面血管密度與創面血流量。治療前及治療當日、治療后1周、治療后2周,每組取5 只大鼠,用激光多普勒血流成像儀檢測創面血流量,檢測時掃描窗口大小統一為10.0 cm×10.0 cm,探頭距創面距離統一為14.0 cm,檢測結果單位為PU。治療前及治療當日、治療后1周、治療后2周,每組取5只大鼠處死后距創緣0.5 cm擴大環形切取創面組織至深筋膜淺層,將切取的組織縱行分成左右兩半,右側組織凍存于液氮中備用;采用濃度為4%的甲醛溶液將左側組織固定,固定后進行石蠟包埋切片,行CD31免疫組織化學染色。根據CD31表達情況,每只大鼠選取3 張切片,采用生物圖像導航儀在100倍視野下觀察并計數血管數目,每張切片選取5 個視野,計算創面微血管密度,單位為條/視野。比較兩組大鼠治療前后創面血管內皮生長因子(VEGF)、血管內皮生長因子受體1(Fit-1)、血管生成素(Ang)-1,Ang-2及酪氨酸激酶受體(Tie-2)的mRNA表達水平。對凍存的右側組織采用實時熒光定量PCR儀進行熒光定量分析,在無RNA酶情況下提取總RNA并進行定量,而后進行反轉錄,反轉錄完成后使用SYBR Green熒光定量檢測試劑盒檢測上述指標水平。
1.6 統計學方法
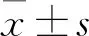
2 結 果
2.1 兩組大鼠治療前后血糖和創面血流量及血管密度比較
觀察組大鼠治療當天、治療后1周、治療后2周創面血流量顯著高于對照組(P<0.05);治療后1周、治療后2周血管密度顯著高于對照組(P<0.05);兩組治療期間各時間段血糖水平比較,差異無統計學意義(P>0.05)(見表1)。

表1 兩組大鼠治療前后血糖和創面血流量及血管密度比較
2.2 兩組大鼠治療前后VEGF,Fit-1,Ang-1,Ang-2,Tie-2mRNA相對表達量比較
治療前兩組大鼠VEGF,Fit-1,Ang-1,Ang-2,Tie-2的mRNA相對表達量比較,差異無統計學意義(P>0.05);治療當天、治療后1周觀察組大鼠VEGF,Fit-1,Ang-1,Ang-2的mRNA相對表達量均明顯高于對照組(P<0.05)。治療后2 周觀察組大鼠VEGF,Ang-1的mRNA與對照組比較,差異無統計學意義(P>0.05);觀察組Ang-2低于對照組,Fit-1高于對照組(P<0.05)。治療后1 周及2 周,對照組Tie-2相對表達量顯著高于觀察組(P<0.05)(見表2)。
3 討 論
目前研究證實[4],創面血管形成是創面愈合的關鍵所在,創面新生肉芽組織是創面的重要組成部分,豐富的血管能夠為新生肉芽組織提供大量營養,進而促進創面愈合。創面血管形成過程受阻會導致創面不愈合或延遲愈合,同時也是糖尿病足患者創面難愈合的關鍵原因之一[5]。目前關于改善糖尿病足潰瘍創面血管形成的相關研究是內分泌科醫務工作者關注的熱點。糖尿病足潰瘍創面的治療關鍵是將慢性創面轉換為急性創面,將感染創面轉化為潔凈創面。在此過程中血流量、血管密度及相關細胞因子均會出現顯著變化。本研究中構建糖尿病創面大鼠模型,采用微動力負壓護創與常規換藥對大鼠進行干預,同時檢測了創面愈合過程中血流量的改變、血管密度及相關細胞因子水平。創面血流情況及血管密度能夠間接反映新生血管功能狀況。本研究結果顯示,觀察組大鼠治療當天、治療后1 周、治療后2 周創面血流量顯著高于對照組,治療后1 周、治療后2 周血管密度顯著高于對照組,兩組治療期間各時間段血糖水平比較,差異無統計學意義,提示采用微動力負壓護創技術能夠明顯改善創面血流供應,進而促進創面愈合,且對大鼠血糖無明顯影響。研究顯示[6-7],VEGF及血管生成素是血管生成的關鍵性調節因子,前者能夠與血管內皮細胞特異性受體Fit-1結合,加速創面血管的形成,后者又分為Ang-1與Ang-2。研究顯示[8],Ang-1能夠與Tie-2結合,促進新生血管形成并增強其穩定性,在創面愈合過程中具有重要作用。Ang-2作為Ang-1的自身拮抗劑,通過與Tie-2結合達到拮抗Ang-1功能的作用,防止新生血管數量過多,同時可降低血管成熟的穩定性[9-10]。本研究結果顯示,治療當天、治療后1周觀察組大鼠VEGF,Fit-1,Ang-1,Ang-2的mRNA相對表達量均明顯高于對照組,治療后2 周觀察組大鼠VEGF,Ang-1的mRNA與對照組比較,差異無統計學意義;治療后1 周及治療后2 周,對照組Tie-2 mRNA相對表達量顯著高于觀察組;治療后2 周對照組Ang-2mRNA顯著高于觀察組。說明采用微動力負壓護創技術能夠增加糖尿病足潰瘍創面VEGF,Ang-1,Fit-1的表達水平,促進創面新生血管的形成,同時抑制Ang-1及其受體Tie-2的表達。

表2 兩組大鼠治療前后VEGF,Fit-1,Ang-1,Ang-2,Tie-2的mRNA相對表達量比較
綜上所述,微動力負壓護創技術能通過改變糖尿病潰瘍大鼠創面細胞因子水平,促進創面新生血管形成,進而促進創面愈合。

