基于數字化實驗與傳統實驗相結合的化學概念教學
郝升華

摘要:以人教版高中化學“離子反應及其發生條件”教學為例,闡述了基于數字化實驗與傳統實驗相結合的課例研究思路和教學活動設計。圍繞離子反應概念、離子反應發生條件等知識內容,宏微結合,幫助學生形成對“離子反應”概念的整體認識。
關鍵詞:數字化實驗? 宏微結合? 離子反應
新課改的基本理念要求重視開展“素養為本”的教學,提倡在課堂上開展以學生實驗為主的多種探究學習活動,促進學生學習方式的轉變,能從宏微結合的視角分析解決實際問題。傳統的化學實驗能讓學生獲得充分體驗及不可替代的技能訓練。數字化實驗實現了實驗數據的即時處理和直觀表現,并可獲得準確的定量數據,從而幫助人們更深入地研究化學現象和反應的本質規律。二者相結合運用在課堂上可以充分開發學生的高階思維,幫助學生掌握反應的本質。
一、學生學情分析
在傳統的課堂教學中,高中生在離子反應這一章節中很難形成“離子觀”,不能真正理解物質在溶液中以離子的形式存在這一知識,導致學習后續很多知識時只能靠死記硬背。本節課將書本上的實驗編排稍作改動,利用傳統實驗與數字化實驗相結合的實驗探究法教學,強調溶液中離子的行為,重點探究離子反應發生的本質。
二、實驗準備
試劑:0.01 mol·L-1 Na2SO4(aq),0.1 mol·L-1 BaCl2(aq),0.1 mol·L-1 KCl(aq),稀NaOH(aq),0.2 mol·L-1 ?HCl(aq),0.05 mol·L-1 ?CuSO4(aq),鋁片, 鋅粒
實驗儀器:電導率傳感器、數據采集器、電腦、磁力攪拌器、鐵架臺、50 mL燒杯等。
三、教學過程
(一)環節一 情景導入:“結石中的化學”
結石的形成屬于生物異常礦化,飲食和環境等都可能導致各種結石病。從事高溫作業、飲水少,出汗多者體內容易形成結石,食用菠菜較多,或長期飲用鈣含量較高的水可能導致結石病,比如H2C2O4與鈣結合形成CaC2O4沉淀在泌尿系統中累積就會形成尿路結石,實質就是草酸根離子與鈣離子發生了離子反應生成沉淀。
【設疑一】什么是離子反應呢?我們中學階段只研究水溶液中的離子反應,下面請同學們完成幾組實驗,并思考哪些實驗發生了化學反應。
(二)環節二 探究離子反應發生的本質
【學生實驗】
實驗1:向10 mL 0.01 mol·L-1 ?Na2SO4(aq)中滴加0.1 mol·L-1 ?BaCl2(aq)。
實驗2:向10 mL 0.01 mol·L-1 ?Na2SO4(aq)中滴加0.1 mol·L-1 KCl(aq)。
實驗3:向15 mL 0.2 mol·L-1 HCl(aq)中滴加稀NaOH(aq)。
實驗4:向15 mL 0.2 mol·L-1 HCl(aq)中加入少量鋁片。
實驗5:向20 mL 0.05 mol·L-1 CuSO4(aq)中加入少量鋅粒。
【學生】實驗2和實驗3中無明顯現象,但實驗3可以通過滴加酸堿指示劑確定發生了化學變化。實驗1中生成白色沉淀,實驗4中生成氣體,實驗5中藍色溶液顏色變淺,實驗1、4和5發生了化學變化。
【教師】實驗1、3和4確實都發生了離子反應,實驗2中沒有發生離子反應,只是離子的簡單混合。
【設疑二】那發生離子反應的條件是什么呢?
【教師演示實驗一】電導率隨溶液體積變化數字化實驗:向10 mL 0.01 mol·L-1 Na2SO4溶液中逐滴加入0.1 mol·L-1 BaCl2溶液。學生觀看教師操作及大屏幕顯示的數據變化如圖1所示。
【教師】起始反應液中離子種類有哪些?
【學生】Na+,SO42-,Ba2+,Cl-
【教師】隨著白色沉淀生成,同學們看到了電導率一直下降直至最低點卻沒有到零,原因是什么?隨后電導率為什么又升高?
【學生1】離子濃度減小,導電能力減弱,導電率降低
【教師】離子濃度為什么減小?
【學生2】SO2-4和Ba2+生成白色沉淀,離子濃度減小,但溶液中仍然存在鈉離子和氯離子,所以并沒有降到零。
【學生3】當Na2SO4被反應完全時再加入BaCl2時,氯化鋇過量,溶液中離子濃度開始增大,所以電導率增大。
【教師】硫酸鈉溶液和氯化鋇溶液充分混合后SO2-4和Ba2+結合發生了離子之間的反應,生成了白色沉淀BaSO4,離子種類和數目減小。
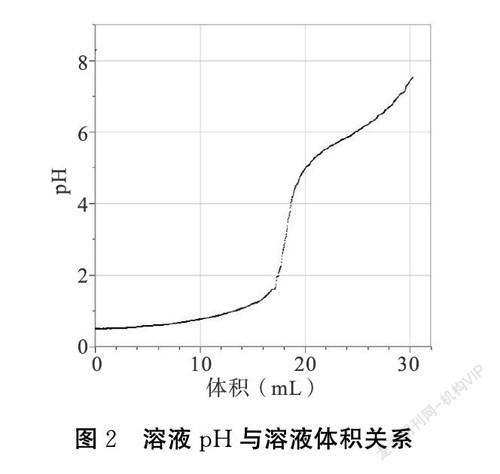
【教師演示實驗二】向15 mL 0.2 mol·L-1 HCl溶液中滴加稀NaOH溶液,播放視頻,演示溶液中pH隨溶液體積變化數字化實驗,同學們觀看教師操作,大屏幕顯示的數據變化如圖2所示。
學生們分析出pH發生變化的原因是隨著NaOH溶液加入中和了H+,H+濃度減小,OH-濃度增大,pH增大。溶液中離子數目減少。
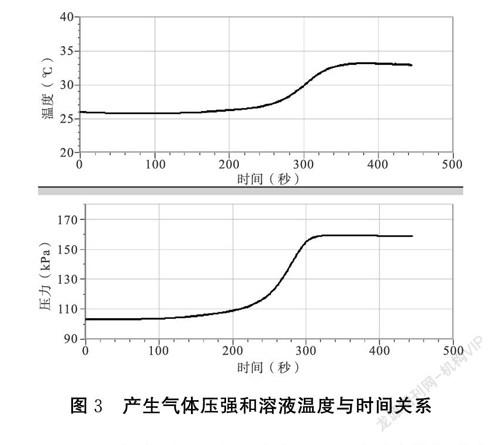
【教師演示實驗三】向10 mL 0.2 mol·L-1 HCl溶液中加入少量鋁片,播放視頻,演示溶液中溫度和壓強隨時間變化數字化實驗數據如圖3所示,同學們觀看教師操作及顯示的數據變化。
通過觀察實驗三及已有知識經驗,同學們分析出產生了氫氣,通過數字化實驗學生清楚看出該反應溫度升高,產生氣體氣壓增大,分析反應前后離子種類,發現反應前后離子種類和數目發生變化,原來溶液中H+數目減少生成了Al3+,發生了離子反應。
【教師演示實驗四】向20 mL 0.05 mol·L-1 CuSO4溶液中加鋅粒,實驗數據顯示電導率隨時間推移基本無變化。
通過電導率實驗四可知離子濃度基本沒有發生變化,但根據宏觀現象同學們知道CuSO4溶液中加鋅粒確實發生了化學變化,離子種類發生了變化,溶液中Cu2+變成了Zn2+,同樣也發生了離子反應。
【教師】最后給同學們展示向Na2SO4溶液中加稀的KCl溶液電導率實驗數據,無宏觀現象,電導率一直增大,說明溶液中離子濃度逐漸增大,溶液混合僅是Na+,SO2-4,Cl-,K+的簡單混合,沒有生成沉淀、氣體和水,沒有發生離子種類和數目的變化,沒有發生離子反應。
通過以上實驗,學生發現離子反應發生時宏觀上通常能看到有沉淀、氣體、水生成,離子的種類或數目發生了變化。
(三)運用符號表征,深化離子反應及其發生條件在學生腦海中的印象
傳統實驗和數字化實驗相結合,層層遞進地引導學生發現離子反應發生時通常伴有沉淀、氣體和水生成,并總結出發生離子反應的本質原因是溶液中離子種類和數目發生了變化,并以硫酸鈉和氯化鋇反應為例講解如何正確使用化學符號來表示離子反應的過程;并做課本相應的練習鞏固,提問學生CuSO4和NaOH反應、NaCO3和HCl反應本質原因是什么并寫出離子方程式。
四、回顧反思
本節課例對接宏觀辨識與微觀探析化學學科素養,將數字化實驗和傳統實驗相結合,開發學生的高階思維,將離子反應發生的常見宏觀現象和本質原因深化入學生的腦海中。離子反應的本質不是所有的離子都參與反應,而是某些離子的濃度和種類發生了變化。目前的學習中,在宏觀上我們可以通過判斷是否有沉淀、氣體和水生成來判斷是否發生了離子反應。為今后學生理解離子共存等問題打下基礎。
參考文獻:
[1]中華人民共和國教育部.普通高中化學課程標準2017年版[M].北京:人民教育出版社,2017:3.
[2]張瑋,張軍.學生“離子觀”淡薄成因分析以及解決策略[J].化學教與學,2019(10):3942.
[3]季剛.合理運用對比實驗幫助學生理解“離子反應”[J].現代交際,2013(6):159160.

