人臍帶來源的間充質(zhì)干細胞運載3型呼腸孤病毒在殺傷K562細胞過程中相關(guān)細胞因子表達分析*
宋曉梅,劉雨思,趙書利,李 晨,趙硯馳,李 化,舒莉萍△
1.貴州醫(yī)科大學(xué)細胞工程生物醫(yī)藥技術(shù)國家地方聯(lián)合工程實驗室/貴州省再生醫(yī)學(xué)重點實驗室/貴州醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院免疫學(xué)教研室,貴州貴陽 550004;2.貴州省貴陽市婦幼保健院檢驗科,貴州貴陽 550004;3.延安大學(xué)基礎(chǔ)醫(yī)學(xué)院,陜西延安 716000;4.長江航運總醫(yī)院腫瘤科,湖北武漢 430014;5.中國醫(yī)學(xué)科學(xué)院成體干細胞轉(zhuǎn)化研究重點實驗室,貴州貴陽 550004
慢性粒細胞白血病(CML)是一種起源于多能造血干細胞的異常增生性腫瘤,雖然病程發(fā)展較慢,但發(fā)病率較高,約占新發(fā)白血病病例的10%[1]。CML的傳統(tǒng)療法治療后不良反應(yīng)多、易復(fù)發(fā),分子靶向藥物酪氨酸激酶抑制劑的出現(xiàn)雖然使CML的治療效果與以往比較取得了重要進展[2],但是酪氨酸激酶抑制劑不能清除靜止期的白血病干細胞,因此,停藥后復(fù)發(fā)是目前酪氨酸激酶抑制劑治療CML難以克服的一個瓶頸[3],這些困難仍困擾著眾多臨床醫(yī)生及患者。異基因造血干細胞移植雖有望治愈CML,但是由于配型相合的干細胞來源有限、并發(fā)癥多及費用高昂使這種治療方案難以普及,為此有必要探索治療CML的新方法,比如免疫療法。K562細胞是來源于CML急性病變患者的異常細胞,具有Ph染色體, K562細胞可以作為構(gòu)建CML的細胞模型。溶瘤病毒是指能夠感染腫瘤細胞并致其死亡而對正常組織沒有影響的非致病性病毒顆粒,它可以通過在宿主細胞內(nèi)進行自我復(fù)制來增加病毒載量殺死腫瘤細胞,實現(xiàn)腫瘤靶向治療的目標,是惡性腫瘤治療領(lǐng)域中的新治療方式[4-5]。呼腸孤病毒(Reovirus)作為一種天然存在的溶瘤病毒,不僅可以通過選擇性殺死腫瘤細胞直接發(fā)揮溶瘤作用,還能誘導(dǎo)機體的免疫活性介導(dǎo)優(yōu)異的抗腫瘤作用[6]。利用天然的腫瘤歸巢細胞(如干細胞)作為細胞載體將Reovirus遞送到腫瘤,能幫助病毒逃避機體的免疫清除,使溶瘤病毒能夠到達腫瘤細胞并進行復(fù)制來殺傷腫瘤細胞成為可能[7]。人臍帶來源的間充質(zhì)干細胞(MSCs)有較強的自我更新能力及多向分化潛能,來源較為廣泛且不損傷供者的身體,易于轉(zhuǎn)染外源基因,因此,已被眾多研究證實是細胞替代治療的理想來源。“歸巢”最早是指淋巴細胞在體內(nèi)依靠歸巢受體傾向于由定居地經(jīng)淋巴循環(huán)及血液循環(huán)不斷往返于外周免疫器官、外周淋巴組織及全身器官組織,最終再回到外周免疫器官及外周淋巴組織的過程,后來這一概念逐漸引申至循環(huán)系統(tǒng)中特定的細胞類群,如干細胞、免疫細胞在多種因素的作用下能定向趨向性遷移至機體組織或器官微環(huán)境,維持或重塑其細胞命運的生命過程,類似于人體局部炎性反應(yīng)后大量白細胞遷移至炎性反應(yīng)周圍。2002年,SAITO等[8]證明了MSCs的歸巢能力,有研究表明,利用MSCs的腫瘤歸巢能力可將抗癌基因產(chǎn)物直接遞送至腫瘤病灶[9]。單獨的溶瘤病毒Reovirus3進入機體有可能被體內(nèi)針對Reovirus3產(chǎn)生的抗體中和,所以本研究選用具有腫瘤歸巢能力的MSCs作為運載Reovirus3的載體可使之躲過體內(nèi)抗體的攻擊,使Reovirus3能夠到達腫瘤病灶并進行復(fù)制來殺傷腫瘤細胞。本研究探討細胞培養(yǎng)體系中相關(guān)細胞因子對MSCs運載Reovirus3殺傷K562細胞的影響,為利用細胞因子治療或者輔助MSCs運載Reovirus3治療CML提供一定依據(jù)。
1 材料與方法
1.1材料與儀器 K562細胞株(美國ATCC公司);Reovirus3病毒株(貴州醫(yī)科大學(xué)組織工程與干細胞中心);DMEM培養(yǎng)基、RPMI1640培養(yǎng)基(Gibco公司);胎牛血清(FBS , BI公司);磷酸鹽緩沖液(PBS,Solarbio公司);ELISA細胞因子檢測試劑盒(安徽巧伊生物科技有限公司);CO2培養(yǎng)箱(Thermo公司)。
1.2方法與步驟
1.2.1細胞的分離與培養(yǎng) 參照劉雨思[10]及《細胞培養(yǎng)技術(shù)》,通過體外實驗從臍帶中分離培養(yǎng)MSCs,取第3代處于對數(shù)生長期的MSCs進行實驗。K562細胞在含有10%FBS的RPMI1640培養(yǎng)基,于37 ℃,5%CO2條件下進行傳代培養(yǎng),取對數(shù)生長期的K562細胞進行實驗。
1.2.2分組 對照組:K562細胞;MSCs組:K562細胞+MSCs; Reovirus3組(陽性對照組):K562細胞+Reovirus3;實驗組:K562細胞+Reovirus3+MSCs。
1.2.3檢測方法 分別收集共培養(yǎng)24、48、72 h各組細胞培養(yǎng)上清液,1 000 r/min離心5 min,采用ELISA雙抗體夾心法,按照試劑說明書檢測腫瘤壞死因子-α(TNF-α)、干擾素-γ(IFN-γ)、轉(zhuǎn)化生長因子-β(TGF-β)、白細胞介素(IL)-2、IL-4、IL-5、IL-6和IL-17水平。培養(yǎng)24、48、72 h后培養(yǎng)體系中的K562細胞由本課題組劉雨思[10]進行K562細胞增殖抑制能力檢測。
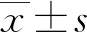
2 結(jié) 果
2.1培養(yǎng)24 h時4組細胞培養(yǎng)上清液細胞因子水平比較 培養(yǎng)24 h時4組細胞培養(yǎng)上清液均未檢測出TNF-α、IFN-γ、IL-2、IL-4、IL-5及IL-17。見表1。

表1 培養(yǎng)24 h時4組細胞培養(yǎng)上清液細胞因子水平比較
2.2培養(yǎng)48 h時4組細胞培養(yǎng)上清液細胞因子水平比較 培養(yǎng)48 h 時MSCs組、Reovirus3組和實驗組TNF-α、IFN-γ、IL-2、IL-4水平雖然均高于對照組,但差異均無統(tǒng)計學(xué)意義(P>0.05)。培養(yǎng)48 h時4組細胞培養(yǎng)上清液均未檢測出IL-5和IL-17。見表2。

表2 培養(yǎng)48 h時4組細胞培養(yǎng)上清液細胞因子水平比較
2.3培養(yǎng)72 h時4組細胞培養(yǎng)上清液細胞因子水平比較 培養(yǎng)72 h時 MSCs組和實驗組TGF-β、IL-6水平均高于對照組,差異均有統(tǒng)計學(xué)意義(P<0.05),Reovirus3組比對照組TGF-β、IL-6水平雖有所升高,但差異無統(tǒng)計學(xué)意義(P>0.05)。培養(yǎng)72 h時4組細胞培養(yǎng)上清液均未檢測出TNF-α、IFN-γ、IL-2、IL-4、IL-5及IL-17。見表3。

表3 72 h時4組細胞培養(yǎng)上清液細胞因子水平比較
3 討 論
細胞因子是由免疫細胞和某些非免疫細胞經(jīng)刺激而合成并分泌的具有多種生物學(xué)活性的小分子蛋白質(zhì),在免疫應(yīng)答與調(diào)節(jié)、細胞分化和發(fā)育、炎性反應(yīng)、組織修復(fù)及造血中發(fā)揮重要作用。MSCs可分泌多種細胞因子,包括IL-6、IL-7、IL-8、白血病抑制因子、IFN-γ及TNF-α,MSCs具有抗腫瘤免疫調(diào)節(jié)功能,它的免疫調(diào)節(jié)功能是通過細胞分泌的可溶性細胞因子,還有細胞與細胞之間受體與配體的相互作用或者兩種機制的組合來實現(xiàn)。因此,可以通過檢測相應(yīng)的細胞因子來評價抑瘤體系對白血病細胞溶瘤作用的效果和可行程度。有研究顯示,MSCs分泌的細胞因子可促進細胞凋亡,改變K562細胞的細胞周期分布,這些細胞因子可通過BAX和Caspace-3級聯(lián)途徑抑制K562細胞增殖[11]。此外,MSCs分泌的細胞因子IFN可以激活雙鏈RNA依賴性蛋白激酶(PKR)途徑,Reovirus3感染K562細胞后,轉(zhuǎn)錄過程中的小基因片段編碼的σ3蛋白也可以引起PKR的活化,經(jīng)IFN及σ3蛋白激活的PKR可引起細胞凋亡來抑制K562細胞的增殖[12]。
本課題組劉雨思[10]采用流式細胞儀檢測了MSCs與K562細胞表面Reovirus3易感受體重組人連接黏附分子-A(JAM-A)的表達量分別為11%和99%,JAM-A在K562細胞表面高表達。K562細胞增殖抑制能力檢測結(jié)果顯示,對照組和Reovirus3組(陽性對照組)K562細胞隨著時間延長細胞存活率始終最高和最低, MSCs組在24 h時發(fā)現(xiàn)MSCs有一定促進腫瘤生長的作用,但隨著共培養(yǎng)時間的延長這種促瘤作用轉(zhuǎn)為抑瘤作用。實驗組與MSCs組相似,在24 h時發(fā)現(xiàn)MSCs有一定促進腫瘤生長的作用,隨著共培養(yǎng)時間延長至72 h時,實驗組K562細胞存活率與Reovirus3組(陽性對照組)接近。在Reovirus3存在的Reovirus3組和實驗組K562細胞存活率明顯低于對照組,可能是因為Reovirus3感染K562細胞后激活了PKR途徑,引起細胞凋亡。而MSCs組和實驗組在24 h時發(fā)現(xiàn)MSCs有一定促進腫瘤生長的作用,但隨著共培養(yǎng)時間的延長這種促瘤作用轉(zhuǎn)為抑瘤作用,可能是因為隨著共培養(yǎng)時間的延長,培養(yǎng)體系中產(chǎn)生的細胞因子對抗腫瘤的作用得以發(fā)揮,由促瘤作用轉(zhuǎn)為抑瘤作用。通過檢測細胞培養(yǎng)上清液細胞因子,48 h時在MSCs存在的情況下,細胞培養(yǎng)上清液TNF-α、IFN-γ水平比并沒有MSCs存在的Reovirus3組和對照組高,培養(yǎng)體系中的IFN-γ可能激活了PKR途徑引起細胞凋亡,TNF-α可能是通過啟動Caspase信號通路使腫瘤細胞發(fā)生凋亡。4組IL-2、IL-4水平較為接近,差異無統(tǒng)計學(xué)意義(P>0.05),可能是因為培養(yǎng)體系中IL-2、IL-4主要由K562細胞自分泌產(chǎn)生參與免疫應(yīng)答。24、72 h時細胞培養(yǎng)上清液均未檢測出TNF-α、IFN-γ、IL-2及IL-4,可能是因為這2個時間點的這4種細胞因子水平較低,采用ELISA雙抗體夾心法沒有檢測出來。IL-4能以自分泌的方式促進Th2細胞分化,參與變態(tài)反應(yīng),在腫瘤免疫中起抑制腫瘤免疫應(yīng)答的作用。IL-2可由CD4+和CD8+T細胞產(chǎn)生,另外轉(zhuǎn)化的B細胞、白血病細胞亦可產(chǎn)生,是對免疫系統(tǒng)具有重要作用的細胞因子之一,可以使細胞毒性T細胞、自然殺傷細胞(NK細胞)增殖,并使它們的殺傷活性增強,還可促進淋巴細胞分泌抗體和IFN,具有抗病毒、抗腫瘤和增強機體免疫功能等作用,已經(jīng)被批準用于治療轉(zhuǎn)移性腎細胞癌和轉(zhuǎn)移性黑色素瘤,改進的IL-2制劑可單獨使用,與其他的抗癌免疫療法結(jié)合有望治療轉(zhuǎn)移性癌癥[13]。培養(yǎng)24、48、72 h時MSCs組和實驗組TGF-β、IL-6水平均高于對照組,差異均有統(tǒng)計學(xué)意義(P<0.05),而Reovirus3組TGF-β、IL-6水平雖有所升高,但差異無統(tǒng)計學(xué)意義(P>0.05)。4組TGF-β水平隨著時間的推移不斷降低,可能是因為TGF-β對腫瘤具有雙重作用,隨著時間的推移被逐漸消耗及不斷降解而減少,還可能與K562細胞死亡率逐漸增加及培養(yǎng)體系中的營養(yǎng)逐漸消耗有關(guān)。48 h時IL-6水平最高,之后降低可能與IL-6隨著時間的推移不斷降解,以及培養(yǎng)體系中營養(yǎng)逐漸消耗及K562細胞死亡率逐漸增加有關(guān)。有研究表明,腫瘤(如卵巢癌、乳腺癌等惡性腫瘤)處于旺盛時期均出現(xiàn)了IL-6的高表達[14-15],作為促炎因子的IL-6可通過自分泌和旁分泌方式促進腫瘤發(fā)生,在腫瘤血管生成、腫瘤微環(huán)境的免疫調(diào)節(jié)及疾病進展中起重要作用。此外,在腫瘤微環(huán)境中,TGF-β、IL-6和IL-10可以直接抑制NK細胞活性,還可以通過影響免疫抑制細胞和拮抗刺激細胞因子的作用間接抑制NK細胞活性,從而抑制NK細胞的抗腫瘤反應(yīng),使腫瘤細胞有機會逃避免疫系統(tǒng)的攻擊[16]。培養(yǎng)48 h時細胞培養(yǎng)上清液未檢測出IL-5、IL-17,可能是因為IL-5主要由Th2細胞和活化的肥大細胞產(chǎn)生,IL-17主要由Th17細胞產(chǎn)生,因此,細胞培養(yǎng)體系中未檢測到IL-5、IL-17存在,也有可能是這兩種細胞因子水平過低,采用ELISA雙抗體夾心法沒有檢測出來。本研究采用ELISA雙抗體夾心法檢測細胞因子,檢測的是可溶性細胞因子的免疫反應(yīng)性即細胞因子的蛋白水平,因此,檢測結(jié)果與細胞因子的生物活性不一定呈正比。并且測定結(jié)果與所用的抗體來源及親和力有關(guān),樣本中存在的各種細胞因子結(jié)合蛋白也可能對細胞因子免疫測定產(chǎn)生干擾。
MSCs運載Reovirus3在體外實驗的細胞培養(yǎng)體系中可以有效抑制K562細胞增殖,除了溶瘤病毒Reovirus3的溶瘤作用外,可能還與培養(yǎng)體系中細胞因子促進細胞凋亡從而抑制K562細胞的增殖有關(guān)。本課題組荷瘤小鼠體內(nèi)細胞因子的檢測結(jié)果提示細胞因子在體內(nèi)對抑制K562細胞的增殖有一定作用[17]。細胞因子對腫瘤的作用十分復(fù)雜,隨著人們對各種細胞因子的來源、生物學(xué)功能、分子結(jié)構(gòu)、相應(yīng)受體和受體介導(dǎo)的信號轉(zhuǎn)導(dǎo)等多方面研究取得的進展,采用細胞因子治療或者輔助治療CML受到臨床關(guān)注。

