RNA氧化及其在2型糖尿病中的研究進展
王晚霞 王安奇
活性氧簇(reactive oxygen species, ROS)修飾生物分子是疾病發生的重要機制,RNA氧化是其中重要一環。RNA氧化見于多種疾病發病早期,是神經變性疾病的重要致病機制,在預測衰老相關疾病風險、評估疾病療效方面具有良好的應用前景[1~4]。氧化應激增強誘發胰島素抵抗和β細胞功能障礙,是2型糖尿病發生、發展的主要因素,具體機制尚未完全闡明。近年來,大量人群研究發現,2型糖尿病患者尿8-氧化鳥嘌呤(8-oxoguanine,8-oxoG)升高,RNA氧化是影響2型糖尿病死亡的危險因素,也可能誘發胰島素抵抗和2型糖尿病,提示RNA氧化可能是影響2型糖尿病發生、發展的重要機制[2, 5]。
一、RNA氧化的形成
RNA中的堿基易受ROS、紫外線和烷基化劑誘導的化學修飾。RNA氧化由細胞內ROS修飾核糖核酸堿基形成。線粒體功能障礙及抗氧化機制失活導致細胞內ROS增加,是RNA氧化累積產生病理效應的主要原因。RNA氧化可經ROS修飾RNA鏈上堿基直接氧化形成,也可由RNA聚合酶摻入細胞質中氧化的核糖核苷酸形成。目前研究發現, RNA中氧化堿基有20多種,包括8-氧化鳥嘌呤(8-oxoguanine, 8-oxoG)、8-氧化腺嘌呤(8-oxo-7,8-dihydroadenosine, 8-oxoA)、5-羥基尿嘧啶(5-hydroxyuridine,5-OHU)和5-羥基胞嘧啶(5-hydroxycytidine,5-OHC)等(圖1A),其中8-oxoG在哺乳動物細胞中含量最高,是RNA氧化代表性堿基。RNA氧化對內、外源性刺激敏感。生理條件RNA中8-oxoG的頻率約每105G出現一次,氧化應激輕度增強(如炎癥)可致8-oxoG出現的頻率增加10倍。除了內源性因素,凡造成氧化應激增強的多種外源因素如電離輻射、紫外線輻射和環境中苯、吸煙、二氧化鈦、焊工吸入空氣中重金屬如鉻、短期高濃度空氣污染等均會促使RNA氧化增強。
細胞內不同類型的RNA均會受氧化修飾的影響。早期研究發現,mRNA最易受氧化應激的影響。mRNA中8-oxoG的含量是以rRNA為主的總RNA的5倍,而Fenton反應在rRNA形成的8-oxoG是tRNA的13倍。研究發現,8-oxoG 在miRNA中累積(處理后增加3.2倍)高于其他RNA(>200nt)(處理后增加1.8倍),證實miRNA更易受氧化修飾的影響[1]。
RNA氧化導致其功能缺失或改變。RNA中被氧化修飾的堿基配對能力會發生顯著改變。例如8-oxoG以同樣的速率與腺嘌呤和胞嘧啶配對,誘發鳥嘌呤-胸腺嘧啶(G> T)突變(圖1B)。除了形成氧化堿基,RNA氧化也造成脫嘌呤及脫堿基位點、RNA交聯、斷裂[6~8]。mRNA氧化影響mRNA代謝的多個環節,包括mRNA穩定性和翻譯。mRNA氧化抑制肽鍵形成,導致錯誤轉碼、核糖體漂移或mRNA降解,rRNA氧化可導致核糖體裝配缺陷或與核糖體蛋白發生交聯,tRNA損傷可能導致氨基酰化缺陷,影響細胞內蛋白質合成。MicroRNA氧化可改變其調節靶標,影響基因表達[1,9]。
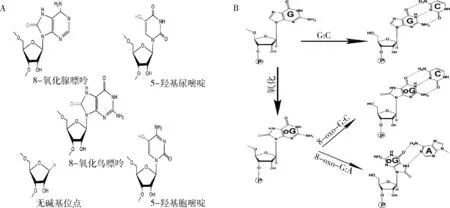
圖1 RNA氧化修飾堿基,改變其配對能力A. RNA氧化產物的結構:8-氧化腺嘌呤(8-oxoA),8-氧化鳥嘌呤(8-oxoG),5-羥基尿嘧啶(5-OHU),5-羥基胞嘧啶(5-OHC)和無堿基位點(aba);B. RNA氧化影響堿基配對:氧化后鳥苷仍可與胞嘧啶配對,但更可能采用順式構象并與腺苷配對
二、細胞對氧化RNA的調控
機體氧化RNA調控機制尚未完全闡明,尚未發現RNA氧化特異性修復機制的報道。清除細胞核酸池中氧化核糖核苷酸、防止摻入、特異性降解和誘導細胞死亡是細胞控制氧化RNA的主要途徑[10]。細胞內存在特定清理氧化核苷酸、防止氧化核苷酸在轉錄過程中摻入RNA的酶。mutT同源蛋白(mutT homolog 1,MTH1)可將8-oxoGTP水解為8-oxoGMP,而NUDT5(nudix type 5, NUDT5)可將8-oxoGTP水解為8-oxoGDP。RNA合成過程中,鳥苷酸激酶(guanylate kinase,GK)無法將8-oxoGMP轉換為GDP,核糖核苷酸還原酶(ribonucleotide reductase, RNR)無法識別8-oxoGDP,RNA聚合酶(RNA polymerase)摻入8-oxoGTP的速率遠低于GTP,這有效阻止RNA合成時8-oxoGTP摻入形成氧化RNA。特異性降解和誘導細胞死亡是細胞清除氧化RNA主要方法。含8-oxoG的RNA被RNA結合蛋白識別后特異性降解。
參與特異性識別氧化RNA的蛋白有Y盒結合蛋白1(y-box binding protein 1,YB-1)、AU結合因子1(au-binding factor 1,AUF1)和聚(C)結合蛋白1[poly(C)-binding protein1,PCBP1]。YB-1與含有8-oxoG的RNA帽結構特異性結合,穩定mRNA防止脫帽,啟動mRNA的降解。AUF1可識別含有8-oxoG的RNA,與氧化RNA結合能力最強。AUF1特異性結合氧化RNA,將其募集到外泌體中由核酸酶降解,維持正常基因表達。PCBP1蛋白可特異性結合含2個以上8-oxoG的RNA,激活caspase-3,使PARP-1裂解,通過誘導細胞凋亡清除氧化RNA[10]。
三、RNA氧化對細胞的影響及分子機制
1.RNA氧化導致蛋白質合成異常:RNA氧化影響轉錄和翻譯,導致短鏈多肽或變異蛋白質合成(圖2)。Dai等[11]研究發現,8-oxoGTP摻入mRNA改變基因表達,帶有8-oxoG-mRNA的CHO細胞除了分泌大量已知致病性Aβ外,還可分泌28種未知的Aβ衍生肽,明確RNA氧化增加可造成基因轉錄或翻譯錯誤,產生異常蛋白質。干擾RNA之間的相互作用是RNA氧化致蛋白合成異常的主要原因。mRNA中8-oxoG干擾核糖體對tRNA的選擇,肽鍵形成速率降低3~4個數量級。Thomas等[12]研究證實,mRNA中 8-oxoG在A位采用syn構象,該構象與腺苷的配對能力,不足以促進解碼中心tRNA選擇所必需的結構改變,蛋白翻譯停滯。Willi等[6]研究發現,rRNA氧化堿基聚集于已知功能區域。肽酰轉移酶中心8-oxoA2451抑制肽鍵形成,5-OHU2585干擾A位tRNA的聚集,均降低肽段合成。tRNA氧化誘導其CCA尾部失活,干擾密碼子-反密碼子配對,導致不完全氨基酰化或錯酰化tRNA累積,導致錯誤或截短蛋白質產生。
RNA氧化可調控基因表達影響蛋白質合成,miRNA氧化是調控基因表達的表觀轉錄機制。Wang等[9]首次發現,氧化修飾改變miR-184調節靶標,使其靶向Bcl-xL和Bcl-w的3·UTR結合位點,下調Bcl-xL和Bcl-w的mRNA及蛋白表達。研究發現,miR-1種子區域位置特異8-oxoG修飾,可通過8-oxoG·A堿基配對調控新的mRNA,誘導心肌肥厚,miRNA的位置特異性氧化是調控基因表達的表觀轉錄機制[1]。
2.RNA氧化促進細胞凋亡:RNA氧化見于神經元變性凋亡早期,可能是神經元凋亡的主要原因,具體機制尚未闡明。有研究發現RNA氧化可促進線粒體介導的細胞凋亡。RNA氧化形成脫嘌呤鳥苷、脫堿基位點或RNA交聯,可產生RNA-Cyt C交聯復合物,促進Cyt C從脂質體上的解離,Cyt C從線粒體釋放,直接誘發線粒體介導的細胞凋亡。Ishii等[13]研究發現,當RNA氧化嚴重時,PCBP1蛋白特異性結合含2個以上8-oxoG的RNA,激活caspase-3,使PARP-1裂解,啟動細胞凋亡[10, 13](圖2)。RNA氧化可經ROS修飾RNA鏈上堿基直接氧化形成,也可由RNA聚合酶摻入細胞質中氧化的核糖核苷酸形成。清除核酸池中氧化核糖核苷酸、防止摻入、特異性降解和誘導細胞死亡是細胞控制氧化RNA主要途徑。不同類型RNA氧化(包括mRNA、rRNA、tRNA 和microRNA)均會影響蛋白質合成,導致蛋白質合成異常或細胞凋亡,影響神經變性疾病和2型糖尿病及其并發癥的發生、發展。
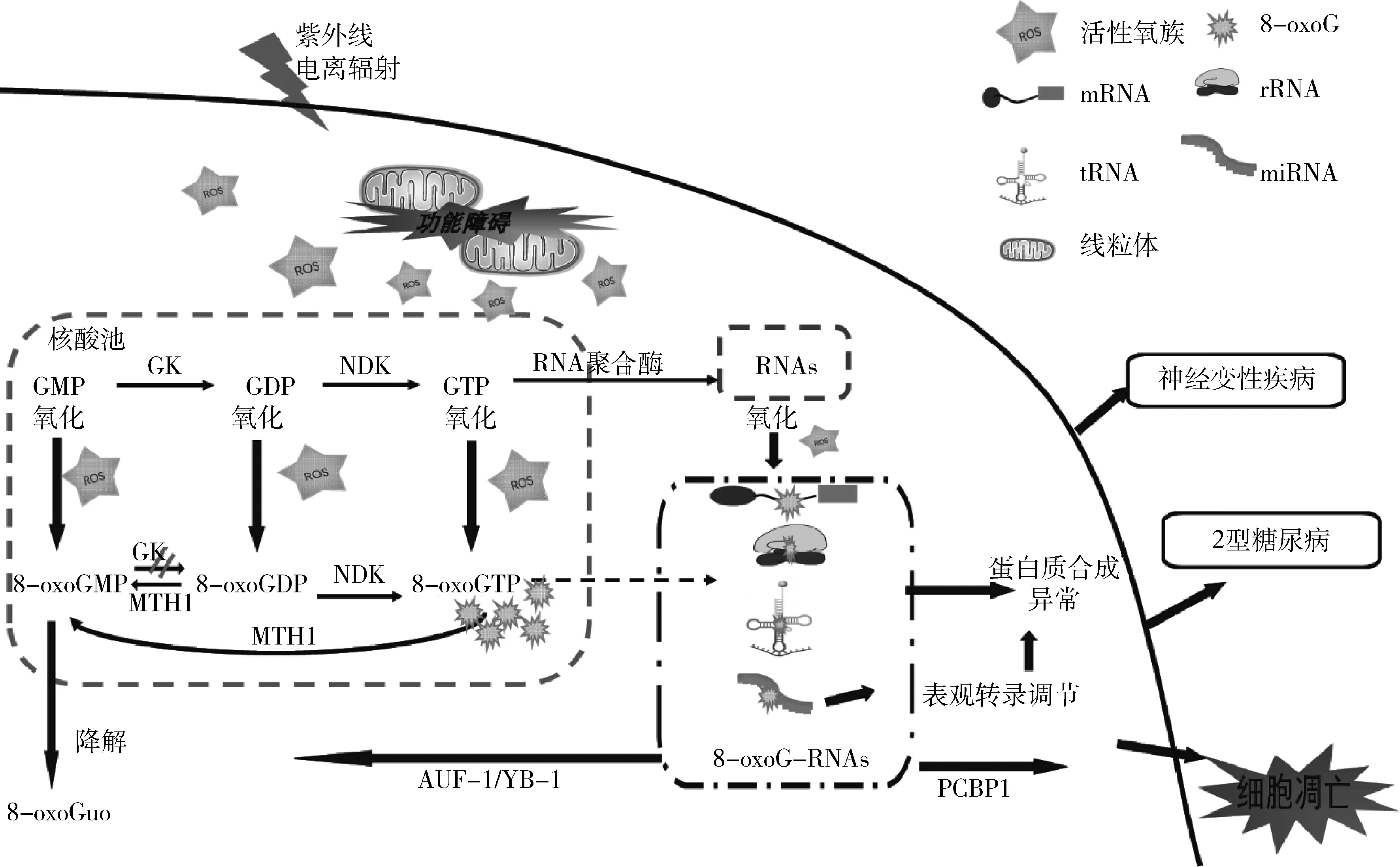
圖2 RNA氧化的形成及病理效應
四、RNA氧化與2型糖尿病
1.RNA氧化是影響2型糖尿病血管并發癥發展的重要因素:RNA氧化是2型糖尿病并發癥的危險因素。Broedbaek等[5]通過1381例未經治療的人群隊列隨訪發現,從確診到隨訪6年,尿8-oxoG升高死亡風險增加,尿8-oxoG是2型糖尿病死亡的獨立預測指標。2型糖尿病鼠模型血漿和尿液中8-oxoG水平明顯升高,腎臟、心臟、腦等臟器RNA氧化升高,并隨著高血糖狀態而持續增高,提示RNA氧化與糖尿病并發癥密切相關[14, 15]。RNA氧化與糖尿病微血管并發癥的研究主要集中于糖尿病腎病。Mao等[16]研究發現,RNA氧化可見于糖尿病性腎病早期疾病。Kjaer等[17]研究發現,糖尿病腎病患者強化治療后8-oxoG低的患者死亡風險最低,尿8-oxoG可用于監測療效及預測糖尿病晚期并發癥的后續風險。RNA氧化水平升高與2型糖尿病心血管死亡風險密切相關。Liu等[18]研究發現,血糖和血脂未出現差異時,2型糖尿病心血管并發癥患者尿8-oxoG水平顯著高于無并發癥患者,8-oxoG水平升高可能是2型糖尿病心血管并發癥的危險因素。近年來研究發現,RNA氧化與2型糖尿病患者心血管事件所致死亡密切相關,尿8-oxoG是評估2型糖尿病氧化應激水平和預測大血管并發癥的良好標志物[19, 20]。
2.RNA氧化與2型糖尿病的發展密切相關:RNA氧化是誘發2型糖尿病危險因素。Cejvanovic等[21]通過對3567例丹麥人群橫斷面調查發現,成年男性肥胖者、2型糖尿病患者尿8-oxoG升高,RNA氧化增高與糖尿病發生率升高有關。Sch?ttker等[2]基于7828例個體14年隨訪的隊列研究發現,8-oxoG的水平與2型糖尿病的發生率存在關聯;高齡組(65~75歲)人群8-oxoG與2型糖尿病發生率的相關性最強,8-oxoG水平每增加1個標準差的HR為1.14(1.05~1.23),表明老年人細胞修復能力降低時RNA氧化增高更為明顯,是RNA氧化是促進2型糖尿病發生或發展的重要因素。Kloppenborg等[22]研究發現,葡萄糖耐量受損的肥胖兒童尿8-oxoG和葡萄糖耐量之間存在相關性。J?rs等[23]研究證實8-oxoG與胰島素抵抗顯著相關,與單純肥胖的患兒比較,肥胖伴胰島素抵抗的患兒尿液8-oxoG明顯升高,表明RNA氧化與2型糖尿病發病聯系密切。
五、展 望
RNA氧化影響2型糖尿病血管并發癥發展,其代謝標志物尿8-oxoG是預測糖尿病血管并發癥發生、發展的良好標志物,在2型糖尿病血管并發癥的預警及防治中有良好的應用前景。RNA與衰老關系密切,尿8-oxoG的水平呈現增齡性增長。因此,建立基于大規模人群研究的尿8-oxoG的參考值范圍和醫學決定水平,是將尿8-oxoG用于2型糖尿病血管并發癥臨床診斷的基礎。尿8-oxoG定量方法的標準方法是高效液相色譜-串聯質譜法(LC-MS/MS)法。由于LC-MS/MS對設備和技術人員要求,尿8-oxoG的監測及臨床應用受限。隨著質譜技術在臨床實驗室診斷中的推廣,尿8-oxoG必將成為2型糖尿病血管并發癥防控的可靠生物學標志物。
RNA可能是誘發2型糖尿病發生的危險因素之一。雖然目前RNA氧化對細胞功能及活性的影響及作用機制尚處于前期探索階段,RNA氧化已被視為誘發神經元凋亡的早期事件和主要原因。基于糖尿病模型鼠和空腹糖耐量受損患者尿8-oxoG的評估,筆者發現RNA氧化升高見于2型糖尿病早期。進一步用8-oxoGTP 干預INS-1細胞模型發現,RNA氧化增加可抑制INS-1細胞增殖(數據尚未發表),可見RNA氧化與2型糖尿病的發生關系密切。目前RNA氧化與胰島素抵抗的因果關系尚未證實,在2型糖尿病發生、發展中的作用機制研究匱乏。針對RNA氧化在2型糖尿病中作用的機制研究必將為其防治提供新策略。

