利伐沙班對血管平滑肌細胞增殖遷移的影響
陳 杰 楊曉霞 余 汁
動脈硬化閉塞癥(arteriosclerosis obliterans, ASO)是由動脈粥樣硬化引起的缺血性疾病,其組織特征包括動脈內膜增厚、鈣化和動脈管腔閉塞狹窄等[1, 2]。據報道,當前全世界約有2億例ASO患者,其中,75歲以上人群的發生率高達20%[3, 4]。目前,已有大量研究探討了ASO的潛在病理機制,涉及炎性反應、血管平滑肌細胞(vascular smooth muscle cells,VSMCs)的增殖遷移及血栓形成等,其中以VSMCs的異常增殖和遷移最為重要[5, 6]。作為血管壁的主要成分,VSMCs生物學功能的異常和表型轉換可促進動脈粥樣硬化、高血壓和術后血管狹窄等血管疾病的發生,從而影響患者的生存質量[7, 8]。
利伐沙班是一種直接FⅩa因子抑制劑,相對分子質量較小(436g/mol),可與血漿蛋白高度結合(結合率約為92%~95%),具有口服便捷、見效快和高安全性等優點,故被廣泛用于治療冠狀動脈疾病、術后靜脈血栓和腦卒中等[9, 10]。利伐沙班的作用機制是濃度依賴性地抑制與凝血相關的FⅩa、與凝血酶原結合的FⅩa和游離FⅩa,但其對由凝血酶、膠原蛋白和二磷酸腺苷引起的血小板聚集無直接影響[9]。據報道,利伐沙班不僅能抑制血栓形成,減輕動脈粥樣硬化斑塊的進展和失穩,還能增強人臍靜脈內皮細胞的活力和遷移,并保護這些細胞免受FⅩa因子的促炎作用[11, 12]。而關于利伐沙班對血管平滑肌細胞增殖和遷移的作用目前尚無研究闡明,本研究旨在探討利伐沙班對PDGF-BB誘導的血管平滑肌細胞增殖及遷移的影響。
材料與方法
1.材料:人主動脈血管平滑肌細胞株(HAVSMC)購自美國ATCC公司;利伐沙班(美國Sigma公司);Edu染色試劑盒(中國廣州銳博生物技術有限公司);FBS、PDGF-BB、抗N-cadherin、抗E-cadherin、抗GAPDH和兔抗IgG(中國上海碧云天生物技術有限公司);RIPA裂解液和MTT試劑盒(中國北京索萊寶科技有限公司);DMEM培養基(美國Gibco公司); ECL化學發光試劑盒(中國上海翊圣生物科技有限公司);PI/RNase染色液(美國Cell Signaling Technology公司)。
2.細胞培養:將HAVSMCs接種于含1%細胞生長因子、2%FBS、1%雙抗(青霉素和鏈霉素)的DMEM培養基中,并培養于37℃、5%CO2的細胞培養箱中。待貼壁細胞密度達到80%時,用胰蛋白酶進行消化和傳代,并選擇3~7代處于對數期的穩定細胞用于后續實驗。
3.細胞分組及處理:將HAVSMCs分成3組,即對照組、PDGF-BB組和PDGF-BB+利伐沙班組。待HAVSMCs細胞貼壁后,替換成無血清DMEM培養基孵育24h,使得HAVSMCs同步化。再給予20ng/ml PDGF-BB刺激HAVSMC細胞48h,以模擬ASO產生條件,促進血管平滑肌細胞發生增殖遷移。在此基礎上,再用溶于DMSO的8μm利伐沙班與PDGF-BB誘導的HAVSMCs細胞共孵育24h。
4.MTT法檢測各組HAVSMCs細胞活力:將HAVSMCs接種于96孔板,密度為5×104個/孔,而后置于培養箱中培養24h。按照材料與方法2進行不同細胞處理,離心并吸棄上清液,加20μl 5mg/ml MTT溶液反應3~4h。再加150μl DMSO試劑,振蕩10min致使結晶充分溶解,酶標儀測570nm處的吸光度A值。
5.Edu染色法檢測各組HAVSMCs增殖活性:將HAVSMCs接種于96孔板,密度為5×104個/孔,放入5% CO2培養箱中孵育24h。按照材料與方法2進行不同細胞處理,參考Edu染色試劑盒說明書,室溫下在孔板中加50nmol/l Edu溶液繼續培養細胞2h,加4%甲醛固定0.5h。而后,加入1000μl Edu Apollo處理細胞0.5h,DAPI核染色0.5h。用倒置顯微鏡(×100)觀察染色情況,即時拍照。
6.流式細胞儀檢測各組HAVSMCs細胞周期:分別轉移1×106個對照組、PDGF-BB組和PDGF-BB+利伐沙班組的血管平滑肌細胞至流式管中,并用預冷PBS清洗2次。流式管經1100r/min離心后棄去上清,加5ml 75%乙醇,振蕩混勻,并于4℃避光孵育過夜。1200r/min離心10min,小心移除上清。隨后依次加入PBS和PI/RNase染色液,繼續孵育12min,并在1h內用流式細胞儀檢測G0/G1期、S期及G2/M期的細胞占比。
7.Transwell檢測各組HAVSMCs遷移能力:收集對照組、PDGF-BB組和PDGF-BB+利伐沙班組的血管平滑肌細胞,將其懸浮于無血清培養基中,并稀釋細胞懸液至2×106個/毫升。在Transwell小室的上腔室中加100μl細胞懸液,同時,下腔室中加500μl無血清DMEM培養基。37℃孵育24h后,用4%多聚甲醛固定,并用0.1%結晶紫溶液進行染色。最后,用倒置顯微鏡(×100)觀察細胞遷移數并成像。
8.劃痕實驗檢測各組HAVSMCs劃痕愈合能力:收集對照組、PDGF-BB組和PDGF-BB+利伐沙班組的血管平滑肌細胞,將其接種于6孔板中,密度為1×105個/孔。待細胞貼壁后,再用無血清DMEM培養基培養12h。用20μl移液槍槍頭在孔板上劃線,同時用PBS清洗細胞2次。重新添加培養液,將孔板培養于37℃、5%CO2的培養箱,并于顯微鏡下(×40)觀察0和24h的劃痕變化及拍照。
9.Western blot法檢測血管平滑肌細胞N-cadherin和E-cadherin蛋白表達:收集對照組、PDGF-BB組和PDGF-BB+利伐沙班組的血管平滑肌細胞,用RIPA裂解液提取細胞總蛋白。經SDS-PAGE分離目標蛋白,將其轉移至PVDF膜上,加5%脫脂牛奶室溫封閉膜2h。用PBST溶液漂洗PVDF膜5次,加入一抗并在4℃下孵育過夜:抗N-cadherin、抗E-cadherin(稀釋比為1∶1000)和抗GAPDH(稀釋比為1∶2000)。再次用PBST溶液漂洗,加入兔抗IgG(稀釋比為1∶2000)孵育1h。以GAPDH為內參,用ECL化學發光試劑盒檢測并分析各組目的蛋白表達量。
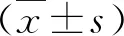
結 果
1.利伐沙班抑制PDGF-BB誘導的血管平滑肌細胞增殖:MTT及Edu實驗顯示,與陰性對照組比較,PDGF-BB誘導的血管平滑肌細胞活力明顯升高(P<0.01);與PDGF-BB組比較,利伐沙班處理顯著抑制了PDGF-BB誘導的血管平滑肌細胞的活力(P<0.05,圖1)。
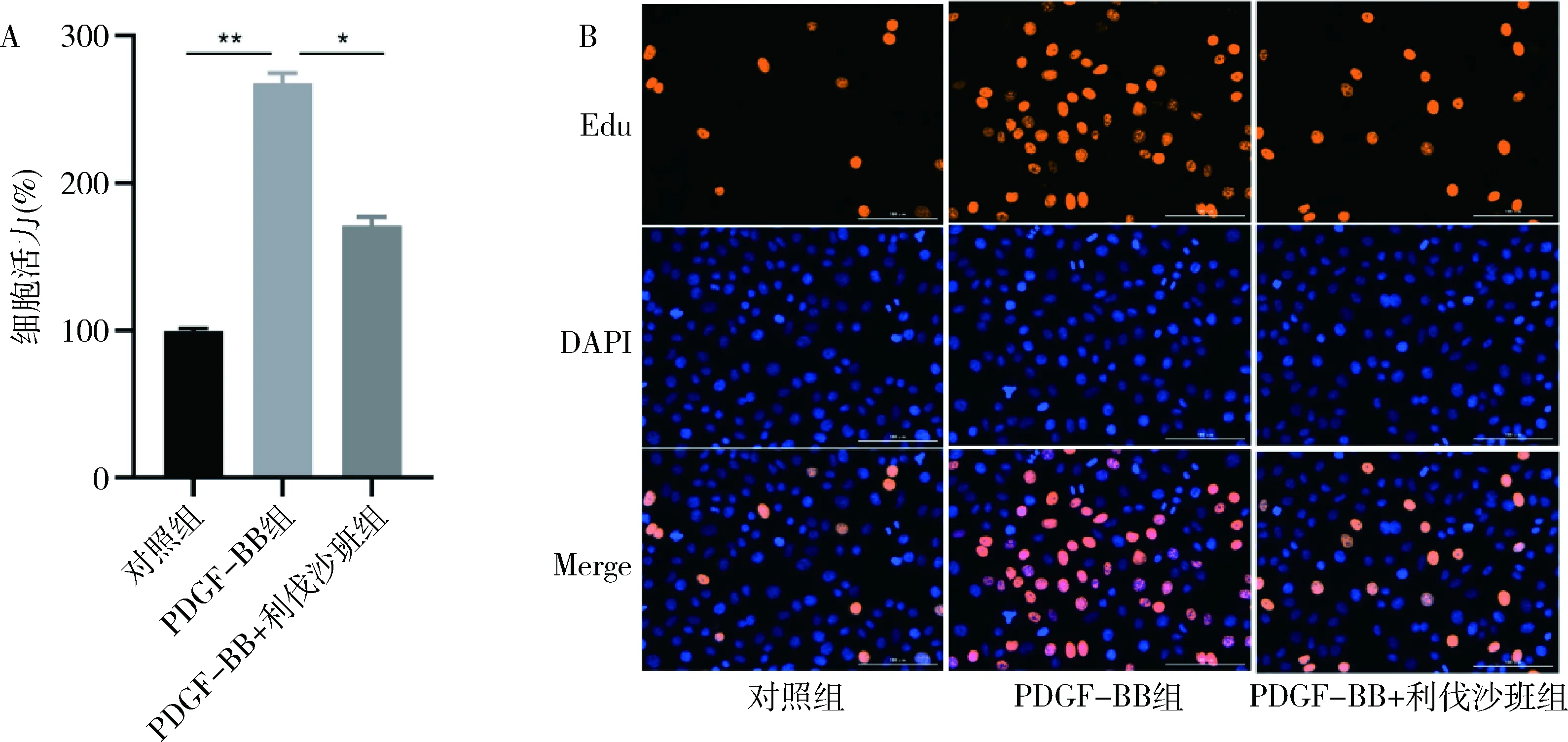
圖1 利伐沙班抑制PDGF-BB誘導的血管平滑肌細胞增殖A.MTT法檢測各組HAVSMCs細胞活力;B.Edu染色觀察各組HAVSMCs增殖情況(×100);*P<0.05,**P<0.01
2.利伐沙班抑制PDGF-BB誘導的血管平滑肌細胞從G0/G1期到S期轉換:PDGF-BB誘導的HAVSMCs中S期細胞數量較陰性對照組顯著增加,且G0/G1期細胞比例明顯下降;與PDGF-BB組比較,利伐沙班處理后,S期細胞數量明顯減少,G0/G1期細胞比例明顯升高,即利伐沙班抑制了PDGF-BB誘導的HAVSMC從G0/G1期到S期的細胞進程(圖2)。
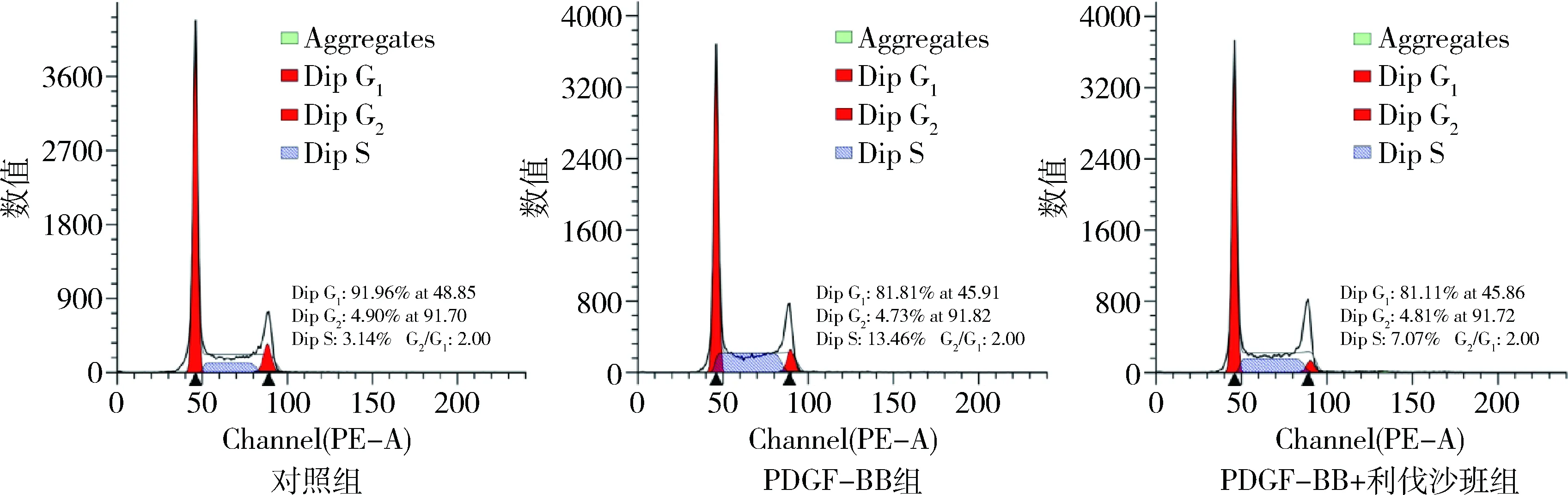
圖2 流式細胞儀檢測各組細胞的細胞周期
3.利伐沙班抑制PDGF-BB誘導的血管平滑肌細胞遷移:與陰性對照組比較,PDGF-BB誘導的血管平滑肌細胞的遷移能力顯著增強;與PDGF-BB組比較,利伐沙班處理能顯著降低PDGF-BB誘導的HAVSMC的遷移能力,即利伐沙班在體外能有效抑制動脈硬化閉塞癥模型細胞的遷移能力(圖3)。
圖3 利伐沙班抑制PDGF-BB誘導的血管平滑肌細胞遷移A.Transwell檢測各組HAVSMCs的遷移能力(結晶紫染色,×100);B.劃痕實驗檢測各組HAVSMCs中劃痕愈合情況(×40)
4.利伐沙班調控PDGF-BB誘導的血管平滑肌細胞遷移蛋白表達:與陰性對照組比較,PDGF-BB誘導的HAVSMCs中促遷移蛋白N-cadherin的表達量明顯增加,但抑遷移蛋白E-cadherin表達量明顯減少;與PDGF-BB組比較,利伐沙班處理PDGF-BB誘導的HAVSMCs后,N-cadherin表達量顯著減少,E-cadherin表達量顯著增加(圖4)。
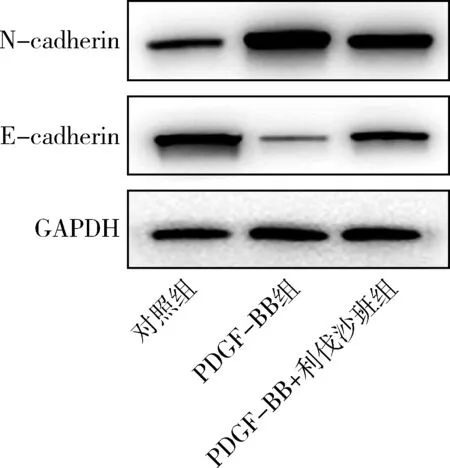
圖4 Western blot法檢測各組HAVSMCs中遷移相關蛋白N-cadherin和E-cadherin的表達量
討 論
動脈硬化閉塞癥是最常見的外周血管疾病之一,與高血壓、年齡、慢性腎衰竭和糖尿病等高風險因素有關,可影響下肢動脈、冠狀動脈和大腦動脈,且下肢動脈硬化閉塞癥會增加靜息疼痛、壞疽和跛行的風險[1,13,14]。在動脈硬化閉塞癥的發生、發展過程中,脂質會持續沉積在動脈內膜上,促使其惡化增生,形成動脈粥樣斑塊[1]。且隨著動脈壁的增厚和扭曲,斑塊面積也會不斷擴大,繼而誘發血栓形成及缺血癥狀[15,16]。由于社會人口老齡化以及不健康的高脂飲食,動脈硬化閉塞癥的發生率呈逐年上升趨勢,現已引起廣泛關注。
動脈硬化閉塞癥的病理機制涉及血管平滑肌細胞的異常增殖遷移、炎性反應激活和動靜脈血栓形成等,通常會導致患者機體供血不足,甚至危及其性命[6]。其中,血管平滑肌細胞的異常增殖遷移會致使血管腔狹小和管壁內膜增厚[17],加速動脈硬化閉塞癥的發病進程。據報道,miR-22-3p和miR-4463均可抑制血管平滑肌細胞的增殖遷移和內膜增生,從而調控動脈硬化閉塞癥的病理進程[18,19]。通過查閱相關文獻,筆者最終選用PDGF-BB刺激HAVSMCs,模擬動脈硬化閉塞癥的產生條件,以構建體外細胞模型[5]。筆者研究表明,PDGF-BB誘導的HAVSMCs細胞活力顯著升高,且S期細胞數量明顯增加,處于活躍增殖狀態。此外,HAVSMCs遷移能力明顯增強,伴隨著N-cadherin蛋白表達量上升,E-cadherin蛋白表達量下降,即PDGF-BB刺激處理促進了血管平滑肌細胞的異常增殖遷移。
迄今為止,動脈硬化閉塞癥的診斷有了很大的提高,但其有效治療措施仍然有限。目前動脈硬化閉塞癥的治療方式主要有開放性手術治療、藥物治療及干細胞移植等。前者包括血管搭橋術、血管內治療和動脈內膜切除術,但存在術后復發率高和僅有30%患者適用等弊端[4]。后者包括溶栓藥、抗凝藥、抗血小板藥和血管擴張素等,但此類藥物通常需要長期服用并存在各種毒性不良反應,如消化道出血、頭痛等[20]。因此,篩選并采用不良反應小和低毒的新型抗凝藥物有助于更好地治療動脈硬化閉塞癥患者。
利伐沙班作為全球第1個獲得臨床使用授權的新型口服抗凝藥物,具有不良反應小、易吸收、抗血栓和抗炎功效,常被用于預防房顫血栓栓塞并發癥、肺栓塞形成及術后靜脈血栓栓塞形成[21~23]。據報道,利伐沙班可通過抑制FⅩa因子調控巨噬細胞和大鼠血管平滑肌細胞的炎癥激活,從而減輕血管損傷后新生內膜的形成[24]。為了明確利伐沙班治療動脈硬化閉塞癥的藥理作用,筆者研究用8μm利伐沙班處理PDGF-BB誘導的HAVSMCs,結果發現利伐沙班有效抑制了PDGF-BB誘導的HAVSMCs的細胞活力并抑制其由G0/G1期到S期,表現為S期的細胞數量明顯減少。同時,利伐沙班處理PDGF-BB誘導的HAVSMCs后,血管平滑肌細胞的遷移能力也有所減弱,N-cadherin蛋白表達量減少,E-cadherin蛋白表達量增加,即利伐沙班能有效減弱血管平滑肌細胞的增殖及遷移能力,從而緩解動脈硬化閉塞癥的發病癥狀。
綜上所述,利伐沙班能有效抑制PDGF-BB誘導的血管平滑肌細胞增殖及遷移,為動脈硬化閉塞癥的臨床治療提供一定的實驗和理論基礎。

