體重指數與多囊卵巢綜合征臨床指標的相關性研究
孟小鈺 侯麗輝 孫 淼 郝松莉 張春蘭
多囊卵巢綜合征(polycystic ovary syndrome, PCOS)是育齡期女性常見的一種生殖內分泌疾病,發生率約為5%~10%[1]。其中約50%~70%的患者存在肥胖,而肥胖會加重PCOS患者的生殖障礙和代謝紊亂,主要表現為增加PCOS患者胰島素抵抗(insulin resistance, IR)和代償性高胰島素血癥(hyperinsulinism, HI)的發生,增加卵巢和腎上腺雄激素的分泌,抑制性激素結合球蛋白的合成[2]。本研究旨在探討不同體重指數PCOS患者的臨床特征及體重指數與臨床指標的相關性,為PCOS患者的臨床治療及療效評價提供理論依據。
對象與方法
1.研究對象:選取2016年12月~2019年12月黑龍江中醫藥大學附屬第一醫院PCOS臨床科研信息共享系統中19~39歲、BMI>18.5kg/m2的PCOS患者病例980例,患者平均年齡25.61±5.35歲,平均體重68.99±14.27kg。
2.診斷標準及排除標準:PCOS診斷標準采用2003年鹿特丹診斷標準[3];中國超重/肥胖不孕不育患者體質量管理路徑與流程專家共識[4];胰島素抵抗的診斷標準IR>2.69[5]。排除標準:①近3個月內應用激素類藥物或近1個月內服用可能會影響檢測結果的中藥、西藥或中成藥者;②其他雄激素過多相關疾病(包括21羥化酶缺乏的先天性腎上腺皮質增生、腫瘤、過量使用產生雄激素的藥物、庫欣綜合征等)。
3.研究方法:通過PCOS臨床科研信息共享系統,選定時間節點2016年12月~2019年12月,解析患者病例,導出患者的基本信息及生化指標。基本信息主要包括年齡、初潮年齡、體重指數(BMI)、腰圍(WC)、臀圍(HC)、腰臀比(WHR)、收縮壓(SBP)和舒張壓(DBP)。試驗室指標主要包括促卵泡激素(FSH)、黃體生成素(LH)、睪酮(T)、雄烯二酮(AND)、硫酸脫氫表雄酮(DHEAS)、性激素結合球蛋白(SHBG)、總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)和空腹血糖(FPG)和空腹胰島素(FINS);計算游離雄激素指數(FAI)、胰島素抵抗指數(IR)、胰島素敏感指數(ISI)和胰島β細胞功能指數(HOMA-β)。

結 果
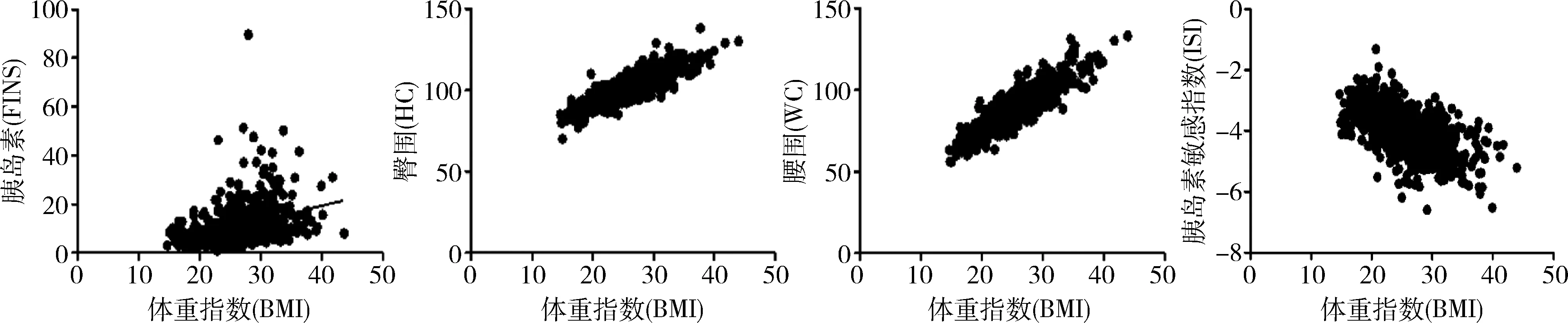
1.PCOS患者BMI及IR的分布情況:研究中共納入PCOS患者980例,超重和肥胖的發生率分別為33.67%和28.88%。18.5kg/m2 2.組間基礎信息的比較:18.5kg/m2 表1 不同體重指數PCOS患者的基礎信息比較 3.組間性激素比較:18.5kg/m2 表2 不同體重指數PCOS患者的性激素比較 4.組間糖脂代謝的比較:18.5kg/m2 表3 不同體重指數PCOS患者的糖脂代謝比較 5.BMI與臨床指標的相關性分析:PCOS患者的BMI與DBP(r=0.320)、SBP(r=0.371)、HOMA-β(r=0.441)、IR(r=0.454)、FINS(r=0.483)、WHR(r=0.554)、HC(r=0.848)和WC(r=0.869)間呈正相關,r值在0.3~0.9之間;與LH(r=-0.308)、ISI(r=-0.570)間呈負相關,r值在-0.3~-0.6之間,詳見圖1。 圖1 BMI與FIN/HC/WC/ISI的Pearson相關性分析散點圖 研究中共納入PCOS患者980例,其中超重的占33.67%、肥胖的占28.88%;IR的發生率隨著BMI的增大逐漸增加,分別為15.80%、48.18%和65.37%。肥胖是引起PCOS患者發生IR的一個獨立危險因素。與體重正常的PCOS患者比較,肥胖的PCOS患者更容易出現月經失調和排卵障礙且程度更重。本研究結果顯示無論肥胖與否,PCOS患者主要為腹型肥胖,臨床表現為腰臀圍比例增加,即男型肥胖。本研究結果顯示隨著BMI的增加,PCOS患者的腰臀比逐漸增加,組間比較差異有統計學意義;同時患者的空腹胰島素水平也逐漸升高,表現為HI。這主要是由于肥胖患者脂肪的過量儲存導致脂肪降解加強,使體內非酯化脂肪酸增多;過多的非酯化脂肪酸一方面可影響肝臟糖代謝過程并抑制肝臟對胰島素的滅活,另一方面還可以抑制胰島素受體酪氨酸激酶活性,從而使血液中胰島素水平增高[6]。此外,INS能夠加速形成脂肪,使體重上升。當體重超標達到35%~40%時,INS本身的敏感度也會降低30%~40%,IR將更為嚴重[7]。 臨床檢測中游離睪酮的測定受多種因素限制,而相較于總睪酮體FAI更能反映睪酮的生物學活性水平,是診斷PCOS 高雄激素血癥的敏感指標[8]。結果顯示,隨著患者BMI的增加,PCOS患者的SHBG水平逐漸下降,而FAI逐漸升高。這可能與肥胖的PCOS患者體內為HI狀態,抑制了肝臟組織SHBG合成水平,從而增加了PCOS患者的血液中游離雄激素的水平以及雄激素生物學活性有關[9]。患者卵巢內的異常和未成熟的卵母細胞長期的暴露在HA狀體下,將會阻斷優勢卵泡發育,使卵泡生長停滯甚至閉鎖,子宮內膜由于持續雌激素水平刺激而無孕激素抵抗,進而增加了子宮內膜癌的患病風險[10]。同時,PCOS患者體內HA、HI的激素內環境與肥胖之間相互影響,形成惡性循環[11]。 研究結果顯示,隨著PCOS患者BMI的逐漸增加,患者的FBG、FIN及IR水平逐漸升高而HDL水平逐漸降低,組間比較差異有統計學意義。同時3組患者的胰島β細胞分泌功能隨著BMI升高逐漸增加,而胰島素敏感度卻逐漸降低,組間比較差異有統計學意義。說明肥胖程度的加重使機體對胰島素的敏感度降低,同時使IR進一步加重[12]。而為了克服IR,胰島β細胞代償性的分泌增加,這可能會導致早期胰島β細胞功能受損,隨著病程的進展,導致糖尿病的發生[13]。提示肥胖加重了PCOS患者糖脂質代謝紊亂,增加了患者遠期發生動脈粥樣硬化、心血管疾病以及2型糖尿病的風險。 PCOS患者的BMI與DBP、SBP、HOMA-β、IR、FINS、WHR、HC和WC間呈正相關;而與LH和ISI間呈負相關。以上結果提示肥胖PCOS患者的IR、血脂紊亂、高血壓、高雄激素血癥和相關臨床癥狀的程度更為嚴重,肥胖的病理改變促進了PCOS的進展,加重了PCOS患者代謝及內分泌的紊亂的風險[14,15]。 綜上所述,防治肥胖,遏制肥胖與PCOS的惡性循環,對于PCOS 女性改善生殖內分泌狀況以及預防遠期并發癥的發生具有重要意義[16]。循證醫學支持PCOS患者調整生活方式減重有助于預防超重與肥胖,并改善遠期生命質量;對于體重正常的PCOS患者,其仍有遠期體重增加風險,因此同樣需要生活方式干預[17]。研究證實排卵障礙的發生隨BMI的增加而增加,肥胖PCOS女性體重下降5%就能改善自主排卵,提高自然妊娠率[18]。同時可以改善內分泌功能、心血管及精神心理健康,進而改善肥胖PCOS患者的妊娠結局。低熱量飲食以及運動減重作為一種非藥物干預,其可行性強、經濟負擔少且安全性高。我國首部超重或肥胖醫學營養治療專家共識明確提出,對于超重或肥胖的PCOS患者,首先應進行生活方式干預以減輕體重,以限能量平衡膳食(calorie restrict diet, CRD)為首選,且應對患者實施包括綜合教育、個體化方案、密切隨訪、社會和家庭支持在內的綜合管理,這為肥胖的PCOS患者提供了一種新的治療方法[19]。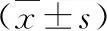
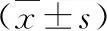
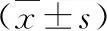
討 論

