2型糖尿病腎病患者尿外泌體足細胞標志蛋白、二肽基肽酶Ⅳ與尿白蛋白/尿肌酐相關性
劉 洋,趙 錦,胡翠寧,楊 陽,劉 丹
錦州市中心醫院1.內分泌糖尿病足亞專科;2.內分泌科;3.腫瘤科,遼寧 錦州 121000;4.南京醫科大學附屬老年醫院 內分泌科,江蘇 南京 210009
糖尿病腎病作為糖尿病的嚴重并發癥,是增加糖尿病患者心血管疾病、終末期腎病乃至死亡風險的重要因素,患者需要以透析、腎移植等方式維持生命[1]。糖尿病腎病早期腎損害較為隱匿,通過常規的尿蛋白定量定性檢查及患者的臨床癥狀很難獲得明顯的發病證據,這對糖尿病腎病患者的早期診斷和治療十分不利。近年來,細胞外泌體所攜帶的標志miRNA或蛋白質已被證實能夠準確反映細胞的病理生理狀況,且穩定的雙層膜結構使其反饋的結果更加穩定和真實[2-3]。本研究旨在探討2型糖尿病腎病患者尿外泌體足細胞標志蛋白(exosome podocyte marker protein,exosome-PCX)、二肽基肽酶Ⅳ(exosome dipeptidyl peptidase Ⅳ,exosome-DPP4)與尿白蛋白/尿肌酐(urine albumin creatine ratio,UACR)的相關性。現報道如下。
1 對象與方法
1.1 研究對象 選取錦州市中心醫院自2018年9月至2019年9月收治的180例2型糖尿病腎病患者為研究對象。納入標準:符合2型糖尿病腎病診斷標準[4];體質量指數20~30 kg/m2。排除標準:其他類型糖尿病,如1型糖尿病、成人遲發性糖尿病、妊娠糖尿病、繼發性糖尿病等;合并糖尿病急性并發癥,如酮癥酸中毒、高滲昏迷、低血糖昏迷等;合并原發性腎-泌尿疾病,如腎小球或腎小管間質疾病、尿路感染等;應激性血糖升高,如心肌梗死、急性創傷、酒精性胃出血、各類感染等;近4周內應用過可能引起腎毒性的藥物。按照UACR分級將患者分入A1組(UACR<30 mg/g)、A2組(UACR 30~300 mg/g)、A3組(UACR≥300 mg/g),每組各60例。另將同期60例健康體檢志愿者納入X組。4組研究對象均簽署知情同意書。本研究經醫院倫理委員會批準。
1.2 研究方法
1.2.1 實驗室指標檢測 囑研究對象禁食熱量8 h以上,晨起抽取靜脈血并留取兩管晨尿以備研究檢測。血液樣本經離心、沉淀后,以血清檢測患者肌酐、糖化血紅蛋白、空腹血糖等指標。
1.2.2 exosome-PCX和exosome-DPP4檢測
1.2.2.1 透射電鏡和納米示蹤技術 通過液壓透析濾過法對新鮮尿液樣本中的細胞外泌體進行分離和富集,以透射電鏡進行外泌體的外在形態特征鑒定。根據考馬斯亮藍蛋白定量結果選取10 μg左右的細胞外囊泡,1∶1 000比例PBS稀釋,通過納米示蹤技術進行外泌體的顆粒直徑和濃度統計。
1.2.2.2 蛋白免疫印跡法 在富集細胞外囊泡的樣本中加入5×loading buffer(上樣緩沖液),5 min沸水浴(每個槽上樣本量蛋白為4 μg,加緩沖液至40 μl)。加入10% SDS-PAGE凝膠電泳將蛋白分離后,用Bio-Rad電泳儀轉移槽將凝膠蛋白條轉移至PVDF膜上,封閉3 h后洗膜3次,浸入含有腎足細胞標志蛋白(podocyte marker protein,PCX)單克隆抗體和二肽基肽酶Ⅳ(dipeptidyl peptidase Ⅳ,DPP4)單克隆抗體的抗體緩沖液中,經過一抗和二抗之后,洗膜加入曝光液,取出濾干后定影掃描。
1.2.2.3 酶聯免疫吸附法 將所需板條取出,將各濃度的標準品及待測樣本置于相應的孔中,在37℃箱內孵育60 min后甩盡孔內液體,按照酶聯免疫吸附法說明書進行洗滌和孵育后,每孔加入90 μl顯色液,繼續37℃孵育15 min后,加入50 μl終止液,隨即在酶標儀上讀取出樣本數值。
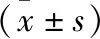
2 結果
2.1 4組研究對象一般資料比較 與X組比較,A1組、A2組、A3組收縮壓、舒張壓、體質量指數、糖化血紅蛋白、空腹血糖升高,差異有統計學意義(P<0.05)。A1組糖尿病病程最短,A2組長于A1組,A3組最長,差異有統計學意義(P<0.05);且隨著糖尿病病程增加,收縮壓、舒張壓、肌酐、UACR逐漸升高,差異有統計學意義(P<0.05)。見表1。
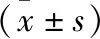
表1 4組研究對象一般資料比較
2.2 4組研究對象exosome-PCX和exosome-DPP4表達水平比較 X組、A1組、A2組、A3組exosome-PCX分別為(1.18±0.37)ng/ml、(2.00±1.05)ng/ml、(2.41±1.13)ng/ml、(3.30±1.78)ng/ml,組間兩兩比較,差異均有統計學意義(P<0.05)。X組、A1組、A2組、A3組exosome-DPP4分別為(0.77±0.32)ng/ml、(1.55±0.22)ng/ml、(1.80±0.18)ng/ml、(2.69±0.75)ng/ml,組間兩兩比較,差異均有統計學意義(P<0.05)。
2.3 exosome-PCX、exosome-DPP4與UACR的相關性分析 exosome-PCX、exosome-DPP4與UACR呈正相關(r=0.873、0.805,P<0.05)。
2.4 exosome-PCX、exosome-DPP4、UACR對2型糖尿病腎病診斷價值 exosome-PCX ROC曲線下面積為0.673(95%可信區間0.585~0.756,P<0.05),exosome-DPP4 ROC曲線下面積為0.667(95%可信區間0.579~0.761,P<0.05),UACR ROC曲線下面積為0.669(95%可信區間0.573~0.752,P<0.05)。見圖1。

圖1 exosome-PCX、exosome-DPP4、UACR對2型糖尿病腎病診斷價值ROC曲線
3 討論
糖尿病腎病是糖尿病患者的常見慢性并發癥,危害性極高。糖尿病腎病患者體內糖原反應物隨著病程延長而不斷蓄積,有20%~40%的糖尿病腎病患者會走向終末期腎病[5]。糖尿病腎病的理化檢查樣本以尿液為主,臨床上通常選擇尿蛋白、腎小球濾過率、UACR及炎癥因子等作為腎損傷的標志物。但當腎功能(腎小球功能為主)出現較為顯著的障礙時,肌酐才會出現異常改變;尿中白蛋白含量升高時,腎小球濾過率通常早已低于正常水平。因此,將單純的尿蛋白定性定量檢測作為糖尿病腎病的早期診斷指標存在一定的滯后性[6-7]。
隨著分子生物學的飛速發展,外泌體逐漸成為疾病早期預防、診斷及治療的研究熱點。外泌體雙層膜結構的隔離作用可防止RNA酶及蛋白酶水解,使細胞釋放的信息保存更完整。尿中外泌體成分較為復雜,24 h新鮮尿液可發現尿外泌體約1 400種,且外泌體的種類和數目是動態的,與機體狀態密切相關[8]。有研究報道,糖尿病腎病早期腎小球基底膜會出現增厚、擴張等改變,足細胞作為構成腎小球濾過屏障的重要組成部分,對大分子的滲透性作用大幅減弱,足細胞及其碎片(通常認為是exosome-PCX)會隨著尿液排出,因此,exosome-PCX是早期腎損害的標志物之一[9]。DPP4作為一種高度保守的外肽酶,分布在血液、尿液等體液中,能夠通過刺激多種因子表達而刺激腎系膜增殖、膜外基質蓄積,從而導致腎基底膜增厚,引起腎功能障礙。有研究發現,糖尿病患者尿exosome-DPP4表達顯著升高,且在短時間內結構穩定,是較好的動態監測糖尿病療效的指標[10]。因此,本研究選取exosome-PCX和exosome-DPP4作為觀察指標。本研究結果顯示:X組、A1組、A2組、A3組exosome-PCX、exosome-DPP4表達水平呈逐漸升高趨勢,組間兩兩比較,差異均有統計學意義(P<0.05);且exosome-PCX、exosome-DPP4與UACR呈正相關(r=0.873、0.805,P<0.05)。這提示,尿外泌體可反映糖尿病腎病患者的疾病發展程度。在腎活檢仍是腎病診斷“金標準”的背景下,UACR在腎疾病發生、發展中扮演重要角色,但其存在的滯后性,可能對糖尿病腎病早期診斷造成不利影響。本研究通過繪制ROC曲線得知exosome-PCX、exosome-DPP4的ROC曲線下面積與UACR相仿,這表明,尿exosome-PCX、exosome-DPP4與UACR一樣對于2型糖尿病腎病有著較強的診斷價值。
綜上所述,exosome-PCX、exosome-DPP4表達水平與UACR密切相關,具有與UACR相近的2型糖尿病腎病診斷作用,可預測早期2型糖尿病腎病的發生和發展。外泌體作為一種新型生物學非侵入性疾病診斷方法,有望代替腎組織病理活檢,給糖尿病腎病患者帶來新的診療希望。

