遠端缺血后適應在急性ST段抬高型心肌梗死患者心血管轉歸中有效性及安全性分析
趙翰文,丁士勤,龔 敏,李坤鵬,張 英
1.淮南新華醫療集團新華醫院 心血管內科,安徽 淮南 232052;2.北部戰區總醫院 核醫學科,遼寧 沈陽 110016
缺血性心臟病對社會造成了巨大的健康負擔和經濟負擔[1]。近年來,發達國家急性ST段抬高型心肌梗死(ST segment elevation myocardial infarction,STEMI)的發病率有所下降,但欠發達國家的發病率卻持續上升[2-3]。直接經皮冠狀動脈介入治療(primary percutaneous coronary intervention,PPCI)可對缺血心肌進行快速再灌注,作為搶救缺血心肌、縮小梗死面積的標準治療方法,再灌注可能會導致缺血心肌進一步損傷,發生“缺血-再灌注損傷”。因此,如何減少心肌缺血再灌注損傷成為臨床關注的重點[4]。遠端缺血后適應(remote ischemic postconditioning,RIC)主要利用遠端組織短暫缺血再灌注產生的遠程缺血條件反射重復一系列短暫再灌注循環,恢復冠狀動脈血流,提高心肌細胞對缺血的耐受性[5-6]。本研究旨在探討RIC在STEMI患者心血管轉歸中的有效性及安全性。現報道如下。
1 資料與方法
1.1 一般資料 選取自2017年10月至2019年3月淮南新華醫療集團新華醫院收治的117例STEMI患者為研究對象。納入標準:年齡18~80歲;于發病12 h內入院治療;胸痛時間>30 min,伴有至少2導聯ST段抬高>0.2 mV或新的束支傳導阻滯。排除標準:接受血液透析者;昏迷或心源性休克者;接受甲氧芐啶、格列本脲等影響遠端缺血適應的藥物治療者;嚴重外周動脈疾病者;有心肌梗死史或冠狀動脈旁路手術史者;孕婦或哺乳期女性。將患者隨機分為A組(n=60)與B組(n=57)。兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。見表1。本研究經醫院倫理委員會批準。所有患者均簽署知情同意書。
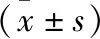
表1 兩組患者一般資料比較
1.2 研究方法 所有患者入院后均接受PPCI治療,預先口服阿司匹林300 mg、替格瑞洛180 mg或氯吡格雷300~600 mg,術中給予70~100 U/kg肝素。常規采用右側橈動脈入路,若右手外傷史或橈動脈變異等不適合右側橈動脈路徑則改為左橈動脈入路或股動脈入路,根據心電圖及造影結果確定冠狀動脈病變數和梗死相關動脈。B組患者在A組基礎上實施RIC方案:直徑2.0~2.5 mm,順應性球囊(Maverick 波士頓科學)擴張閉塞病變后,在再灌注開始60 s內,以6 atm(1 atm=101.325 kPa)充盈球囊阻斷血流30~60 s,然后減壓回收球囊恢復血流30~60 s,重復6~8組缺血-再灌注后給予持續再灌注。A組患者在再灌注后開始的10 min內不作干預,通過以上處置后,植入藥物洗脫支架。PPCI術成功標準:梗死相關動脈(infarct related artery,IRA)的遠端血流為心肌梗死溶栓治療前血流分級(thrombolysis in myocardial infarction,TIMI)3級,未見A型以上冠脈夾層,如果術中即刻植入藥物洗脫支架,則殘余狹窄<20%,住院期間未發生死亡、心力衰竭、再梗死等并發癥。
1.3 觀察指標 比較兩組患者不同時間點(治療前、發病12 h、發病15 h、發病18 h、發病21 h、發病24 h)的血清肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)水平、術后再灌注心律失常(室性心動過速、頻發室性早搏、竇性停搏、心室顫動、竇性心動過緩、慢血流)發生情況、校正的TIMI血流分級(corrected TIMI blood flow classification,CTFC)。隨訪1年,分析不良心血管事件(major adverse cardiovascular events,MACE)發生情況,包括復發性急性心肌梗死、惡性心律失常、心力衰竭再住院、血運重建、中風和死亡。
2 結果
2.1 兩組患者不同時間點CK-MB水平比較 B組患者發病后12、15、18、21、24 h的CK-MB水平均低于A組,差異有統計學意義(P<0.05)。見表2。

表2 兩組患者不同時間點CK-MB水平比較
2.2 兩組患者術后再灌注心律失常發生情況及CTFC比較 B組患者室性心動過速、頻發室性早搏、竇性停搏、心室顫動及竇性心動過緩發生率低于A組,差異有統計學意義(P<0.05)。兩組患者慢血流發生率、CTFC比較,差異無統計學意義(P>0.05)。見表3。

表3 兩組患者術后再灌注心律失常發生情況及CTFC比較/例(百分率/%)
2.3 兩組患者MACE發生情況比較 A組發生急性心肌梗死2例,心力衰竭再住院1例,血運重建4例,惡性心律失常2例,死亡1例,MACE發生率為20.00%(12/60)。B組發生急性心肌梗死1例,心力衰竭再住院1例,血運重建1例,MACE發生率為5.26%(3/57)。B組患者MACE發生率低于A組,差異有統計學意義(P<0.05)。
3 討論
PPCI是STEMI的推薦治療方法,但該手術易出現再灌注損傷,該損傷主要因血流突然恢復造成心肌細胞功能障礙、無法有效收縮,出現一定程度的凋亡[7]。目前,心肌再灌注損傷產生的原因并不十分明確,可能因素包括過度激活的白細胞、自由基損傷和細胞內鈣超載等[8]。當IRA開通后,攜帶充足氧分子的血液流進缺血組織和器官,由黃嘌呤氧化酶催化產生數量眾多的氧自由基,然后與心肌細胞中的各類成分發生反應,誘發心肌細胞代謝障礙,進而引起結構性損傷,造成氧化應激反應。此時,損傷的細胞功能及結構可以進一步加速氧自由基產生,形成惡性循環,最終引起缺血再灌注損傷進展[9-10]。
再灌注心律失常作為常見的心肌再灌注損傷表現,易出現在IRA開通的2 h內,其不僅標志著心肌損傷加重,也會影響心肌梗死患者的近期預后。因此,可以通過分析再灌注心律失常發生情況間接反映RIC對PPCI手術后心肌再灌注損傷的保護作用[11]。本研究結果顯示,B組患者室性心動過速、頻發室性早搏、竇性停搏、心室顫動及竇性心動過緩發生率低于A組,兩組患者術后的CTFC無明顯差異,提示RIC可保持并穩定PPCI手術后心肌再灌注損傷,起一定的保護作用[11]。
正常的生理情況下,心肌酶主要分布在心肌細胞的細胞漿中,當心肌梗死出現后,完整的心肌細胞被破壞,細胞漿中的的CK-MB釋放入血,因此,心肌酶水平增高是心肌損傷的標志之一[12]。本研究發現,B組術后不同時間點的CK-MB水平均低于A組,提示RIC可維持PPCI手術后心肌細胞中的CK-MB水平穩定,進一步降低心肌損傷,縮小心肌梗死面積,對于心肌保護方面效果較好,其原因可能為RIC作為一種在心肌再灌注開始時應用短暫的冠狀動脈閉塞/再灌注來保護心肌細胞,提高其對缺血的耐受性,減輕缺血再灌注導致的損傷,最終達到保護心功能的目的[13-14]。本研究B組的MACE發生率明顯低于A組,提示RIC應用于STEMI患者的安全性高,與甘劍挺等[15]研究結果一致。
綜上所述,RIC能夠降低STEMI患者再灌注心律失常發生率,減少心肌損傷,降低MACE發生率。

