胰腺癌差異表達基因的篩選及其功能分析
田莉,胡月明
唐山中心醫院病理科,河北唐山063000
胰腺癌是消化道常見惡性腫瘤,具有侵襲性強、易早期轉移、病死率高等特點,患者5年存活率<5%。2018年全球新發胰腺癌病例和死亡病例分別為45.89萬人、43.22萬人[1];中國癌癥中心發布的相關數據顯示2015年我國胰腺癌發病率為6.92/10萬、死亡率為6.16/10萬[2]。目前胰腺癌的干預手段包括手術、化療、放療等,但臨床療效欠佳[3]。超過90%的胰腺癌患者會發生KRAS突變,70%的患者會發生TP53錯義突變。研究顯示,突變型KRAS與p53蛋白之間存在依賴于GTP酶激活蛋白(GAP)的異常剪接和膜定位的通路;TP53通過RNA剪接蛋白hnRNPK介導的通路對GAP異常剪接發揮調節作用,從而促使TP53與KRAS突變協同促癌[4]。近年來,基因組學、蛋白組學及生物信息學的發展極大地促進了惡性腫瘤的分子診斷及分型的進步,亦有利于探索胰腺癌的分子機制和尋找潛在生物學標志。本研究利用公共數據庫中的數據和資料,尋找胰腺癌的差異表達基因(DEG),并對DEG進行功能分析和通路富集分析,以期尋找胰腺癌核心基因和潛在藥物作用靶點。
1 資料與方法
1.1 基因芯片數據的來源 通過美國國家生物技術信息中心公共基因芯片(GEO)數據庫進行基因芯片篩選。以“pancreatic cancer”為關鍵詞在GEO數據庫中檢索胰腺癌患者臨床標本,檢索時間:2000年1月—2021年4月,獲得GSE15471[5]、GSE62165[6]兩個數據集,剔除重復標本,兩個數據集均有胰腺癌組織樣本和正常胰腺組織樣本,共納入157例胰腺癌組織樣本和52例正常胰腺組織樣本。
1.2 DEG的篩選 利用GEO數據庫的GEO2R在線工具分析GSE15471、GSE62165,篩選符合條件的DEG。篩選條件:校正后P<0.05;|log FC|>1.5,FC為差異倍數。同時滿足以上2個條件的基因為DEG。通過Venny2.1在線工具(https://bioinfogp.cnb.csic.es/tools/venny)對篩選出來的DEG進行映射,找出共同數據,以提高數據的準確性。
1.3 DEG的功能和信號通路富集分析 用在線工具 DAVID(version 6.7,http://david.ncifcrf.gov)進行基因本體(GO)功能分析、京都基因與基因組百科全書(KEGG)通路富集分析,明確DEG在胰腺癌發生中的作用。GO功能分析將DEG功能注釋分生物過程、細胞組分和分子功能;KEGG通路富集分析對DEG作用機制和信號通路進行總結。
1.4 蛋白互作網絡(PPI)的構建和基因模塊分析在 STRING(http://string-db.org)和 Cytoscape(version 3.6.0)軟件中繪制關于DEG的PPI網絡圖,并處理為可視化網絡圖。用Cytoscape3.6.0生物信息學軟件平臺的插件MCODE工具對構建的生物學網絡進行關聯度分析,篩選出核心蛋白質簇和關鍵節點蛋白。MCODE選擇標準:MCODE scores>10,degree cut-off=2,node score cut-off=0.2,Max depth=100,k-score=2。將篩選的核心基因利用cBioPortal網站繪制Kaplan-Meier法生存曲線,以明確核心基因與患者預后的相關性。
2 結果
2.1 DEG篩選結果 GSE15471數據集納入78例組織樣本,分析得到708個DEG,其中表達上調基因625個、表達下調基因83個;GSE62165數據集納入131例組織樣本,分析得到1 943個DEG,其中表達上調基因1 386個、表達下調基因557個。對兩組DEG進行映射,明確548個為共表達基因,其中表達上調基因476個、表達下調基因72個。
2.2 GO功能分析結果 對548個DEG進行GO功能分析,相關數據可分為生物過程、細胞組分、分子功能等三類,篩選P<0.05的結果有38條。生物過程:膠原蛋白分解代謝過程、細胞黏附、膠原纖維組織、細胞外基質分解、內肽酶活性負調節、內胚層細胞分化、骨骼系統開發、免疫應答、白細胞遷移、炎癥反應;細胞組分:細胞外間隙、胞外區、蛋白質類細胞外基質、胞外體、內質網腔、基底膜、血小板α顆粒管腔、質膜;分子功能:包括與肝素結合、與膠原結合、絲氨酸型內肽酶活性、與鈣離子結合、與整合素綁定、與血小板衍生生長因子結合、與蛋白多糖結合等。
2.3 KEGG通路富集分析結果P<0.05篩選得到的結果有18條。包括ECM受體作用、蛋白質消化吸收、PI3K-Akt信號通路、吞噬體、血小板活化、白細胞經內膜遷移、癌癥相關通路、細胞因子-受體相互作用、癌癥中的轉錄失調、胰腺分泌物等。
2.4 PPI的構建和核心基因生存分析結果 構建548個DEG的PPI,有67個屬于核心基因,分別屬于2個子簇(得分≥10)。子簇A包含30個節點、241條邊;子簇B包含37個節點、272條邊。其中節點度排名前6的核心基因:FN1(節點度=138)、MMP2(節點度=97)、PTPRC(節點度=80)、ITGAM(節點度=77)、COL1A2(節點度=76)、COL3A1(節點度=71)。見圖1。對6個核心基因進行Kaplan-Meier生存分析,根據基因相對表達量中位數將胰腺癌患者劃分為高表達組和低表達組。FN1高表達組中位生存時間(19.77個月)短于低表達組(22.80個月),比較差異有統計學意義(P=0.029);MMP2高表達組中位生存時間(11.13個月)短于低表達組(13.13個月),比較差異有統計學意義(P=0.011)。PTPRC、ITGAM、COL1A2、COL3A1高表達組中位生存時間分別為19.87、19.87、19.73、19.77個月,低表達組中位生存時間分別為24.6、22.8、22.0、35.3個月,比較差異均無統計學意義(P均>0.05)。
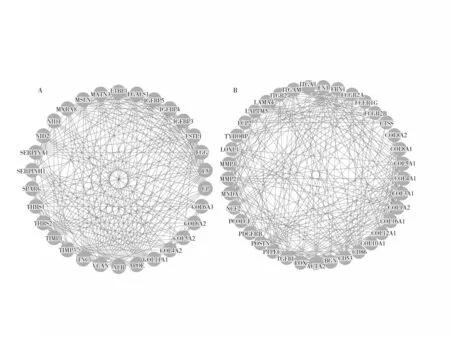
圖1 核心基因的PPI圖
3 討論
近年來,隨著DNA、RNA測序技術的發展,對于胰腺癌的分子分型展開了較多的探索,以期開展胰腺癌的精準治療。COLLISSON等[7]根據臨床胰腺癌組織標本和基礎實驗基因組學分析的結果,將胰腺癌區分為經典型、類間充質型和外分泌樣型,對臨床和預后具有一定的指導意義。其中經典型的GATA6、KRAS等黏附基因及上皮細胞相關基因多處于高表達狀態;類間充質型的TWIST1、CAV1存在異常表達的狀態;而外分泌樣型的消化酶基因高表達。有研究將胰腺癌患者區分為基底樣A型、基底樣B型、混合型、典型性A型、典型性B型等5個類型[8]。但可應用于的胰腺癌分子分型及發生、發展的分子機制尚未明確,需要進一步進行探索。
本研究共納入157例胰腺癌組織和52例正常胰腺組織,進行相關分析后明確了548個DEG,其中大部分呈高表達狀態(476個),低表達基因較少(72個)。在548個DEG中有PTPRC、ITGAM、COL1A2、COL3A1、FN1、MMP2共6個核心基因。PTPRC具有編碼蛋白質酪氨酸磷酸酶的作用,被公認是T細胞和B細胞抗原受體信號轉導的重要調節劑,在多種惡性腫瘤中呈異常表達狀態,但其在胰腺癌中的研究較少[9]。ITGAM位于染色體16p11.2,編碼白細胞黏附分子β2,具有介導體內細胞向炎癥局部遷移和聚集的作用,亦與腫瘤細胞的早期侵襲和轉移具有相關性。研究表明,處于異常表達狀態的ITGAM對于調控髓源性免疫細胞遷移到腫瘤微環境具有重要作用,影響腫瘤患者的整體生存期和預后[10-12]。COL1A2、COL3A1屬于膠原蛋白基因家族,其家族構成了細胞外基質的主要成分,在細胞黏附、固定、遷移中具有重要作用,在胰腺癌的轉移和侵襲中亦具有重要作用[13]。Ⅰ型膠原蛋白是細胞外基質中最豐富的膠原蛋白,根據α1(Ⅰ)鏈和α2(Ⅰ)鏈構成的不同可分為兩個亞型。COL1A2編碼Ⅰ型膠原的α2(Ⅰ)鏈,在乳腺癌、頭頸部癌、結直腸癌、胰腺癌等惡性腫瘤中異常表達[14]。研究發現,COL1A2通過與microRNA相互作用,可直接在胰腺癌細胞增殖、遷移、侵襲和體內異種移植進程中發揮作用[15]。一項臨床試驗比較了胰腺癌患者、胰腺良性病變患者和健康人群血清COL6A3水平,結果發現胰腺癌患者的COL6A3蛋白水平顯著升高,高COL6A3血清水平與神經周浸潤、吸煙等因素相關,并證明循環COL6A3在胰腺癌診斷中有潛在臨床價值[16]。以上研究均顯示PTPRC、ITGAM、COL1A2、COL3A1參與各種腫瘤的發生發展;但本研究顯示PTPRC、ITGAM、COL1A2、COL3A1與生存時間無關。考慮以下原因:上述基因與胰腺癌的發生發展具有相關性,但胰腺癌發生發展由多因素引起,上述基因與生存時間無必然的因果關系;進行Kaplan-Meier生存分析,上述基因高表達組和低表達組之間的生存時間亦存在不同,僅表現在統計學上無差異,可考慮進一步對腫瘤分期、性別、年齡等因素進行分層分析,但因局限于數據來源于公共數據庫,難以在本文中開展探索;上述相關研究多從細胞和動物實驗層面開展,具體在臨床病例中亦存在差異。
本研究對篩選出來的6個核心基因進行生存相關的Kaplan-Meier分析,結果顯示FN1和MMP2的高表達與胰腺癌患者的預后不良相關。FN1是一種以二聚體或者多聚體的形式存在于細胞表明或細胞外基質中的糖蛋白,介導細胞與細胞外基質的相互作用,在細胞黏附、遷移、生長和分化中起重要作用[17-18]。FN1可通過與整合素受體 α5β1結合激活PI3K/Akt信號通路,在食管癌、鼻咽癌、卵巢癌等多種腫瘤中具有促進細胞增殖和遷移的作用[19]。研究發現,65.7%的胰腺癌患者間質細胞中FN1蛋白表達升高,FN1陽性的患者存活率明顯降低[20]。研究表明,FN1高表達與吉西他濱干預胰腺癌的耐藥性相關,腫瘤相關性巨噬細胞能夠分泌攜帶FN1蛋白的囊泡,FN1通過ERK信號通路引起胰腺癌對吉西他濱的耐藥,采用FN1抑制劑可顯著逆轉吉西他濱的耐藥[21]。FN1在胰腺癌中處于異常表達狀態[22],本研究亦發現FN1高表達與患者預后不良具有相關性。此外,MMP是一類具有裂解細胞外基質底物能力的內源性蛋白水解酶,具有調節細胞黏附性及促進微血管新生的作用,參與癌細胞的遷移、侵襲等病理過程,可分為MMP1、MMP2、MMP9、MMP11等20多個亞型[23-24]。MMP-2在胰腺癌組織中高表達,與胰腺癌患者術前血清CA19-9水平升高、組織學分級差淋巴結轉移神經周浸潤及遠處轉移有關[25]。本研究亦發現,MMP2高表達組的中位生存時間短于低表達組。
綜上所述,PTPRC、ITGAM、COL1A2、COL3A1、FN1、MMP2參與胰腺癌的發生、侵襲和轉移的過程,有望成為胰腺癌治療的潛在靶點。本研究為胰腺癌的精準治療提供了一定的思路和方向,但上述結果尚需通過臨床和基礎實驗進行驗證。

