吡非尼酮對(duì)慢性傳輸型便秘小鼠的治療作用及機(jī)制
王博,劉勇,任冰冰,付思齊,姚志偉,孫大慶
天津醫(yī)科大學(xué)總醫(yī)院兒外科,天津300052
功能性便秘是最常見的消化道疾病,表現(xiàn)為腸道傳輸時(shí)間變慢,糞便干硬,排便次數(shù)減少[1]。慢性傳輸型便秘(STC)作為最常見的功能性便秘,是多種因素(炎癥、分泌功能障礙、消化道神經(jīng)支配的改變)相互作用的結(jié)果[2]。研究發(fā)現(xiàn),腸道微生物和短鏈脂肪酸失衡可能是STC發(fā)病的另一危險(xiǎn)因素[3]。STC一般治療包括增加運(yùn)動(dòng)量、高纖維飲食以及藥物干預(yù)。除了高纖維飲食和瀉藥干預(yù)外,益生菌也可以作為STC的替代治療藥物[4]。手術(shù)被認(rèn)為是頑固性STC最后的治療手段。吡非尼酮(PFD)是目前被歐盟批準(zhǔn)的治療特發(fā)性肺纖維化的兩種藥物之一。PFD可改善輕中度肺纖維化患者的肺功能,降低患者病死率,延長(zhǎng)無進(jìn)展生存期[5-6]。PFD通過多種機(jī)制發(fā)揮抗纖維化的作用,包括下調(diào)轉(zhuǎn)化生長(zhǎng)因子β(TGF-β)、腫瘤壞死因子α(TNF-α)表達(dá),抑制炎癥反應(yīng),降低肌成纖維細(xì)胞的活化[7-8]。PFD還是活性氧(ROS)清除劑,可下調(diào)氧化相關(guān)基因的表達(dá),減少過氧化氫和ROS的產(chǎn)生[9]。研究發(fā)現(xiàn),STC的結(jié)腸組織中存在氧化應(yīng)激損傷[10]。我們前期研究發(fā)現(xiàn),STC患者骨形態(tài)發(fā)生蛋白2(BMP2)蛋白表達(dá)升高。2020年9月—2021年3月,本研究探究PFD對(duì)STC小鼠的治療作用及機(jī)制。
1 材料與方法
1.1 動(dòng)物、試劑及儀器 SPF級(jí)雄性BALB/c小鼠50只,6~8周齡,體質(zhì)量(20±2)g,購自濟(jì)南朋悅實(shí)驗(yàn)動(dòng)物繁育有限公司(合格證號(hào):No.370726201100859673),并于山東大學(xué)生命科學(xué)院實(shí)驗(yàn)動(dòng)物中心飼養(yǎng),符合動(dòng)物倫理學(xué)標(biāo)準(zhǔn)。PFD購自大連美侖生物技術(shù)有限公司,純度>98.5%。洛哌丁胺購自美國(guó)Sigma公司;TNF-α抗體購自美國(guó)Abcam公司;HE染色試劑盒購自中國(guó)南京BioChannel公司;TNF-α抗體、蛋白基因產(chǎn)物(PGP)9.5抗體購自武漢三鷹生物技術(shù)有限公司。
1.2 動(dòng)物分組及模型制備 小鼠適應(yīng)性喂養(yǎng)1周后,將其隨機(jī)分為對(duì)照組、STC組及1、10、100 mg/kg治療組,各10只。STC組、各治療組給予10 mg/kg洛派丁胺溶液(美國(guó)Sigma公司)灌胃,對(duì)照組給予等量生理鹽水灌胃,均2次/日,持續(xù)2周。自造模第8天,各治療組在洛哌丁胺灌胃3 h后分別給予1、10、100 mg/kg的PFD灌胃,1次/日,持續(xù)1周。
1.3 小鼠一般情況及糞便參數(shù)記錄 每天對(duì)小鼠的體質(zhì)量、飲水量、攝食量進(jìn)行監(jiān)測(cè)。實(shí)驗(yàn)結(jié)束后,采集糞便樣本進(jìn)一步分析。給藥14 d后,將小鼠禁食16 h,給予100 g/L活性炭混懸液2 mL灌胃處理。記錄各組第1顆黑色糞便排出時(shí)間,測(cè)量單只小鼠每小時(shí)排便次數(shù),并計(jì)算糞便含水量,糞便含水量=(糞便濕重-糞便干重)/糞便濕重×100%。
1.4 結(jié)腸組織形態(tài)學(xué)變化觀察 干預(yù)完成后將小鼠頸椎脫臼處死取結(jié)腸段組織,用生理鹽水沖洗結(jié)腸內(nèi)容物,剪取新鮮結(jié)腸1 cm,用4%多聚甲醛固定,石蠟包埋后切片,切片厚度5μm。組織切片經(jīng)二甲苯脫蠟和梯度乙醇脫水后,用HE染色試劑盒染色,中性樹脂封片后,在光學(xué)顯微鏡(×10)下觀察結(jié)腸組織形態(tài)。剝離小鼠結(jié)腸肌層,采用肌間神經(jīng)元全層鋪片,用PGP9.5神經(jīng)元特異性指標(biāo)染色。剪取遠(yuǎn)端結(jié)腸段(2~3 cm)置于含氧磷酸鹽緩沖鹽水(PBS)中,沿腸系膜邊緣切開,清除其內(nèi)容物,最大限度地拉伸并剝離肌層,用4%多聚甲醛固定過夜。37℃條件下,將肌層用5%山羊血清封閉30 min。孵育PGP9.5抗體(14730-1-AP,1∶100),并在4℃條件下孵育過夜,PBS清洗一抗后,加入二抗并在37℃下孵育1 d。蔡司激光共聚焦顯微鏡LSM880(×20)觀察結(jié)腸肌層神經(jīng)元形態(tài)變化。用抗TNF-α抗體進(jìn)行免疫組化染色評(píng)估結(jié)腸組織中炎癥反應(yīng)發(fā)生的位置及程度。方法:結(jié)腸組織石蠟切片經(jīng)二甲苯脫蠟,梯度乙醇脫水,將切片浸入檸檬酸鈉抗原修復(fù)液中煮20 min,取出切片自然冷卻致室溫,用0.3%過氧化氫溶液阻斷內(nèi)源性過氧化物酶10 min,5%山羊血清封閉10 min,滴加TNF-α抗體(1∶100稀釋),4℃孵育過夜,清洗一抗后,二抗室溫孵育30 min,滴加DAB顯色液于光學(xué)顯微鏡(×20)下觀察,著色為棕色特異性區(qū)域既存在TNF-α表達(dá)。用Image J軟件統(tǒng)計(jì)TNF-α陽性面積百分比,值越高則炎性反應(yīng)程度越高。
1.5 結(jié)腸組織中BMP2、Smad同源物1(Smad 1)mRNA表達(dá)檢測(cè) 采用定量PCR法。小鼠結(jié)腸標(biāo)本保存于RNAlater溶液(廣州大匯生物技術(shù)有限公司)中。提取RNA,逆轉(zhuǎn)錄獲得互補(bǔ)cDNA。采用特異性引物,β-actin上游引物5'-CCACCATGTACCCAGGCATT-3',下游引物 5'-CGGACTCATCGTACTCCTGC-3';BMP2 上 游 引 物 5'-CTCCGGGCTATCATGCCTTT-3',下游引物 5'-ACAACATGGAGATTGCGCTG-3';Smad1 上游引物 5'-AATACTTCACTGAGGCGGGC-3',下 游 引 物 5'-CAGTGAGCACATCTGTCCGT-3'。反應(yīng)體系中PrimeScript酶液1.0μL、引物各1.0 μL、5×PrimerScript buffer2 4.0μL、無菌蒸餾水14μL、cDNA模板10μL。擴(kuò)增條件:95℃起始10 min,95℃ 10 s、60 ℃ 30 s共40個(gè)循環(huán)。以β-actin 為內(nèi)參基因,用 2-ΔΔCt法[11]計(jì)算目的基因相對(duì)表達(dá)量。每個(gè)樣本重復(fù)實(shí)驗(yàn)3次。
1.6 統(tǒng)計(jì)學(xué)方法 采用SPSS25.0統(tǒng)計(jì)軟件。計(jì)量資料用±s表示,多組間比較采用單因素方差分析,進(jìn)一步兩兩比較采用LSD-t檢驗(yàn)。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 PFD對(duì)小鼠排便的影響 與對(duì)照組比較,STC組第1顆黑色糞便排出時(shí)間長(zhǎng)、排便頻率低(P均<0.05)。1、10 mg/kg治療組第1顆黑色糞便排出時(shí)間、排便頻率與STC組比較差異無統(tǒng)計(jì)學(xué)意義(P均>0.05);與STC組及1.10 mg/kg治療組比較,100 mg/kg治療組第1顆黑色糞便排出時(shí)間短、排便頻率高(P均<0.05)。后續(xù)實(shí)驗(yàn)選擇100 mg/kg治療組進(jìn)行觀察。見表1。
表1 各組排便情況比較(±s)

表1 各組排便情況比較(±s)
注:與對(duì)照組比較,#P<0.05;與100 mg/kg治療組比較,*P<0.05。
組別對(duì)照組STC組1 mg/kg治療組10 mg/kg治療組100 mg/kg治療組n 10 10 10 10 10第1顆黑色糞便排出時(shí)間(min)83.3±13.4 196.7±63.8#*200.0±69.0*177.3±70.1*98.5± 4.5*排便頻率(次/小時(shí))8.43±1.73 2.68±1.33#3.18±1.21 3.22±1.23 5.66±1.82*糞便含水量(%)68.59±15.36 47.50± 9.35#49.22± 5.23 52.32± 6.32 60.88± 2.60*
2.2 PFD對(duì)小鼠一般情況的影響 與對(duì)照組比較,STC組體質(zhì)量低,攝食量、飲水量少(P均<0.05)。與STC組比較,100 mg/kg治療組體質(zhì)量高,攝食量、飲水量多(P均<0.05)。見表2。
表2 各組一般生理狀態(tài)比較(±s)

表2 各組一般生理狀態(tài)比較(±s)
注:與對(duì)照組比較,#P<0.05;與STC組比較,*P<0.05。
組別對(duì)照組STC組100 mg/kg治療組n 10 10 10體質(zhì)量(g)23.12±0.65 19.15±0.98#21.25±0.74*攝水量(mL)9.02±1.92 5.39±0.65#6.54±1.06*攝食量(g)4.13±1.12 1.99±0.61#2.98±0.55*
2.3 PFD對(duì)小鼠腸道組織形態(tài)的影響 對(duì)照組腸壁結(jié)構(gòu)完整,腸絨毛分布均勻,腸管壁較厚;STC組結(jié)腸腸壁組織較薄,肌層變薄明顯,可見少許炎癥細(xì)胞浸潤(rùn);100 mg/kg治療組治療1周后小腸腸壁明顯增厚,結(jié)腸腸黏膜發(fā)育良好,腸絨毛豐厚,排列緊密,炎癥細(xì)胞浸潤(rùn)減少,組織形態(tài)結(jié)構(gòu)正常,未見明顯組織病理損傷。對(duì)照組、STC組、100 mg/kg治療組TNF-α陽性面積百分比分別為(0.82±0.25)%、(10.12 ± 0.98)%、(3.12 ± 0.65)%,均在結(jié)腸肌層。與對(duì)照組比較,STC組TNF-α陽性面積百分比高(P<0.05);與STC組比較,100 mg/kg治療組TNF-α陽性面積百分比低(P<0.05)。STC組結(jié)腸肌間神經(jīng)分布稀疏,神經(jīng)纖維變細(xì),胞體減少;而100 mg/kg治療組神經(jīng)元的以上變化發(fā)生逆轉(zhuǎn)。
2.4 PFD對(duì)小鼠結(jié)腸組織中BMP2、Smad1 mRNA表達(dá)的影響 與對(duì)照組比較,STC組結(jié)腸組織中BMP2、Smad1 mRNA相對(duì)表達(dá)量高(P均<0.05);與STC組比較,100 mg/kg治療組結(jié)腸組織中BMP2、Smad1 mRNA相對(duì)表達(dá)量低(P均<0.05)。見表3。
表3 各組結(jié)腸組織中BMP2、Smad1 mRNA表達(dá)比較(±s)
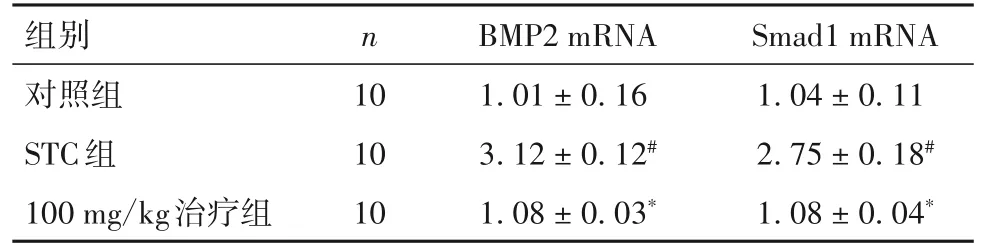
表3 各組結(jié)腸組織中BMP2、Smad1 mRNA表達(dá)比較(±s)
注:與對(duì)照組比較,#P<0.05;與STC組比較,*P<0.05。
組別對(duì)照組STC組100 mg/kg治療組n 10 10 10 BMP2 mRNA 1.01±0.16 3.12±0.12#1.08±0.03*Smad1 mRNA 1.04±0.11 2.75±0.18#1.08±0.04*
3 討論
STC是一種常見的功能性便秘,其特點(diǎn)是結(jié)腸運(yùn)動(dòng)緩慢,腸道傳輸時(shí)間延長(zhǎng),排便次數(shù)顯著減少甚至不排便,糞便干硬及水分減少。該病為慢性、復(fù)發(fā)率高,常影響患者的日常生活[12]。研究表明,結(jié)腸腫瘤、帕金森病、兒童相關(guān)多動(dòng)癥、自閉癥及慢性腎臟疾病均與便秘有關(guān)[2]。對(duì)慢性便秘特別是STC的研究在了解疾病的發(fā)生機(jī)制及治療中有重要作用。STC的正常治療包括飲食控制、運(yùn)動(dòng)、使用瀉藥等。越來越多的研究發(fā)現(xiàn),慢性便秘患者的結(jié)腸存在慢性炎癥反應(yīng)與氧化應(yīng)激損傷,抗炎抗氧化應(yīng)激治療也越來越多被應(yīng)用在便秘患者的治療中。PFD作為一種新的抗炎抗氧化應(yīng)激損傷的藥物,是否可以用來治療便秘,其作用方式及潛在的藥物靶點(diǎn)尚不清楚。本研究通過PFD治療洛哌丁胺誘導(dǎo)的STC小鼠,觀察便秘相關(guān)參數(shù)證明PFD對(duì)STC的治療作用。
通過PFD的臨床特點(diǎn)與羅馬Ⅳ診斷標(biāo)準(zhǔn),本研究設(shè)計(jì)了第1顆黑色糞便排出的時(shí)間來觀察腸道傳輸時(shí)間,以每小時(shí)糞便顆粒數(shù)作為排便頻率,并統(tǒng)計(jì)糞便含水量。在STC小鼠模型中,PFD可增加糞便含水量,減少第1顆黑色糞便排出時(shí)間,增加排便頻率,同時(shí)減少炎癥細(xì)胞浸潤(rùn),增加結(jié)腸肌層厚度,增強(qiáng)腸道動(dòng)力。BMP2-Smad1調(diào)節(jié)通路可以調(diào)節(jié)腸神經(jīng)元的發(fā)生與重塑,同時(shí)BMP2升高可增加腸道硝基能神經(jīng)元,從而增加抑制性神經(jīng)遞質(zhì)一氧化氮(NO)產(chǎn)生,NO抑制腸道收縮導(dǎo)致腸道傳輸功能異常。BMP2高表達(dá)會(huì)導(dǎo)致腸神經(jīng)元結(jié)構(gòu)與功能異常。本研究顯示,PFD可下調(diào)STC小鼠結(jié)腸BMP2、Smad1基因表達(dá),通過抑制BMP2-Smad1信號(hào)軸減少腸道神經(jīng)元的重塑,逆轉(zhuǎn)腸神經(jīng)結(jié)構(gòu)變化與腸道調(diào)節(jié)功能的失常。TNF-α是最常見的周圍炎癥反應(yīng)介質(zhì),其在慢性與急性炎癥反應(yīng)中水平均升高,在神經(jīng)性疾病中亦合成增加。STC小鼠模型結(jié)腸肌層組織中TNF-α與對(duì)照組相比明顯升高,且表達(dá)位置與腸道神經(jīng)元存在共定位。說明STC小鼠結(jié)腸肌層組織中的腸神經(jīng)元存在炎癥損傷,PFD可減少STC小鼠結(jié)腸肌層中的TNF-α表達(dá)來發(fā)揮抗炎與神經(jīng)保護(hù)作用。
隨著對(duì)PFD研究的深入,PFD在消化系統(tǒng)中的作用逐漸被發(fā)現(xiàn)。PFD可呈劑量依賴性抑制人類腸道纖維細(xì)胞的增殖和遷移,但不導(dǎo)致其死亡,從而有效抑制炎癥性腸病中腸纖維化的發(fā)生發(fā)展[13]。PFD可通過抑制氧化應(yīng)激、巨噬細(xì)胞的浸潤(rùn)和炎癥小體依賴性的NLRP3途徑誘導(dǎo)的炎癥,來減輕急性腎損傷[14]。PFD可抑制克隆恩病患者腸道源性成纖維細(xì)胞增殖和基質(zhì)金屬蛋白酶的產(chǎn)生,且呈劑量依賴性[15]。這些研究均從PFD對(duì)于腸道的免疫調(diào)節(jié)入手,通過體內(nèi)與體外實(shí)驗(yàn)證明了PFD的抑制腸道炎癥的作用。本研究不僅證明了PFD可以有效降低腸道炎癥反應(yīng),同時(shí)發(fā)現(xiàn)了PFD可以通過BMP2-SMAD1通路調(diào)節(jié)腸道神經(jīng)元的結(jié)構(gòu)與功能,具有神經(jīng)保護(hù)作用。由此可見PFD作為一個(gè)常規(guī)的抗肺纖維化藥物的同時(shí),可通過抗炎作用在多種急性慢性疾病中發(fā)揮作用。
本研究中PFD不僅能改善便秘,還能糾正洛哌丁胺誘導(dǎo)便秘導(dǎo)致的小鼠體質(zhì)量丟失與結(jié)腸組織病理的改變。盡管目前有很多植物提取物、多糖、小分子化合物、中草藥被用來研究對(duì)于便秘的改善作用,但是很少有藥物能在100 mg/kg的劑量下,單獨(dú)處理STC模型小鼠中驗(yàn)證其通便作用,PFD相較于其他通便藥物具有較低的起效濃度,并且未出現(xiàn)明顯的不良反應(yīng),安全性高。接下來的研究中,我們將進(jìn)一步探索PFD對(duì)腸道微生物及其代謝產(chǎn)物的調(diào)控作用。
綜上所述,本研究驗(yàn)證了PFD在STC的腸道運(yùn)動(dòng)中起重要的調(diào)節(jié)作用。其作用機(jī)制可能為PFD能夠通過調(diào)控BMP2-Smad1信號(hào)軸減輕腸神經(jīng)的損傷,抑制腸道炎癥反應(yīng),逆轉(zhuǎn)腸道微生物多樣性改變,從而直接或間接改善了便秘癥狀。

