人乳頭狀瘤病毒16相關口咽鱗狀細胞癌獨特生物學行為及治療的研究現狀
王岳 季一鳴 王曉毅 張凌楠 孫樂剛
1.濱州醫學院附屬醫院口腔頜面外科 濱州 256600;2.濱州醫學院口腔醫學院 煙臺 264010;3.口腔疾病研究國家重點實驗室 國家口腔疾病臨床醫學研究中心四川大學華西口腔醫院頭頸腫瘤外科 成都 610041;4.濱州醫學院附屬醫院口腔正畸科 濱州 256600
頭頸部鱗狀細胞癌(head and neck squamous cell carcinoma,HNSCC)在全部癌癥排名中位居第6,其中75%好發于口腔、口咽部及喉部[1]。人乳頭狀瘤病毒(human papilloma virus,HPV)是能感染人類皮膚、黏膜上皮細胞引起增殖性病變的DNA病毒[2]。至2014年,共發現118種不同核苷酸序列的HPV,對人類有感染能力者共40種,分為高危型 (16、18、31、33、35、45、51、52、55、58、59、68、73、82、83)和低危型(6、11等)兩大類[3-4]。HPV與口咽鱗狀細胞癌(oropharyngeal squamous cell carcinoma,OPSCC)聯系密切[5],其中90%以上的HPV相關OPSCC是由HPV16引起的[6]。2009年,國家癌癥研究綜合網(National Comprehensive Cancer Network, NCCN) 將HPV16作為OPSCC的除吸煙、飲酒外的又一獨立致病因素[7]。近些年的相關研究顯示:HPV16相關OPSCC具有獨特的臨床病理特征,如發病趨于年輕化,預后好,好發于扁桃體、舌根部等。因其治療方法不同于傳統OPSCC的治療方法,可通過研究HPV16相關OPSCC的治療方法、尋找潛在的治療靶點,為HPV相關惡性腫瘤患者的治療提供新的治療思路[8-10]。
1 HPV的致癌機制
HPV是一種小的、無包膜的雙鏈環狀DNA病毒,其基因主要由3 個部分組成:早期區域(E1~E7)、晚期區域(L1和L2)、基因調控區[3,11]。HPV相關OPSCC的發生主要是E2、E6和E7基因表達的改變引起的。HPV感染后,E2區與人基因組發生結合,引起其自身表達的下降。當E2低表達甚至不表達時,E6、E7致癌蛋白表達上升,引起組織的癌變[12]。基因的整合好發于細胞基因殘缺的部位,如不完整基因區域、容易發生堿基配對的區域。正是這樣的結合,引起了細胞基因表達的改變,使細胞本身過度繁殖甚至癌變。但基因整合通常不會改變所有的基因表達,即使缺失一個堿基對或者其發生替換,都不會引起原本表達的改變。從目前的研究來看,E6、E7致癌蛋白的表達仍是HPV相關OPSCC發病的主要原因[13]。p16是腫瘤細胞的抑制分子同時也是細胞周期調控分子,其產生的主要機制是E7基因表達下調pRb進而促進p16的表達。但像RB1等分子也可以通過類似途徑促進p16的表達,所以不是所有表達p16者都是HPV DNA陽性。p16能否作為HPV相關OPSCC良好預后的標志物成為目前的研究熱點[12-14]。p53是腫瘤抑制分子,在腫瘤中往往會出現變異,且其變異往往發生于吸煙相關的癌癥中。在HPV相關OPSCC中,HPV E6蛋白有一由氨基(N)-和羧基(C)-末端鋅結合域以及螺旋連接器構成的LxxLL袋狀結構,與細胞泛素連接酶E6AP中的LxxLL識別并結合,形成了E6/E6AP異二聚體,在LxxLL的作用下,E6基因表面形成了容納p53的裂,吸引p53與之結合,進而導致了p53表達的下降,但沒有改變p53基因的結構[15];同時,在HPV相關OPSCC中仍能檢測出野生型p53的存在[16]。Kimple等[17]發現:放射治療也可以重新激活HPV相關HNSCC中低表達的p53,提高腫瘤細胞對放射治療的敏感性(圖1)。
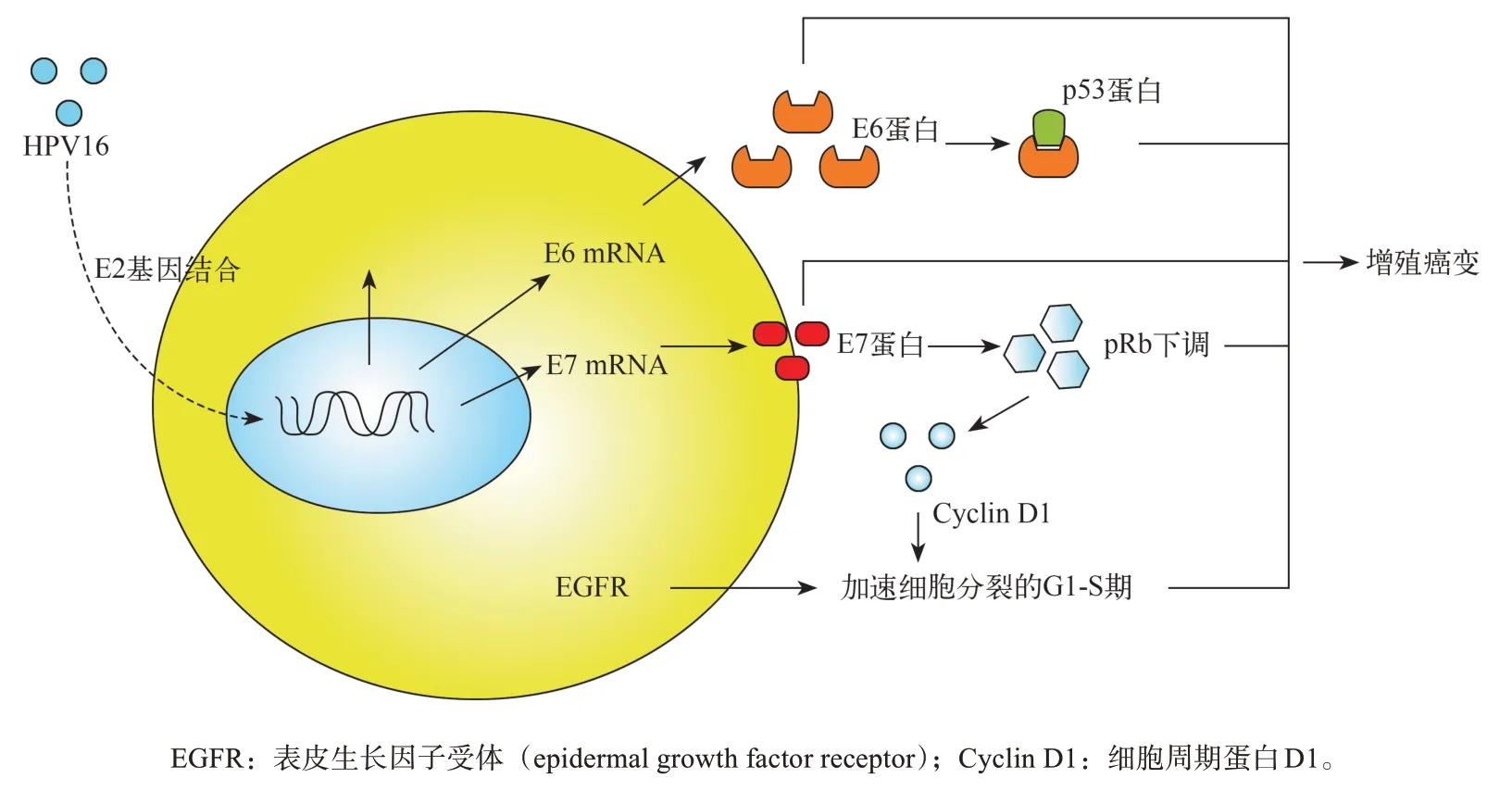
圖 1 HPV16的致癌機制Fig 1 Mechanism of HPV16 carcinogenesis
2 HPV16相關OPSCC獨特的臨床病理特征
OPSCC是指發生于舌根部、軟腭、扁桃體、咽后壁的鱗狀細胞癌[18]。Kreimer等[19]的研究發現:HNSCC患者HPV陽性率為26%,其中OPSCC HPV陽性率(35.6%)明顯高于口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC)患者(23.5%),HPV相關OPSCC約86.7%為HPV16感染。傳統OPSCC者多有飲酒、吸煙等習慣,腫瘤可發生于口咽部任何部位,早期可出現咽喉部疼痛、吞咽異物感、頸部淋巴結腫大等癥狀,其TNM分期可以處在任何時期[10]。根據場癌變的理論,甚至侵及周圍組織波及到頭頸部其他部位并引發癥狀[20]。HPV16相關OPSCC患者多傾向于年輕化,無吸煙、飲酒習慣。由于扁桃體及舌根部存在免疫功能的網狀上皮,HPV相關OPSCC多好發于此。其原發灶較小,早期可無明顯咽喉部癥狀,僅出現頸部淋巴結的囊性腫大[10,18,21]。組織病理學主要表現為基底樣鱗狀細胞癌,呈現突然的角化或是粉刺樣壞死[22]。頸部淋巴結的轉移分為外顯型和隱匿型2類,切除部分頸部淋巴結活組織,通過免疫組織化學等方法可確定是否發生淋巴結的轉移,進而制定治療計劃[23]。HPV相關OPSCC患者預后相對較好[23],Ragin等[9]通過Meta分析發現:HPV相關HNSCC患者的死亡風險與復發風險均低于HPV陰性者。特異性分析顯示:HPV相關OPSCC患者比HPV陰性者降低了28%。其可能的原因有p53未發生突變、p16蛋白的高表達、免疫系統處于活躍狀態(PD-1+T細胞的高表達)、EGFR低表達等(表1)[16]。缺氧誘導因子-1α(hypoxia induced factor-1 alpha,HIF-1α)是惡性腫瘤介導缺氧適應性反應的重要轉錄因子,OPSCC患者中HIF-1α高表達者預后相對較差[24]。本課題組研究發現:LncRNA PVT1通過miR-194-5p/HIF1α通路促進OSCC增殖和順鉑耐藥性[25],未來將研究HPV不同感染狀態下OSCC、OPSCC中HIF-1α及其下游蛋白的表達情況來獲得新的治療靶點。

表 1 HPV16不同感染狀態下OPSCC的臨床病理特征Tab 1 Clinicopathological characteristics of HPV16 in different infection states
3 HPV相關OPSCC的治療
3.1 手術治療
OPSCC的治療方法是以手術治療為主、放射和化學合并治療的綜合序列治療[26]。傳統手術治療采用的是開放式經頸/下頜骨入路的手術方式,嚴重影響患者的口腔功能及美容、美觀,降低了患者的生活質量[27]。口腔內窺鏡手術技術(transoral endoscopic surgery,TES)的誕生引起了眾多學者的關注,其主要包括口腔機器人手術技術(transoral robotic surgery,TORS)和口腔激光顯微外科技術 (transoral laser microsurgery,TLM)[28]。由于OPSCC的位置特殊、邊緣難以確定、視野受限、操作難度大,增加了手術的難度,加上大劑量放射和化學治療的應用,造成黏膜損傷、組織纖維化,增加了胃造口術的概率,極大降低了患者的生活質量。而TES的應用改變了這一現狀,應用TES可以更好地確定腫瘤邊界,精準地切除腫瘤,適當降低放射和化學治療的劑量。這不但能降低OPSCC的復發率,更能提高患者的生活質量[29-31]。Kumar等[32]的研究發現:HPV相關OPSCC患者通過開放入路術式患者的死亡率及胃造口術概率均是采用TORS的3倍以上。盡管TORS技術日趨成熟,但仍存在成本高、口腔內操作空間小、視野局限、對醫師專業素養要求高、醫師需接受專門的培訓等難點[28-29]。TLM在早期喉癌有著良好的應用,后逐漸發展到口咽部,是早期應用于OPSCC的微創技術。但相較于TORS,其學習周期相對較長且受到部位的限制,難以操作。目前,主要應用于下咽部病變的治療[33]。因此,臨床上廣泛應用TES還需要一定時間的普及和相關技術的進一步完善。
3.2 放射和化學治療
手術治療會破壞OPSCC患者器官的完整性,在OPSCC早期可選擇單純放射治療的方法。Palma等[34]發現:單純接受放射治療的患者在1年后的生活質量明顯高于采用TORS者;同時,應用放射和化學治療手段可以有效減少OPSCC的復發和轉移。2018年,NCCN在頭頸部鱗狀細胞癌的臨床實踐指南[35]顯示:單純放射治療可應用早期HPV+OPSCC(T1-2,N1淋巴結直徑≤3 cm及以下),或用于HPV相關OPSCC術后的輔助治療。目前的放射治療手段主要包括:常規分割放射治療、調強放射治療、調整分割放射治療、三維適形放射治療、斷層放射治療和圖像引導放射治療等[36]。根據美國臨床腫瘤學會(American Society of Clinical Oncology,ASCO)循證臨床實踐指南[37],OPSCC有局部復發傾向的T1-2 N1或T2 N0可以采用調整分割放射治療的手段。Nguyen-Tan等[38]對Ⅲ期OPSCC患者進行隨機臨床試驗發現:采用術后常規分割放射治療和加速分割放射治療的患者在8年生存率(48%∶48%,P=0.37)、疾病無進展生存率(42%∶41%,P=0.52)、局部區域失敗率(37%∶39%,P=0.78)的差異無統計學意義。總結來說,放射治療方式的選擇是受OPSCC患者TNM分期影響的。術后放射治療不會影響皮瓣的存活,但可能會增加術后皮瓣并發癥的風險。對于植入假體的患者,甚至影響到假體的存活[39]。而調強放射治療(intensity-modulated radiation therapy,IMRT)與三維適形放射治療(3-dimensional conformal radiation therapy,3D-CRT)可以高度集中于計劃靶區,降低對周圍組織的影響,具有在OPSCC的治療中減少口干等不良反應的特點,是目前NCCN推薦用于治療OPSCC的有效手段。當基于光子的治療無效時,也可以考慮質子治療的手段[35]。
化學治療主要用于晚期OPSCC患者治療前的誘導治療、治療后的輔助治療、無法手術者的直接治療。化學治療主要分為單一用藥療法、誘導化學治療、序貫治療以及同期放射和化學治療[35]。目前常用的藥物種類有鉑類藥物、紫杉醇類藥物、5-氟尿嘧啶、甲氨蝶呤、西妥昔單抗、卡培他濱等[35,40]。單一用藥療法效果較差,有效率僅為15%~30%,有研究指出術后的單純化療對HNSCC并沒有明顯意義[40-41]。2009年,Pignon等[42]收集了87項臨床試驗共16 485例患者,通過Meta分析后發現:同步放射和化學治療組的5年生存率比單純放射治療組高4.5%,治療前的誘導化學治療也沒有提高患者的總生存率。因此,目前最常用的還是同步放射和化學治療手段。比較常用的同步放射和化學治療手段有:1)順鉑化合物化學治療合并放射治療;2)卡鉑合并放射治療;3)西妥昔單抗合并放射治療。在不考慮HPV相關性的基礎上,采用順鉑化合物化學治療合并放射治療的方法預后相對較好,但其帶來的毒性也相對較大,因此,主要用于年輕、免疫力強的患者,年老者則極少采用[43]。HPV16相關OPSCC患者往往有良好的預后,因此,有學者[44]提出減少放射和化學治療劑量的觀點。但何時可降低該治療劑量的標準難以確定,仍需要大量實驗及研究的支持來制定更為精準的治療方案。
3.3 靶向治療
3.3.1 直接抑制的靶向治療 EGFR會引起腫瘤細胞的增殖、侵入和轉移。OPSCC患者中可發現EGFR的表達。其中,HPV陽性者EGFR表達相對較少,但在吸煙的情況下,仍發現EGFR的高表達[45-46]。臨床上,常用的EGFR抗體藥物有西妥昔單抗和尼妥珠單抗[47],利用西妥昔單抗代替順鉑化合物結合放射治療來治療OPSCC患者的方法目前已趨向成熟[45-46]。然而,在西妥昔單抗的治療中,治療抵抗是一個難以解決的問題,阿法替尼具有抵消西妥昔單抗先天和獲得性免疫的作用,但阿法替尼與西妥昔單抗之間是否有拮抗作用仍存在爭議[48]。尼妥珠單抗是人源性的抗體,與西妥昔單抗相比其毒性相對較低,不易作用于正常組織,不良反應相對較少[49]。Yuan等[50]對19項隨機對照研究中1 201例接受EGFR抗體藥物治療的鼻咽癌患者進行Meta分析,結果發現:西妥昔單抗組中鼻咽原發病灶的完全緩解率、總體緩解率要遠低于尼妥珠單抗組。
血管內皮生長因子(vascular endothelial growth factor,VEGF)是缺氧條件下腫瘤新生血管的關鍵因子[51]。抗血管生成藥物主要通過阻斷VEGFVEGFR通路來達到治療的結果。截止2015年,美國食品和藥物管理局(Food and Drug Administration,FDA)批準用于臨床的VEGF-VEGFR通路阻斷藥物有貝伐珠單抗、索拉非尼和舒尼替尼[52]。Fury等[53]對42例Ⅲ~Ⅳ期HNSCC患者(其中39例為OPSCC)行貝伐珠單抗聯合大劑量順鉑及調強放射治療,結果發現:2年總生存率為88%,2年疾病無進展率為75.9%,顯示了貝伐珠單抗針對OPSCC的可行性,但是未來還需完善相關的臨床試驗,促進貝伐珠單抗在OPSCC中的應用。
3.3.2 靶向介導的免疫治療 免疫治療是繼手術治療、放射和化學治療后又一廣泛應用于腫瘤治療的方法。程序性細胞死亡受體-1(programmed cell death protein 1,PD-1)是位于T細胞的抑制性受體,在與程序性細胞死亡配體-1(programmed cell death ligand 1,PD-L1)結合后,會抑制T細胞的功能與作用,促進腫瘤細胞的增殖、轉移等。而阻斷PD-1/PD-L1,恢復人體免疫功能,發揮T細胞的作用,則有利于疾病的治療。而HPV相關OPSCC患者,其PD-1+T細胞的表達遠遠高于陰性者,卻擁有良好的預后。有學者[54-57]提出:PD-1+T細胞的高表達正是免疫系統處在活躍狀態的表現。在惡性黑色素瘤中,外泌型PD-L1可與PD-1結合,造成CD8+T細胞的失活、凋亡。在患病早期,特別是干擾素γ的治療后,外泌型PD-L1會導致腫瘤微環境的改變,出現PD-1/PD-L1阻斷治療效果不佳的情況,因此,利用PD-1抑制劑及早阻斷PD-1/PD-L1通路利于患者的治療[58]。由此看出,PD-1/PD-L1分子只有在配對后,才會導致T細胞功能的下降,PD-1+T細胞與PD-L1分子之間的空間接觸作為OPSCC預后標志的觀點應運而生。假設交互作用分布(hypothesised interaction distribution,HID)方法可以量化腫瘤微環境中分子間的空間信息,從而反應免疫逃逸的情況及預測OPSCC的預后,但該方法仍需要大量實驗和臨床研究的支持[59]。阻斷PD-1的治療方法是目前免疫治療非常有效的方法,但有時卻會引起腫瘤的快速發展,稱為快速進展性疾病(hyperprogressive disease,HPD)。因此,在OPSCC免疫治療研究及應用中,需要研究者付出更多的努力來避免這一情況的發生[60]。有研究顯示:EGFR與腫瘤的免疫作用有一定的相關性,但其相關機制仍需深入的研究。HPV相關OPSCC患者采用放射和化學治療時,PD-1/PD-L1的表達會隨之上升。但PD-1、PD-L1、EGFR之間尚未發現明確的關系,深入研究EGFR和PD-1/PD-L1之間的相關性可以提供更多不同組合形式的治療方法[61]。
細胞毒T淋巴細胞抗原-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)是免疫反應的又一重要通路,CTLA-4與CD-28表達于調節性T細胞表面,競爭性與抗原提呈細胞表面的B7受體結合,其中CTLA-4為抑制性分子,其競爭力要遠遠大于CD-28,造成了T細胞表達的下降[62]。在HNSCC的患者中,其原發灶組織中CTLA-4的表達水平要遠遠高于外周血,說明腫瘤組織中的免疫抑制作用更強[63]。CTLA-4抑制劑可以有效阻斷這一通路,增強患者的免疫功能,從而達到治療的目的。FDA目前已將Ipilimumab(CTLA-4抑制劑)應用于惡性黑色素瘤的治療中,并且大量的實驗驗證了其在肺癌中的作用,但仍需大量的研究來證實Ipilimumab在HNSCC乃至OPSCC的有效性[64]。
3.4 疫苗的應用
HPV是宮頸癌的主要致病因素,HPV疫苗預防宮頸癌的治療方法已經應用于臨床[65]。HPV疫苗分為九價疫苗 (6、11、16、18、31、33、45、52、58)、四價疫苗(6、11、16、18)、二價疫苗(16、18),接種年齡建議為9~26歲,其中九價疫苗可預防96%的宮頸癌,四價與二價疫苗可預防70%的宮頸癌[66-68]。但仍未有有效的研究證明:HPV疫苗可預防其他與之相關的疾病,應用HPV疫苗預防HPV相關OPSCC成為目前的研究熱點之一。HPV疫苗是根據HPV衣殼蛋白L1構建的失活病毒空殼,可引起體內免疫反應產生抗體,進而起到預防的作用。Ahn等[69]的研究發現:HPV疫苗對于小鼠口咽部HPV16感染及相關OPSCC均有預防作用。然而,仍未有完善的實驗及分析證明HPV疫苗可以有效的預防HPV相關OPSCC。基于此 , Lehtinen 等[70]邀 請 了 38 631 名 出生 于 1995、1996年的志愿者進行分組試驗,并對完成3~6年隨訪的4 871名女性的口咽樣本進行統計學分析,結果發現:A-S04-HPV16/18疫苗對于HPV OPSCC的防治是有一定意義的,這推動了疫苗預防的完善和應用。考慮到HPV16這一治病因素的危害性,HPV16的早期診斷顯得格外重要。在HPV16相關OPSCC發病前數十年,HPV16 E6血清陽性實驗可作為檢測HPV致癌因子所致免疫反應的指標之一[71]。作為醫生,更應該承擔起向群眾普及HPV16相關口咽鱗狀細胞癌和疫苗預防知識的責任與義務,將預防作為疾病治療的第一道防線[72]。
4 總結與展望
總之,OPSCC的治療目前還是以手術治療為主,放射和化學治療為輔的綜合序列治療。目的旨在提高患者生存質量,減少其復發。HPV16相關OPSCC具有獨特的臨床病理特征,延伸出更為精確的治療方法,如較低毒性放射和化學治療手段、免疫治療、TES等。同時,HPV疫苗也可作為一種新型的預防HPV相關OPSCC的有效措施,但仍需大量的研究來確保其安全性及有效性。通過HPV16相關OPSCC機制的研究,推動了對HPV相關惡性腫瘤的研究進展。目前,尋找HPV相關OPSCC及其他惡性腫瘤新的治療靶點,降低患者治療的不良反應是尋找更為優良的治療方法的必經之路。
利益沖突聲明:作者聲明本文無利益沖突。

