大腸桿菌K88ac-ST1-LTB基因工程疫苗菌株培養條件的優化
許崇利,許崇波,佘玉罕
(1. 吉林化工學院生物與食品工程學院,吉林吉林132022;2. 重慶醫藥高等專科學校醫學技術學院,重慶401331;3. 韶關學院英東生物與農業學院,廣東韶關512005)
仔豬大腸桿菌性腹瀉是由產腸毒素性大腸桿菌(ETEC)引起的急性傳染病。大腸桿菌利用菌毛上的抗原(又稱為黏附素)與仔豬小腸上皮細胞上的受體結合,吸取腸道內的營養物質大量繁殖,并產生腸毒素而導致強烈的腹瀉。大腸桿菌(ETEC)的主要致病因子是黏附素和腸毒素[1-4]。目前,已從豬源大腸桿菌中發現K88(F4)、K99(F5)、987P(F6)、F18、F41、F42、F107 等多種菌毛[5-8]。腸毒素包含耐熱腸毒素(ST)和不耐熱腸毒素(LT)。ST1能夠使小腸絨毛上皮細胞內環磷酸鳥苷(cGMP)升高10倍,而且該毒素有組織特異性[9-11]。LT 由A 亞單位和B 亞單位組成,全LT 或B 亞單位均具有良好的免疫原性。LTA亞單位是大腸桿菌(ETEC)毒素的活性部位,LTB亞單位負責與GMl神經節苷脂糖蛋白受體結合,產生功能性細孔。LTA亞單位則由孔進入,激活胞漿內的腺苷酸環化酶(AC),環磷酸腺苷(cAMP)含量增加,引起腸道內環境改變,從而導致腹瀉[12-13]。
ECET腹瀉的藥物治療已經使菌株產生耐藥性。目前常使用疫苗免疫接種的方式來預防、控制新生仔豬的大腸桿菌性腹瀉。目前,應用的疫苗主要有K88-K99-987P、K88-LTB和K88-K99等基因工程亞單位疫苗[14-15]。本課題組構建重組菌株BL21(DE3)(pXK88acST1LTB)[16-17]。該重組菌株在保留K88ac 和LTB原有抗原性的基礎上,使原本不具有抗原性的ST1被賦予抗原性,并喪失ST1腸毒素的活性;并采用控制不同單因素變量的方法,探索K88ac-ST1-LTB三價基因工程疫苗菌株最適的培養方法,確定最佳培養條件,并進行滅活試驗,從而為ETEC疫苗的成功研制和生產提供參考。
1 材料與方法
1.1 試驗菌株
基因工程菌株BL21(DE3)(pXK88acST1LTB)由許崇波等[15]構建。
1.2 試驗試劑
肉湯培養基:20.0 g 蛋白胨、5.0 g 牛肉粉、5.0 g 氯化鈉,加蒸餾水定容到1 000 mL,調pH值至7.5。
LB 培養基:5.0 g 酵母粉、10.0 g 氯化鈉、10.0 g 胰蛋白胨,加蒸餾水定容到1 000 mL。
改良LB培養基:5.0 g酵母粉、8.0 g胰蛋白胨、5.0 g牛肉膏、5.0 g NaCl,加蒸餾水定容到1 000 mL。制備好的3 種培養基需要分別添加一定量的消泡劑。2 mol/L 氫氧化鈉調pH值至7.4~7.6,高壓滅菌20 min。
IPTG、聚丙烯酰胺等購自南京海克爾生物科技有限公司;胰蛋白胨、酵母粉購自上海新睿生物科技有限公司;牛肉膏、葡萄糖、氯化鈉、氫氧化鈉購自赫澎(上海)生物科技有限公司。
1.3 菌株最佳培養條件試驗
1.3.1 最佳培養基的篩選
將制備的LB、改良LB 和普通肉湯培養基分別添加至發酵罐,每罐10 萬mL,2%比例接種大腸桿菌菌株的種子液,37 ℃通氣培養6 h 后,加入葡萄糖溶液至終濃度0.2%,繼續培養16 h 進行活菌計數。每種培養基重復進行3 次試驗,記錄每種培養基的菌數,并計算平均值(CFU/mL)。
1.3.2 最佳誘導劑的篩選
4個發酵罐分別加入改良LB培養基,每罐為10萬mL,按照2%比例接種菌株的種子液,37 ℃通氣培養4~6 h后,加入終濃度為0.2%葡萄糖補充碳源,繼續培養4 h 后,每罐分別加入終濃度為1.0 mmol/L的IPTG、1.0 mmol/L的乳糖、10.0 mmol/L的乳糖、100.0 mmol/L的乳糖進行誘導,誘導4 h,每罐取1 mL菌液進行SDS-PAGE分析并檢測目的蛋白表達量。
1.3.3 乳糖最佳誘導條件的篩選
按照2%比例接種種子液于發酵罐中,37 ℃培養4~6 h,加入終濃度為0.2%葡萄糖補充碳源,繼續通氣培養4 h,加入終濃度為100 mmol/L乳糖誘導6 h,期間每隔1 h取1 mL菌液進行活菌計數,同時SDS-PAGE 檢測目的蛋白表達量。
1.3.4 最佳通氣量培養條件的篩選
按照2% 比例分別接種大腸桿菌BL21(DE3)(pXK88acST1LTB)菌株的種子液至3 個發酵罐,每罐10 萬 mL,3 個罐的通氣量分別為 50、100、500 L/min。37 ℃培養6 h 后,加入終濃度0.2%的葡萄糖補充碳源,繼續培養4 h,加入終濃度為100 mmol/L 的乳糖誘導6 h,取1 mL 菌液進行活菌計數,同時SDS-PAGE 檢測目的蛋白表達量。試驗重復3次。
1.4 滅活試驗
取3 罐菌數在1.15×1010~1.23×1010CFU/mL 的大腸桿菌菌液,每罐分成9份,共27份。將27份菌液隨機分成3 組,每組 9 份。將 9 份菌液分為 3 組,每組 3 份,每組分別加入終濃度為0.4%、0.6%和0.8%的甲醛溶液37 ℃滅活。滅活時間分別為12、24、48 h。滅活的過程中,需要振搖菌液數次,以保證菌液的徹底滅活。
2 結果與分析
2.1 不同培養基對菌株生長的影響(見表1)
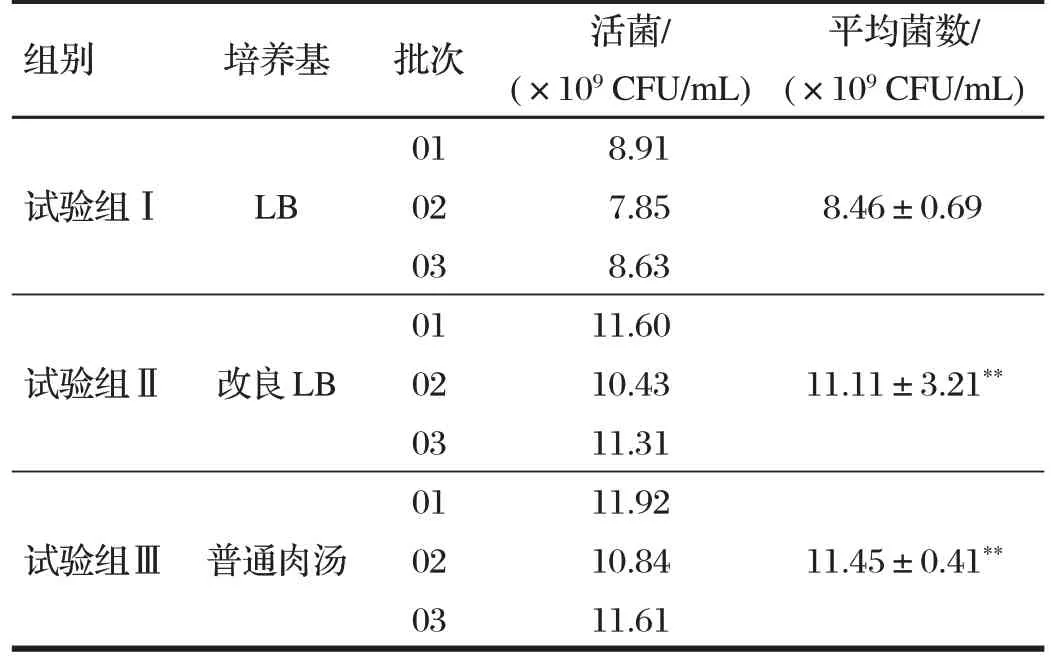
表1 不同培養基對菌株生長的影響Tab.1 The influence of different media on the growth of strains
由表1可知,配置的3種培養基對細菌生長影響較大,其中改良LB 培養基、普通肉湯培養基的細菌數目極顯著高于LB培養基(P<0.01)。從菌株培養環境的穩定性和降低工業化生產成本角度來說,改良LB 培養基是最適宜培養基。
2.2 不同誘導劑對菌株生長的影響(見圖1、表2)
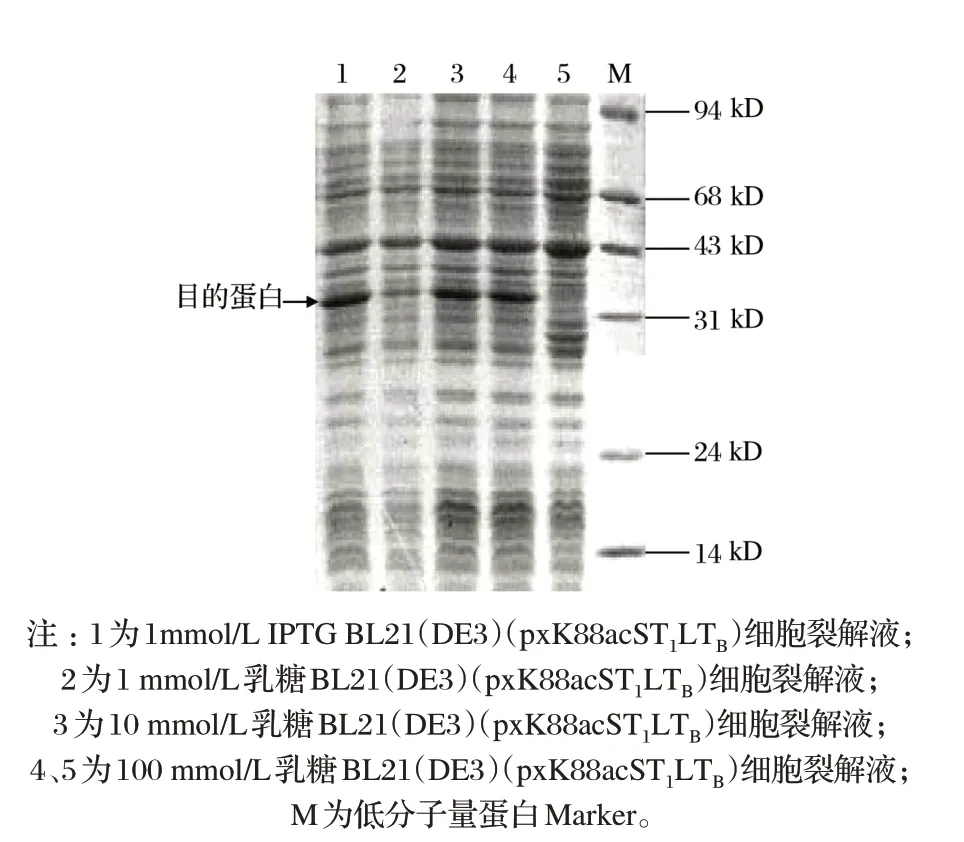
圖1 IPTG與乳糖誘導的試驗結果Fig.1 The induced test results of IPTG and lactose

表2 不同誘導劑對菌株生長的影響Tab.2 The effect of different inducers on the growth of strains
由圖1、表2 可知,分別使用IPTG 和乳糖進行誘導表達,100 mmol/L 乳糖和1 mmol/L IPTG 誘導效果最較好,GDS-8000 凝膠成像分析系統軟件分析表明,二者表達量分別為29.43%和33.24%,考慮生產成本,宜選用乳糖作為誘導劑。
2.3 乳糖不同誘導時間對菌株生長的影響(見表3、圖2)
由表3、圖2 可知,隨著誘導時間的增加,pH 值先降低后升高,總菌數和蛋白表達量也在相應增多。當誘導時間為6 h時,蛋白表達達到最大值。GDS-8000凝膠成像分析系統軟件分析表明,蛋白表達量為30.02%。

表3 乳糖不同誘導時間對菌株生長的影響Tab.3 The effect of different induction time of lactose on the growth of strains
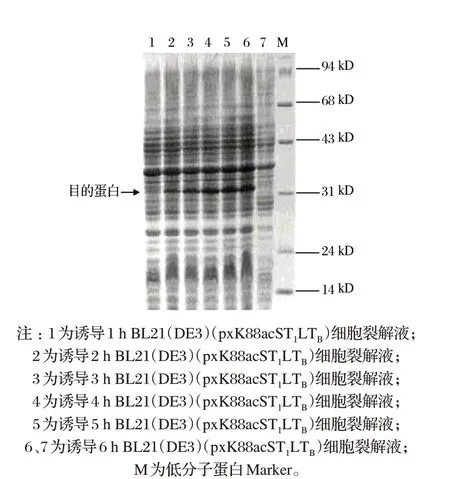
圖2 不同誘導時間對目的蛋白表達的影響Fig.2 Effects of different induced time on the expression of the target protein
2.4 通氣量對菌株生長的影響(見表4)
由表 4 可知,采用改良LB 培養基(10 萬mL)對BL21(DE3)(pXK88acST1LTB)菌株通氣培養。其中以500 L/min的通氣培養條件培養的菌數最高,3 種通氣量對目的蛋白的表達量無明顯差異。
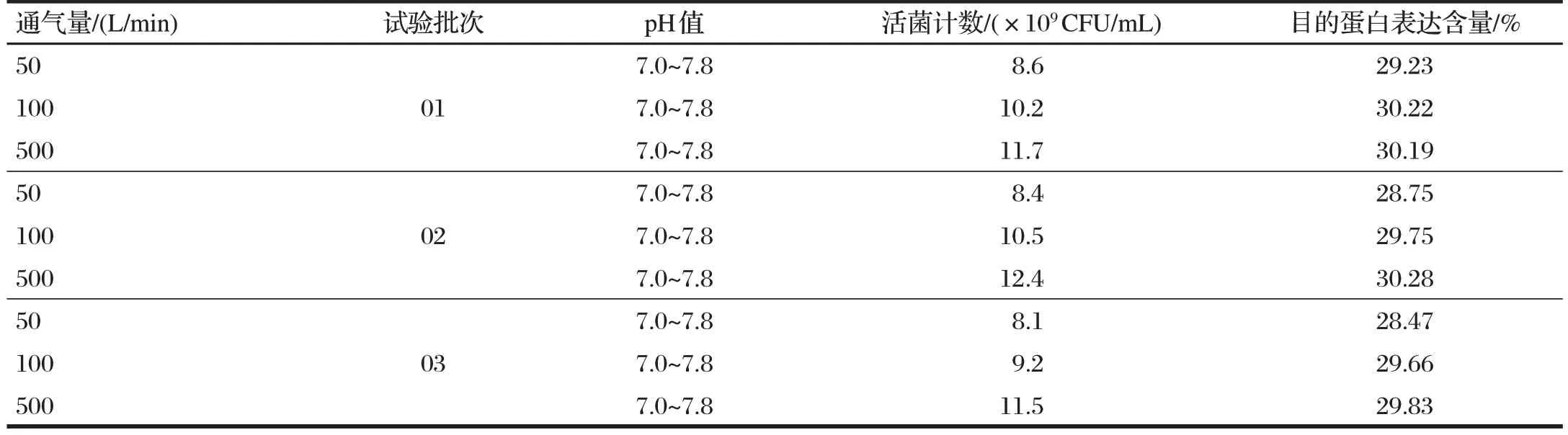
表4 通氣量對菌株生長的影響Tab.4 The effect of ventilation on the growth of strains
2.5 菌株滅活試驗結果(見表5)
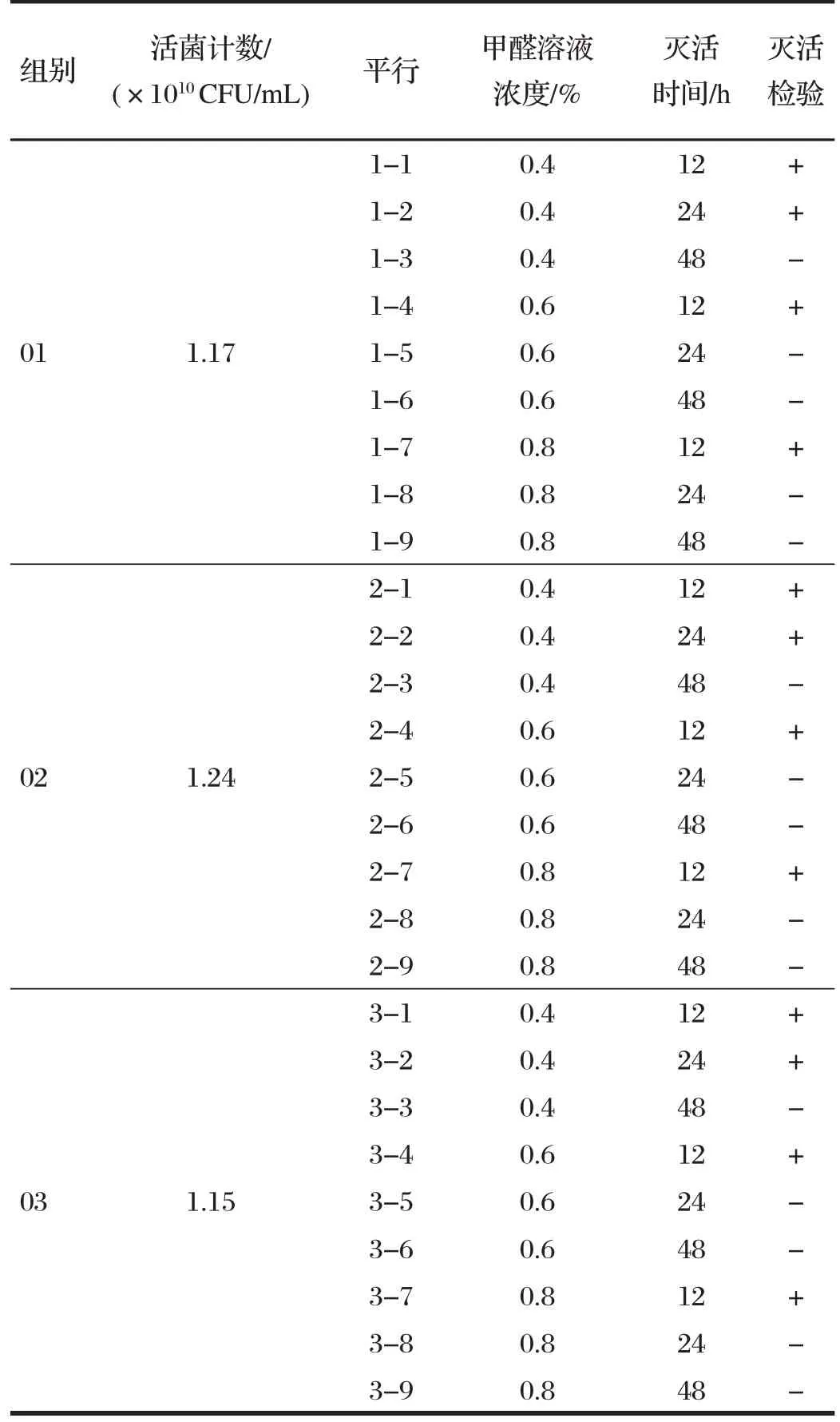
表5 菌株滅活試驗結果Tab.5 Strain inactivation test results
選取3 種不同濃度(0.4%、0.6%、0.8%)的甲醛溶液加入培養好的菌液中滅活。由表5 可知,滅活培養菌數在1.15×1010~1.24×1010CFU/mL 之間的菌液以0.4%甲醛溶液(按菌液終濃度計算)滅活48 h,可以達到很好的滅活效果。
3 討論
本研究中,關于工業化生產中誘導劑的篩選試驗是在培養基配制好的20 萬mL 的發酵罐中進行的。該菌株37 ℃培養4~6 h 后,發酵罐內加入葡萄糖溶液(終濃度0.2%)用以補充碳源,繼續培養菌株4 h。選取等量的菌液分別添加4 種不同濃度的誘導劑(1.0 mmol/LIPTG、1.0 mmol/L 乳糖、10.0 mmol/L 乳糖和 100.0 mmol/L 乳糖)對菌株展開誘導,使目的蛋白大量表達。在誘導4 h 后每種濃度各提取1 mL菌液,在低溫(4 ℃)條件下,5 000 r/min離心 5 min,使用 100 μL 10 mmol/L Tris·Cl(pH 值 8.0)重懸菌體沉淀。依據所收集的試驗材料使用常規的操作方法進行SDS-PAGE試驗分析,得到的目的蛋白表達含量依次為33.21%、8.27%、26.39%、29.44%。根據研究資料,生產與檢驗所培養的菌種使用的培養容器等條件不同,于37 ℃溫度下進行搖床,振蕩培養2 h后,使用IPTG(終濃度為1.0 mmol/L)誘導4 h 后,可收獲所需的菌液,吸取1 mL菌液,4 ℃、5 000 r/min 離心5 min,使用100 μL 10 mmol/L Tris·C(lpH 值8.0)重懸菌體使其沉淀,并按照常規的方法步驟進行SDS-PAGE試驗分析。試驗結果表明,所獲得的目的蛋白表達量在40%左右。
上述2次試驗中,同是IPTG作為誘導劑的情況下蛋白的表達量卻相差較大。原因可能是2次誘導蛋白的容器不同,培養的體系差別較大,補料條件不同,通氣條件有差別,加入誘導劑時的菌液濃度有差別,因此導致2種情況下蛋白的表達量差別較大。
根據試驗數據分析,改良LB 中的培養菌數比LB 的高,比普通肉湯的低一點。改良LB批次之間差異小,能夠保持疫苗的免疫原性和質量穩定的優點,且其生產成本比普通肉湯低50%以上。在工業化生產中選用改良LB培養基具有更大的經濟效益。對于誘導劑來說,乳糖的加入濃度為100 mmol/L 且誘導時間在6 h 以上,目的蛋白的表達量較多。重組菌株中蛋白的表達,運用的是乳糖操縱子的原理(乳糖操縱子會轉錄表達β-半乳糖苷酶)。使用乳糖作為誘導劑,誘導的效果好且價格比IPTG低,更加適合于工業化的大量生產。在大腸桿菌培養時通入無菌空氣維持罐內的氧溶解度,可促進其大量繁殖。本試驗用10萬mL發酵罐展開培養,在相同的培養條件下對3種不同通氣量進行比較。在不影響蛋白相對表達量的情況下,培養菌數最高是500 L/min的通氣量。由于本次試驗所用菌株其質粒之中所含有的生物公害——卡那霉素抗性基因,所以在使用時必須滅活。試驗數據分析表明,終濃度0.4%的甲醛溶液在37 ℃下,攪動、滅活48 h效果最佳。
4 結論
本研究在成功地構建BL21(DE3)(pXK88acST1LTB)重組表達菌株基礎上,從培養基的選取、通氣量的多少、誘導劑的選擇以及其對應的誘導條件(誘導時間及濃度)4個方面對其培養條件進行研究。結果表明,改良的LB 培養基為培養該菌株的最適宜培養基,100 mmol/L乳糖誘導6 h,可實現經濟效益最大化,同時確定在20萬mL發酵罐中培養重組菌株的最適宜通氣量為500 L/min。滅活試驗結果表明,37℃0.4%甲醛滅活48 h,滅活效果徹底。
本研究探索K88ac-ST1-LTB三價基因工程疫苗菌株最適的培養方法,確定最佳培養條件并進行滅活試驗,從而為ETEC疫苗的成功研制和生產奠定基礎。

