超聲造影鑒別診斷涎腺腺樣囊性癌與多形性腺瘤的應用價值
彭柳清,羅渝昆,李 楠,李秋洋,費 翔,梁舒媛
解放軍總醫院第一醫學中心 超聲診斷科,北京 100853
涎腺腺樣囊性癌(adenoid cystic carcinoma,ACC)是涎腺較常見的惡性腫瘤,主要累及腮腺,次為頜下腺,以“羊皮狼”為特征,其生長緩慢,形狀和特點與良性多形性腺瘤(plemorphic adenoma,PA)相似,但浸潤性強且血行轉移率高[1-3]。超聲檢查是涎腺腫瘤術前常用的檢查方法,但部分涎腺ACC惡性征象不明顯,容易誤診為PA,兩種腫瘤的治療方案及遠期預后迥異[4]。因此,術前明確腫瘤的性質對選擇合適治療方案及預后判斷非常關鍵。目前超聲造影技術可為涎腺良惡性腫瘤鑒別診斷提供有價值的信息[5-6]。本研究回顧性分析涎腺ACC和PA的常規超聲特征、超聲造影增強特征和時間強度曲線(time intensity curve,TIC)參數,以期為涎腺ACC和PA的鑒別診斷提供參考。
資料與方法
1資料 本研究收集2018年1月-2019年12月因頜面部腫塊就診于解放軍總醫院第一醫學中心口腔外科,后經病理證實的ACC及PA患者。所有患者術前進行常規超聲和超聲造影檢查,檢查前均簽署超聲造影知情同意書。
2超聲造影檢查 儀器采用Mindray Resone7彩色多普勒超聲診斷儀,探頭型號為L11-3(頻率3~11MHz)。造影劑使用聲諾維(sonovue)加入5mL0.9%氯化鈉注射液稀釋配制,使用前充分震動混勻。患者平臥位,頭部向健側微轉,充分暴露檢查區域。先行常規超聲檢查,記錄病灶大小、形態、邊界、內部回聲及彩色多普勒(color Doppler flow imaging,CDFI)情況。CDFI采用Adler0~Ⅲ級的分級方法。選擇病灶血流最豐富切面(同時包括部分正常腺體組織),固定探頭,再切換至超聲造影模式,機械指數設定為0.08。經肘部淺靜脈采用團注法推注2.5mL造影劑,隨后推入5mL0.9%氯化鈉注射液,推注造影劑同時打開計時器,連續采集120s動態圖像并保存。為避免因推注時間不同引起的造影參數差異,推注藥物和0.9%氯化鈉注射液的時間均在3s內完成。
3圖像分析 逐幀回放超聲造影動態圖像。分析指標:1)增強時間:快進(早于周圍正常組織增強),慢進(晚于或同步于周圍正常組織增強)。2)增強方式:向心性增強(自病灶周邊向中心增強),非向心性增強(彌漫性或離心性增強)。3)增強均勻程度:均勻,不均勻增強(包括灌注缺損)。4)增強后邊界:清晰,不清晰。5)增強強度(與周圍正常組織增強程度對比):高增強、等增強、低增強。6)增強環(病灶周邊高亮度的環狀增強):無、有(連續、不連續)。7)增強后病灶范圍:有或無擴大。運行儀器自帶定量分析軟件,避開灌注缺損區、鈣化灶及大血管,選取病灶明顯增強區域為感興趣區(region of interest,ROI),盡量使ROI面積相同,繪制TIC曲線,獲取如下參數:達峰時間(time to peak,TTP)、峰值強度(peak intensity,PI)、峰值強度減半時間(DT/2)。
4診斷方法 常規超聲以聲像圖特征進行診斷,機器自動設置以病灶邊界、形態、內部回聲和CDFI特征等多個聲像圖特征參數進行聯合判斷。超聲造影特征聯合應用:以設備默認的聯合輸出結果,結合臨床專業人員的實踐經驗進行聯合診斷。圖像結果的判讀由兩名主治醫師進行分析得出,若兩者判讀存在不同,由副主任醫師以上級別的醫師會診得出結果。
5統計學分析 采用SPSS20.0軟件進行統計學分析。計量資料以?表示資料以例數(百分比)表示,組間計量資料比較采用t檢驗,計數資料采用Fisher’s精確概率檢驗。診斷價值分析采用ROC曲線。P<0.05為差異有統計學意義。
結 果
1患者一般資料 共納入11例ACC及24例PA患者。ACC組病灶部位為腮腺7例,頜下腺4例,年齡22~68(48.6±14.2)歲,病灶最大徑1.4~5.1(2.8±1.0)cm;PA組病灶部位為腮腺12例,頜下腺12例,年齡21~81(47.2±18.2)歲,病灶最大徑1.0~3.8(2.3±0.9)cm。
2常規超聲聲像圖特征結果比較 涎腺ACC和PA多表現為邊界清晰、形態不規則、內部回聲不均勻,以Ⅰ~Ⅱ級血流為主。涎腺ACC和PA聲像圖特征見表1、圖1A、圖1B。

表1 涎腺ACC和PA患者聲像圖特征比較(n,%)Tab. 1 Comparison of sonographic features between salivary gland ACC and PA patients (n,%)
3超聲造影診斷比較 涎腺ACC和PA均可表現為高增強或低增強,多表現為向心性、不均勻增強伴灌注缺損區且無增強環。涎腺ACC患者中9例(81.8%)增強時間為快進且增強后邊界不清,8例(72.7%)增強后病灶范圍擴大,5例(45.4%)存在異常血管結構,PA患者中僅2例(8.3%)快進、6例(25.0%)增強后邊界不清、2例(8.3%)增強后病灶范圍擴大,1例(4.2%)存在異常血管結構,兩組增強時間、增強后病灶邊界、增強后病灶范圍及異常血管結構比較結果見表2、圖1C、圖1D。
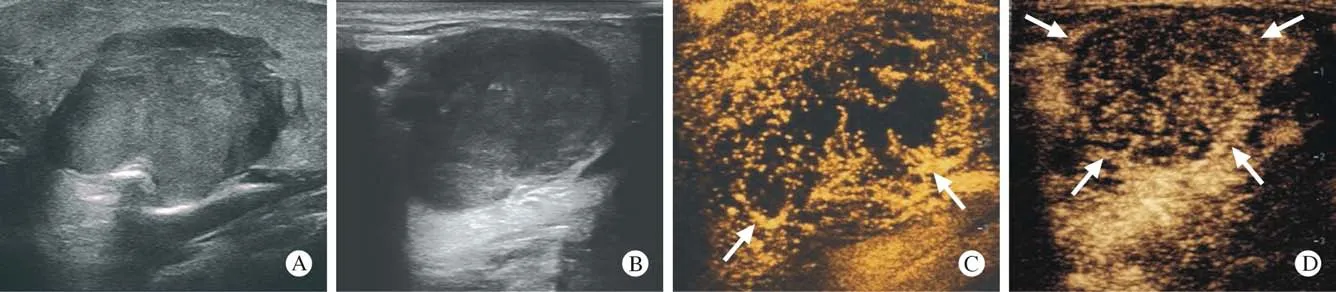
圖1 腮腺內ACC和PA的常規超聲和超聲造影圖像A:腮腺內ACC常規超聲圖像;B:腮腺內PA常規超聲圖像;C:腮腺內ACC超聲造影達峰時表現,局部邊界不清,箭頭所示病灶邊緣異常血管結構;D:腮腺內PA超聲造影達峰時表現,箭頭所示病灶邊界清楚Fig.1 Conventional ultrasound and contrast-enhanced ultrasound images of ACC and PA in the parotid glandA: Routine ultrasound image of ACC in the parotid gland; B: Routine ultrasound image of PA in the parotid gland; C: The peak of ACC ultrasound contrast in the parotid gland, the local boundaries are unclear, abnormal vascular structure at the edge of the lesion is shown by the arrow; D: Peak performance of PA ultrasound in parotid glands, the border of the lesion shown by the arrow is clear
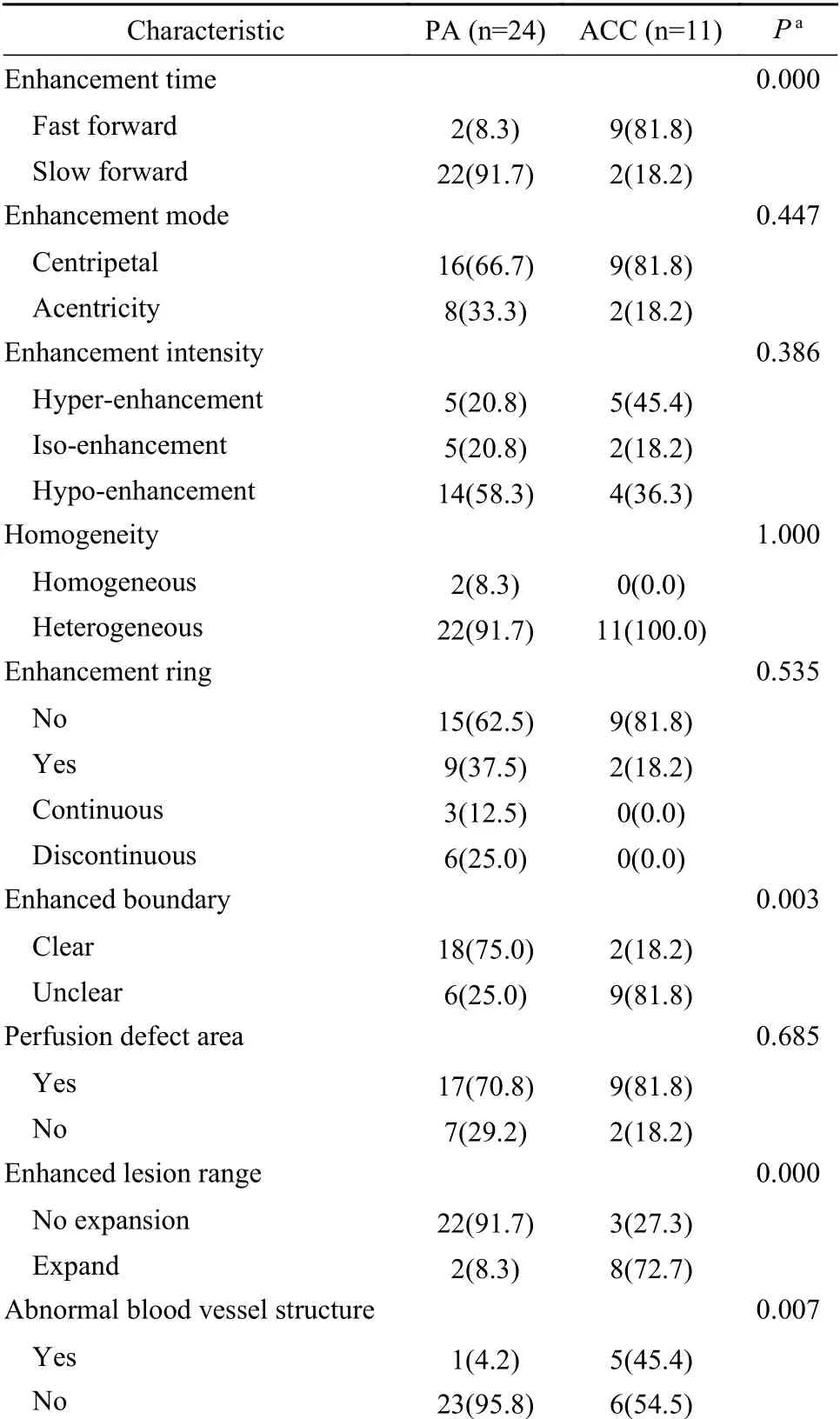
表2 涎腺ACC和PA超聲造影結果比較(n,%)Tab. 2 Contrast-enhanced ultrasound of ACC and PA in salivary glands (n,%)
4超聲造影參數比較 涎腺ACC的TTP為(9.97±0.68)s,短于PA的(11.77±2.41) s (P<0.05);其DT/2(35.62±4.93) s明顯高于PA的(23.68±7.58)s(P<0.05)。兩組PI差異無統計學意義(P>0.05)。見表3。

表3 涎腺ACC和PA超聲造影參數對比Tab. 3 Comparison of ACC and PA ultrasound contrast parameters of salivary glands
5兩種方法的診斷性能比較及ROC曲線分析1)常規超聲:11例ACC樣本中,9例被正確發現(確診涎腺ACC),即敏感度為0.818;24例PA樣本中,17例被正確發現(排除涎腺ACC),特異性為0.708;全部35例樣本中,被正確診斷的病例數為26例,準確度為0.743(26/35)。對應的ROC分析曲線見圖2。2)超聲造影特征聯合應用:聯合應用增強時間、增強邊界及增強后病灶范圍診斷涎腺ACC的敏感度、特異性及準確度分別為0.909(10/11)、0.833(20/24)、0.857(30/35),對應的ROC分析曲線見圖2。

圖2 常規超聲及超聲造影鑒別涎腺腺樣囊性癌與多形性腺瘤的ROC曲線Fig.2 ROC curves of conventional ultrasound and CEUS in differential diagnosis of ACC and PA
討 論
涎腺腫瘤分類煩雜,以上皮細胞性良性腫瘤多見,其中80%為PA(又稱混合瘤),占涎腺腫瘤的65%[7]。涎腺ACC約占涎腺腫瘤的14.5%,惡性涎腺腫瘤的40%,是發病率較高的惡性腫瘤,早期臨床表現類似PA,隨著疾病的漸進性發展,易發生局部浸潤、侵入血管,造成血運轉移[8-10]。文獻報道80% ACC術前針吸細胞學檢查誤診為PA[11]。因此,提高ACC超聲診斷的準確率,對早期發現ACC、減少誤診有一定的幫助。
常規超聲檢查主要依靠邊界、形態、內部回聲及血流豐富程度等鑒別診斷涎腺良惡性腫瘤[12],但對涎腺ACC的診斷特征存在爭議[13-14]。本研究中大部分ACC邊界清晰(72.7%)、Ⅰ~Ⅱ級血流(54.5%),具有部分良性腫瘤的特征。大部分PA形態不規則(75%)、內部回聲不均勻(75%)。故常規超聲鑒別診斷ACC與PA存在一定困難。PA由上皮組織、黏液樣或軟骨樣間質混雜組成,呈膨脹性生長,腫瘤長入周圍腺體內或穿破包膜形成瘤結節[15-16]。ACC病理組織分為管狀型(無實性成分)、篩狀型(實性成分<30%)及實性型。管狀型腫瘤形態較規則,較少出現浸潤及轉移。篩孔和實體型腫瘤形態不規則,易出現周圍浸潤和轉移[17]。另有研究表明ACC彩色多普勒顯示率僅為33.3%,血流信號少量或中等[14],與本研究相符。
超聲造影技術可以增強病變血管對比度,TIC曲線能顯示腫瘤血管內的造影劑強度隨時間的變化,通過評估腫瘤內微血管的豐富程度、血流動力學特征及灌注模式,可為腫瘤性質的判定提供新的信息[18-19]。本研究中涎腺ACC和PA均以不均勻性增強伴灌注缺損為主,均可表現為低增強或高增強。PA組織學表現多樣性,故增強多不均勻,上皮組織豐富者多為高增強,黏液樣、軟骨樣及透明樣間質豐富者多為低增強[15]。ACC管狀型、篩孔型及實體型細胞密度和微血管密度(microvessel density,MVD)計數依次增加,惡性程度逐漸增高,腫瘤細胞可形成腺樣或囊狀結構,間質可見黏液及玻璃樣變性。同時瘤內組織纖維化、壞死程度不同、血管局部豐富程度不一,影響造影劑灌注[9,17,20-21]。故增強不均勻、增強強度不一。但周玲燕等[13]的報道中涎腺ACC均為高增強,可能與病例選擇偏倚以及判斷增強強度方法不同有關(本研究采用TIC定量分析法)。
本研究中涎腺ACC與PA的增強邊界、增強后病灶范圍差異明顯,可作為鑒別診斷的依據。病理研究顯示PA包膜情況不定,腫瘤與周圍組織界限清楚,涎腺ACC與周圍組織分界清,無包膜,但呈浸潤性生長,破壞正常組織血管網,故增強后邊界不清、范圍擴大[22]。蔣麗萍等[6]認為涎腺腫瘤以非向心性增強為主,向心性增強是PA特征性超聲造影表現。茍加梅等[5]則持相反觀點。本研究中9例(81.8%)涎腺ACC、16例(66.7%)PA呈向心性增強,與后者相符。研究結果不一致可能因為前者病例中惡性腫瘤組未納入ACC。腫瘤邊緣區血管較密集,而中央區血管較稀疏可能是形成向心性增強的原因。茍加梅等[5]研究結果顯示,涎腺大部分良性腫瘤有完整的增強環(腫瘤膨脹性生長壓迫周圍組織形成假包膜或自身包膜),可與惡性腫瘤鑒別。但本研究中僅9例(37.5%)PA有環狀增強(3例連續,6例不連續)。筆者考慮有以下原因:1)部分PA體積大,包膜受壓變薄或消失;2)部分PA(以上皮樣成分為主型)易出現包膜浸潤或不完整[16];3)部分PA無包膜(以黏液性為主型多見),與周圍正常組織分界不清[22]。本研究中6例PA邊界不清晰,常規病理均提示無包膜;4)部分病灶位于淺葉或囊變區較大,受側邊聲影、后方回聲增強及近場無法聚焦等因素影響不利于病灶邊界的觀察。故需繼續充實樣本進一步研究。本研究發現涎腺ACC與PA增強時間差異較大,分別表現為快進(81.8%)、慢進(91.7%),與相關報道一致[13,23]。惡性腫瘤受血管因子的誘導,大量新生血管形成,血管分布雜亂、形成動-靜脈瘺,故造影劑進入快。聯合應用增強時間、增強邊界及增強后病灶范圍鑒別診斷涎腺ACC與PA的敏感度、特異性及準確度為90.9%、83.3%、85.7%,但ACC超聲造影特征仍缺乏對不同惡性腫瘤的特異性,需與其他惡性腫瘤鑒別。
楊嘉嘉等[24]發現腫瘤邊緣有1條向內部走行的條狀血流(Ⅱ級血流),認為此征象對提示ACC可能有一定作用。本研究有類似的發現,5例ACC增強后病灶邊緣有1條或以上增粗并向內部走行的血管結構,推測自病灶邊緣穿入的異常血管結構對診斷ACC可能有一定幫助。這可能與該腫瘤易侵入血管的生長特性有關,ACC新生血管網非常豐富,微血管密度常位于浸潤的前緣,形態呈芽狀、細索狀甚至球狀血管叢[21]。
采用繪制超聲造影TIC曲線定量分析法比較發現ACC的TTP短于PA[(9.97±0.68) s、(11.77±2.41) s]、DT/2長于PA[(35.62±4.93) s、(23.68±7.58) s](P<0.05),與Zheng等[25]報道涎腺ACC的MRI動態增強TIC表現為典型的上升-平臺型,即對比劑流入快、流出較慢,PA表現為持續上升型相似。
綜上所述,CEUS增強特征和TIC曲線定量分析在鑒別不具有典型常規超聲特征的涎腺ACC與PA時可以提供有價值的診斷信息,從而提升超聲鑒別診斷的準確率,有利于術前選擇合適的治療方案,具有一定的臨床應用價值。

