骨碎補總黃酮對大鼠骨髓間充質干細胞倍增反應和分化的作用機制實驗
王軍松,李 佳,劉桂奇
解放軍總醫院第一醫學中心 骨科,北京 100853
隨著年齡增長,人體內各器官功能逐漸退化,骨量也逐漸減少,最終引起骨質疏松。目前骨質疏松性骨折(osteoporotic fracture,OPF)已成為危害老年人健康的常見疾病,有流行病學研究調查顯示,2006年我國有將近7 000萬人患有OPF,年齡大多在50歲以上[1]。OPF患者成骨能力差,骨折愈合難以達到理想狀態,部分患者甚至因骨折愈合延遲而死亡,所以尋找能有效改善骨質疏松、促進骨愈合的藥物十分必要[2-3]。骨碎補作為傳統中藥,是蕨類植物槲蕨的干燥根莖,有補腎強固、消風祛斑的功效[4]。骨碎補總黃酮(total flavonoids of rhizome drynariae,TFRD)是骨碎補的主要活性成分,近年來許多研究表明TFRD可有效提高骨質疏松癥患者骨密度,促進OPF患者骨愈合,但其作用的具體分子機制尚不完全明確[5-6]。Wnt/β-catenin信號通路在骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)分化為成骨細胞的過程中起重要作用[7]。本研究對BMSCs細胞進行TFRD干預,并觀察TFRD對BMSCs細胞Wnt/β-catenin信號通路中相關蛋白表達的影響,初步探討TFRD促進OPF患者骨愈合的作用機制。
材料與方法
1實驗動物 SPF級SD大鼠10只,均為6月齡,平均體質量(92.14±8.53) g,購自中國科學院上海實驗動物中心。
2主要儀器與試劑 倒置顯微鏡(Olympus公司,日本),酶標儀(Thermo公司,美國),CO2培養箱(上海力康發展有限公司),實時熒光定量PCR檢測儀(ABI公司),流式細胞儀(BD FACSVERSE公司,美國),微量紫外可見光分光光度計(北京凱奧科技發展有限公司),凝膠成像儀(Bio-Rad公司,美國)。強骨膠囊 (北京岐黃醫藥股份有限公司,批號:20030007,規格:0.25 g;其有效成分為骨碎補總黃酮),胎牛血清(Hy-Clone公司),LDMEM培養基(Gibco公司),胰酶(Sigma公司),Trizol試劑(天根生化有限公司),反轉錄試劑盒(Takara公司),β-catenin、RunX2、PPARG一抗以及GAPDH一抗(優寧維生物科技有限公司),二抗(碧云天生物技術研究所)。
3BMSCs的培養和鑒定 10只SD大鼠處死后,將兩側股骨取出,采用DMEM培養液沖洗骨髓腔,調整骨髓腔沖洗液細胞密度至2×107/mL,然后接種于培養皿進行培養。24 h后更換培養基,后每2 d更換1次培養基。待細胞融合80%~90%時,采用胰酶消化傳代,并繼續培養。采用細胞流式法對第三代(P3)細胞表面抗原(CD29、CD44和CD45)的表達進行檢測。
4實驗分組 在含青鏈霉素、10%胎牛血清的LG-DMEM培養基中加入不同濃度的TFRD藥物,根據TFRD濃度的不同分為低濃度組(TFRD 0.1mg/L)、中濃度組(TFRD1.0mg/L)、高濃度組(TFRD 10.0mg/L)。
5CCK8法檢測細胞增殖 調整BMSCs細胞密度至1×104/孔,接種于已加入上述3個濃度的TFRD培養基和不含TFRD培養基的96孔板中,每組設置3個重復孔,在培養箱中分別培養3 d、5 d、7 d、9 d后取出96孔板,每孔加入CCK8試劑10μL,繼續培養4 h后終止培養。采用酶標儀檢測490nm波長下各孔吸光度值。
6成骨分化鑒定 將P3代BMSCs細胞濃度調整至5×104/孔后,接種于6孔板,每組設置3個重復孔,每3 d換液1次,持續培養21 d后取出6孔板,經95%乙醇固定后采用0.2%茜素紅染色。在顯微鏡下隨機選取10個視野觀察礦化結節情況并計數,以平均數形式表示。
7mRNA檢測 P3代BMSCs細胞培養至21 d后,采用Trizol試劑提取細胞總RNA,根據逆轉錄試劑盒說明書步驟進行逆轉錄,采用實時熒光PCR將獲取到的cDNA進行擴增,計算各組2-ΔΔCT值,內參基因為β-actin。實時熒光PCR擴增條件:95℃5min,56℃30s,72℃40s,76℃ 2 s,共42個循環。各檢測基因引物序列見表1。
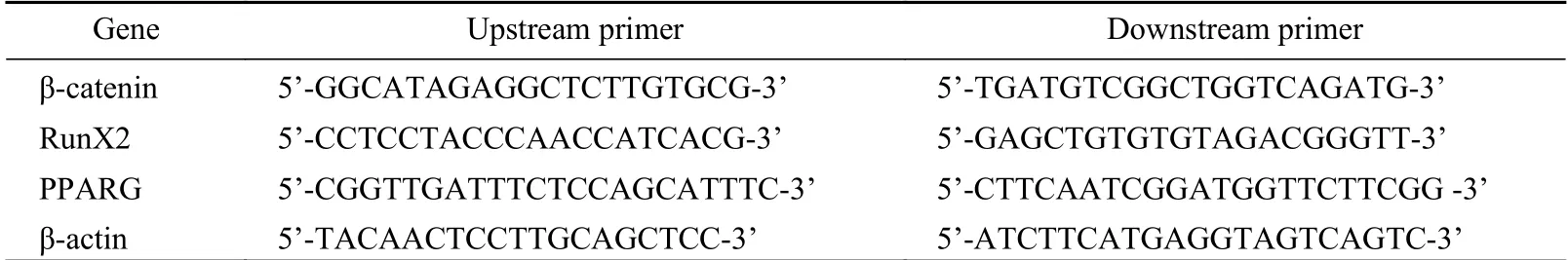
表1 各基因引物序列Tab. 1 Primer sequence of each gene
8Western blot法檢測Wnt/β-catenin信號通路相關蛋白表達 提取BMSCs總蛋白后,采用BCA法進行Wnt/β-catenin信號通路相關蛋白定量。制作SDS-PAGE凝膠,每孔加入BMSCs總蛋白樣品30μL進行電泳,電泳完畢后轉膜,在常溫下封閉2 h,加入一抗,低溫孵育過夜,膜洗凈后,加入二抗常溫孵育1 h,膜洗凈后在暗室滴加顯影液顯影并拍照,采用Quantityone軟件分析條帶灰度。
9數據分析 將數據錄入Excel,應用SPSS20.0軟件對數據進行統計分析。所有符合正態分布的計量資料以表示。依時間變化計量資料比較采用雙因素重復測量方差分析,組間兩兩精細比較行LSD-t檢驗,時間兩兩精細比較行差值t檢驗。P<0.05為差異有統計學意義。
結 果
1BMSCs形態觀察及鑒定 BMSCs接種培養24 h后貼壁生長,數量少,呈短紡錘狀。3 d后,細胞數量增多,體積變大,呈多角形或梭形。7 d后,細胞開始相互融合。10d后,80%~90%細胞呈融合狀態。傳代接種12 h內細胞貼壁,呈紡錘形,5 d后密度達到80%以上(圖1A)。P3代BMSCs細胞經流式細胞儀檢測,CD29、CD44和CD45陽性細胞比例分別為78.56%、85.48%和1.29%(圖1B)。

圖1 大鼠BMSCs細胞形態和表面抗原鑒定A:5 d后P1細胞形態圖(100×);B:流式細胞術檢測P3細胞表面抗原Fig.1 Cell morphology and surface antigen identification of BMSCs in ratsA: Cell morphological image after 5 days of P1 (100×); B: Cell surface antigen of P3 by flow cytometry
2不同濃度TFRD對BMSCs增殖的影響 通過雙因素重復測量方差分析顯示,培養時間(P<0.01)和TFRD濃度(P<0.01)對BMSCs增殖均有顯著影響,而二者之間無交互作用(P=0.27)。不同濃度的TFRD分組之間兩兩比較顯示,中濃度組與高濃度組之間無統計學差異(P=0.31),其他各組之間均有統計學差異(P<0.01)。見圖2。

圖2 不同濃度TFRD對BMSCs增殖的影響(aP<0.01, vs對照組;bP<0.01, vs低濃度組)Fig.2 Effects of different concentrations of TFRD on proliferation of BMSCs (aP<0.01, vs control group; bP<0.01, vs low concentration group)
3不同濃度TFRD對BMSCs成骨分化的影響各組P3代細胞培養21 d后進行茜素紅染色,低濃度組、中濃度組、高濃度組均可見邊界清晰的橘紅色礦化結節,對照組礦化結節則較少(圖3)。統計各組礦化結節數,結果顯示對照組(6.48±1.13)個、低濃度組(12.25±1.18)個、中濃度組(15.94±2.26)個、高濃度組(13.44±1.51)個,中濃度組礦化結節數高于其他三組(P<0.05)。

圖3 BMSCs細胞誘導成骨分化后茜素紅染色結果Fig.3 Induction of alizarin red staining after osteogenic differentiation of BMSCs cells
4TFRD對BMSCs中β-catenin、RunX2、PPARG表達的影響 中濃度組與對照組比較,β-catenin和RunX2表達明顯升高,PPARG表達明顯降低(P<0.05)。見表2,圖4。
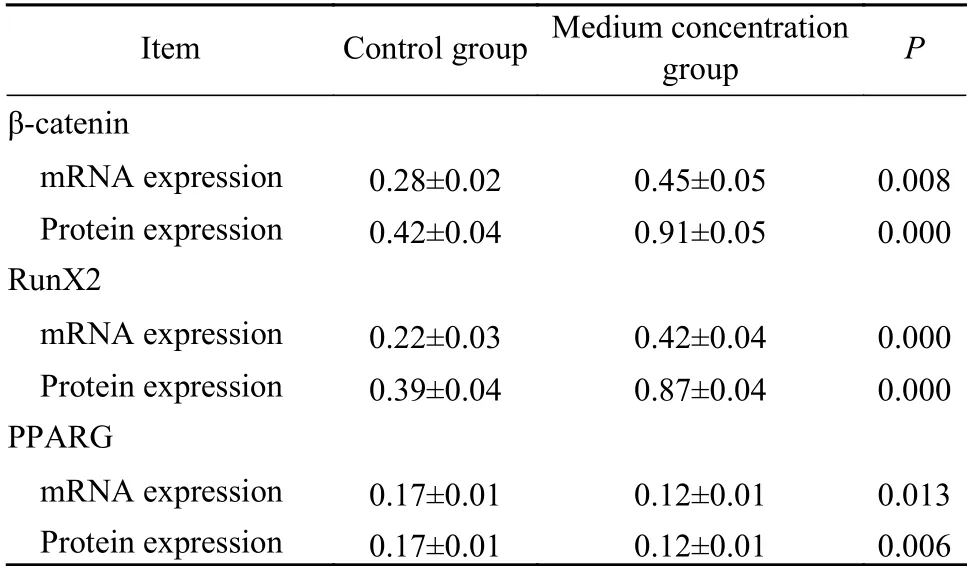
表2 TFRD對BMSCs中β-catenin、RunX2、PPARG表達的影響Tab. 2 Effect of TFRD on expression of β-catenin, RunX2 and PPARG in BMSCs
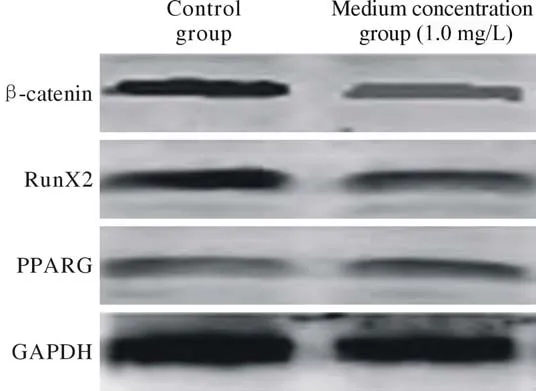
圖4 兩組BMSCs中各蛋白Western blot檢測Fig.4 Western blot results of each protein in BMSCs of the control group and the medium concentration group
討 論
祖國醫學認為腎精的盛衰是決定骨生長發育的關鍵,腎精不足,則不能榮髓,髓不榮則不能生骨,故骨質疏松應以補腎壯骨為治療原則[8]。骨碎補屬于補腎壯骨類中藥,其主要有效成分為TFRD,TFRD是一類二氫黃酮類化合物。現代藥理研究顯示,骨碎補能夠有效促進骨的形成,在防治骨質疏松方面效果明顯,特別是其有效活性成分總黃酮已成為研究熱點[9]。臨床實驗證實,TFRD可提高老年骨質疏松患者血清骨鈣素水平以及骨密度[10]。另有研究發現,TFRD可促進BMSCs細胞增殖,并影響成骨分化[11]。BMSCs是具有自我復制、多向分化能力的干細胞,在體外特定條件下可向成骨細胞、軟骨細胞、脂肪細胞等細胞系定向分化。BMSCs成骨細胞分化能力降低、成脂分化能力增強與骨質疏松癥的發生有關,而多種信號通路參與了BMSCs成骨細胞或成脂分化過程[12-14]。Wnt/β-catenin信號通路是BMSCs成骨細胞分化調控的經典路徑,該通路調控機制如下:Wnt蛋白與LRP5/6和Frizzled受體結合后,激活細胞內散落蛋白,進而激活GSK-3β結合蛋白,而后者通過影響β-catenin的磷酸化以阻止其降解,使β-catenin在細胞質內不斷增多,進入細胞核調控靶基因的轉錄與表達[15-16]。由此可見,β-catenin是Wnt/β-catenin信號通路的樞紐蛋白,在細胞增殖分化中扮演重要角色,其表達上調使BMSCs成骨細胞分化能力增強。RUNX2是成骨分化特異性轉錄因子,通過增強Ⅰ型膠原、骨鈣素、骨橋蛋白等基因轉錄,達到促進成骨分化的目的[17]。PPARG是BMSCs成脂分化過程的關鍵因子,其通過促進骨細胞轉化為脂肪細胞,使骨髓脂肪增多,骨形成減少[18]。
本研究采用CCK8法檢測TFRD對SD大鼠BMSCs細胞增殖的影響,結果顯示低濃度組、中濃度組、高濃度組在不同時間點吸光度值均明顯高于對照組,提示TFRD可促進BMSCs細胞增殖。而中、高濃度組與低濃度組之間吸光度值也存在明顯差異,而中、高濃度之間差異不明顯,說明TFRD對BMSCs增殖作用存在一定的對數關系,在濃度較低時,隨著TFRD濃度升高,對大鼠BMSCs增殖的促進作用會更強,當TFRD濃度達到一定濃度后,這種促增殖作用不會隨濃度增加而增加。TFRD的這種作用在3 d和5 d時增殖最快,在7 d和9 d時增殖速度減慢。原因可能是細胞生長到一定密度后,生長空間受限,影響了其增殖。P3代細胞培養21 d后經茜素紅染色,結果顯示低濃度組、中濃度組、高濃度組礦化結節數明顯多于對照組,且中濃度組礦化結節數最多。提示TFRD可促進BMSCs細胞成骨分化,且當TFRD濃度為1.0mg/L時,BMSCs細胞成骨分化能力最強,所以選擇中濃度組進行后續研究。收集培養了21 d的P3代BMSCs細胞,經RT-PCR和Western blot分別檢測細胞內β-catenin、RunX2、PPARG mRNA和蛋白表達,結果顯示中濃度組β-catenin、RunX2 mRNA表達明顯高于對照組,PPARG mRNA表達明顯低于對照組,蛋白表達情況與mRNA表達情況一致。以上說明TFRD可激活Wnt/β-catenin通路,通過上調βcatenin、RunX2表達,抑制PPARG表達,減少成脂分化,促進成骨分化。
綜上所述,TFRD促進OPF患者骨愈合的機制可能與上調β-catenin、RunX2表達,抑制PPARG表達有關。當然除了Wnt/β-catenin通路外,還有許多信號通路參與了BMSCs的成骨分化,TFRD是否可調節其他信號通路,還需進一步探索。

