黃芪對體外培養的新生大鼠大腦皮層神經細胞缺氧性凋亡的保護機理研究
謝耀錕 曹金城 周錦魁
腦梗死和腦出血都存在缺氧和缺血的病理過程,隨著研究的深入,發現該過程中還存在細胞凋亡[1]。研究顯示[2],腦動脈硬化導致的腦組織細胞缺氧和缺血是因細胞凋亡引起,所以凋亡在其中扮演重要角色。研究顯示[3],黃芪提取物可有效抗缺氧神經細胞凋亡,本研究就分析中藥黃芪在對抗神經細胞缺氧性凋亡中的作用機理,皆在為指導臨床使用黃芪治療腦梗死和腦出血等提供理論依據,現報告如下。
1 資料與方法
1.1材料 清潔級SD 大鼠(南京君科生物工程有限公司,貨號:J001)10 只;氮氣/二氧化碳(N2/CO2)空氣混合器、缺氧罐(廣州市旭朗機械設備有限公司,型號:PE-180F);抗兔IgG 二抗SABC 試劑盒(上海群已生物科技有限公司,貨號:PAB10816);Bax 多克隆抗體(艾美捷科技有限公司,貨號:PAB27023);D-Hank’s液(北京百奧萊博科技有限公司,貨號:BL0817);兔抗大鼠Bcl(北京百奧萊博科技有限公司,產品編號:YT684);Neurobasal 培養液(賽默飛世爾科技有限公司,貨號:21103-049);黃芪注射液(神威藥業集團有限公司,批號:0011024);B27Neurobasal 培養液(上海意杰生物科技有限公司,批號:N014B);多聚甲醛(PA)(武漢賽維爾生物科技有限公司);光學顯微鏡(上海普赫光電科技有限公司,型號:E100);熒光顯微鏡(上海光學儀器廠,型號:XSP-BM13C);新生牛血清(北京索萊寶科技有限公司,貨號:S9040);馬血清(上海北諾生物有限公司型號:Hyclone SH30074.03)。
1.2方法
1.2.1大腦皮層神經細胞原代無血清培養 取出大鼠大腦,置于含有氯化鈉 6.25 mmol/L 的D-Hank’s 液中,軟腦膜剝除,將皮層分離,洗3 次。皮層組織剪為1~2 mm3小塊,置于D-Hank’s 液中(溫度37℃,含0.125%胰蛋白酶),水浴25 min 后加入10%新生牛血清將反應終止,1000 r/min 離心3 min,去除上清液,再加入含6.25 mmol/L 氯化鈉的5 ml 10%馬血清打散,放置5 min 后取細胞懸液置于第2 支離心管,重復1 次上述步驟。10%馬血清清洗細胞2 次,接種于24 孔培養板(5×105/ml),各孔0.4 ml,置于37 ℃,5%的CO2飽和濕度培養4 h。再換為含氯化鈉 6.25 mmol/L 的2%B27Neurobasal 培養液,各孔0.3 ml,后續每3 天換液1 次。
1.2.2大腦皮層神經細胞缺氧復氧培養 神經細胞培養4 d 后置入厭氧罐,通入95%的N2和5%CO2混合氣體,1500 ml/min,30 min 后將厭氧罐夾閉。將厭氧罐置入37℃培養箱中培養,再取出24 孔培養板,置于5%的CO2,于37℃培養箱進行復氧培養。
1.2.3臺盼藍染色細胞直接計數法 24 孔培養板缺氧復氧培養后,1∶9 比例加入0.4%臺盼藍,將其濃度降為0.04%,染色1 min,將蓋玻片反蓋于載玻片,于光學顯微鏡下記錄活細胞和死細胞數,隨機計數>200 個細胞,計算存活率。
1.2.4神經細胞Hoeehst33342 染色 神經細胞加入Hoeehst33342 10 μg/ml,37℃環境下孵育30 min,加入1%的PA 固定10 min,然后用封液將蓋玻片封于載玻片,使用熒光顯微鏡觀看。
1.2.5神經細胞Bax 和Bcl-2 免疫組化染色 神經細胞去除培養液,使用磷酸緩沖鹽溶液0.01 mol/L 沖洗1 次,4%多聚甲醛固定液固定20 min,磷酸緩沖鹽溶液沖洗3 次,5 min/次。0.1% Triton-X100 PRS 作用15 min,磷酸緩沖鹽溶液沖洗3 次,0.3%過氧化氫處理20 min,磷酸緩沖鹽溶液沖洗3 次,加入10%小牛血清磷酸緩沖鹽溶液封閉。加入抗Bax 或抗Bcl-2,4℃濕盒過夜,次日使用磷酸緩沖鹽溶液沖洗3 次,10 min/次,加入抗兔IgG 二抗SABC,37℃下靜置45 min,磷酸緩沖鹽溶液沖洗3 次。加入A、B 試劑,37℃下靜置45 min,磷酸緩沖鹽溶液沖洗3次,給予3,3'-二氨基聯苯胺(DAB)顯色將反應終止,磷酸緩沖鹽溶液沖洗3次,最后封片。
1.2.6實驗分組 ①黃芪注射液組:缺氧培養前分別加入黃芪生藥量10、50、100 mg/ml 作為黃芪注射液1 組、2 組、3 組;Hoeehst33342 染色中,黃芪注射液2 組再加1 組作為第4 組,缺氧培養12 h 后加入黃芪注射液50 mg/ml。②腦源性神經營養因子組:缺氧培養前加入腦源性神經營養因子50 ng/ml;Hoeehst33342染色中,再加1 組作為第2 組,缺氧培養12 h 后加入腦源性神經營養因子50 ng/ml。③凋亡陽性組:缺氧復氧下培養。④正常對照組:5%的CO2,于37℃飽和濕度下培養。
1.3統計學方法 采用SPSS20.0 統計學軟件處理數據。計量資料以均數±標準差()表示,采用t檢驗;計數資料以率(%)表示,采用χ2檢驗。P<0.05 表示差異有統計學意義。
2 結果
2.1不同缺氧時間對培養大腦皮層神經細胞存活率的影響比較 神經細胞培養4 d 后置入厭氧罐,分別缺氧6、12、24 h,均復氧48 h,結果顯示,各組細胞存活率呈持續下降趨勢,正常對照組>缺氧6 h 組>缺氧12 h 組>缺氧24 h 組,差異有統計學意義(t=4.9775、14.2281、69.7896,P<0.05)。見表1。
表1 不同缺氧時間對培養大腦皮層神經細胞存活率的影響比較()

表1 不同缺氧時間對培養大腦皮層神經細胞存活率的影響比較()
注:與正常對照組比較,aP<0.05
2.2黃芪缺氧誘導大腦皮層神經細胞凋亡的Hoeehst33342 染色結果 神經細胞培養4 d 后缺氧12 h再復氧48 h,進行Hoeehst33342 染色,黃芪注射液1、2、3 組的細胞凋亡率呈持續降低趨勢,細胞凋亡率黃芪注射液1 組>黃芪注射液2 組>黃芪注射液3 組,差異有統計學意義(t=3.9112、13.5405,P<0.05);黃芪注射液4 組的細胞凋亡率高于黃芪注射液2 組,差異有統計學意義(t=10.3122,P<0.05)。見表2。
表2 黃芪缺氧誘導大腦皮層神經細胞凋亡的Hoeehst33342 染色結果比較()

表2 黃芪缺氧誘導大腦皮層神經細胞凋亡的Hoeehst33342 染色結果比較()
注:與凋亡陽性組比較,aP<0.05
2.3黃芪對缺氧誘導大腦皮層神經細胞凋亡調控基因蛋白的影響 神經細胞培養4 d后缺氧12 h再復氧48 h,各組Bax 和Bcl-2 蛋白表達:黃芪注射液1、2、3 組Bax 蛋白表達隨著黃芪注射液的增加而降低,Bcl-2 蛋白表達隨著黃芪注射液的增加而增加;黃芪注射液1 組Bax 表達高于黃芪注射液3 組,Bcl-2 蛋白表達低于黃芪注射液3 組,差異有統計學意義(t=5.2528、3.5631,P<0.05)。見表3。
表3 黃芪對缺氧誘導大腦皮層神經細胞凋亡調控基因蛋白的影響比較()
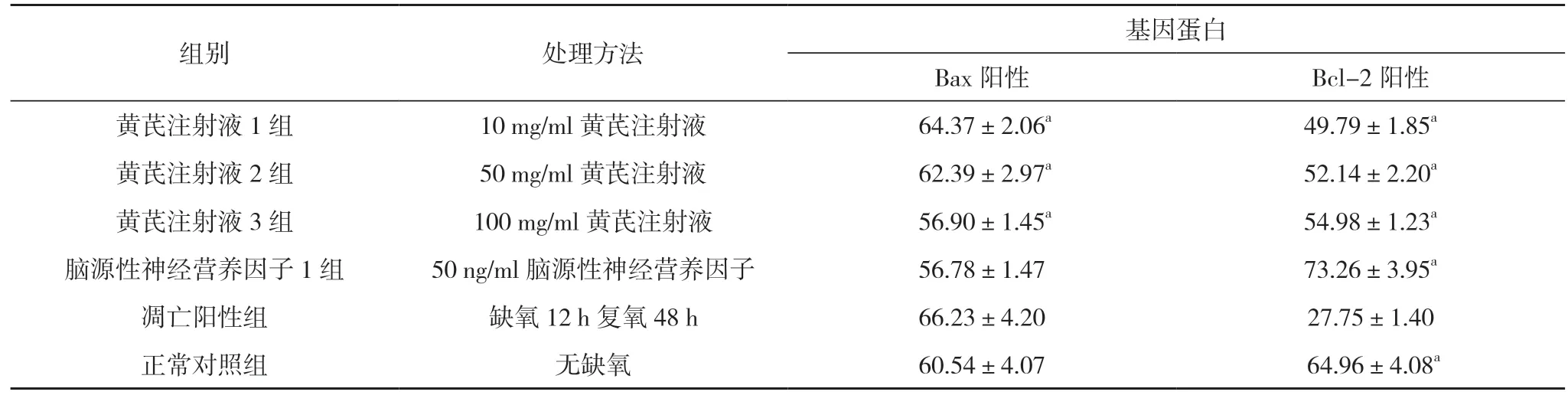
表3 黃芪對缺氧誘導大腦皮層神經細胞凋亡調控基因蛋白的影響比較()
注:與凋亡陽性組比較,aP<0.05
2.4黃芪對缺氧誘導大腦皮層神經細胞表達Bcl-2/Bax比值的影響 缺氧誘導大腦皮層神經細胞Bax 提高,Bcl-2 降低,黃芪注射液1、2、3 組Bcl-2/Bax 比值黃芪注射液1 組<黃芪注射液2 組<黃芪注射液3 組,差異有統計學意義(t=1.8974、13.1559,P<0.05)。黃芪注射液1、2、3 組Bcl-2/Bax 比值均明顯高于凋亡陽性組,差異有統計學意義(t=20.6836、25.2982、38.8909,P<0.05)。見表4。
表4 黃芪對缺氧誘導大腦皮層神經細胞表達Bcl-2/Bax 比值的影響比較()

表4 黃芪對缺氧誘導大腦皮層神經細胞表達Bcl-2/Bax 比值的影響比較()
注:與凋亡陽性組比較,aP<0.05
3 討論
大量研究表明[4,5],細胞凋亡為導致腦梗死、腦出血等腦細胞死亡的一個重要途徑。本研究通過含糖缺氧和復氧培養發現,細胞存活率中,正常對照組>缺氧6 h 組>缺氧12 h 組>缺氧24 h 組,差異有統計學意義(P<0.05)。結果提示缺氧既有細胞凋亡,也有細胞壞死,因此選擇缺氧12 h 進行后續實驗較合適。有研究通過無糖缺氧3、5 h 和復氧45、24 h 發現,大鼠40%的海馬神經元凋亡,提示有糖培養下,因此存在糖酵解,所以缺氧時間需要更長才會紊亂神經細胞代謝,但機體為有糖環境,因此選擇含糖培養基進行培養較為符合[6]。研究表明[7],黃芪總皂甙可提高腦缺血再灌注損傷腦部血清超氧化物歧化酶(SOD)活性,對自由基產生進行抑制,有效降低或避免神經細胞凋亡。黃芪注射液包含氨基酸、多糖、皂甙等多種黃芪有效成分,本研究通過將其作用于缺氧培養的生精細胞,再使用Hoeehst33342 染色觀察,發現缺氧前加入黃芪注射液能顯著抑制缺氧導致的神經細胞凋亡,缺氧12 h 后加入黃芪注射液,雖然抑制細胞凋亡的作用有所降低,但也明顯低于凋亡陽性組,差異有統計學意義(P<0.05),證實了黃芪注射液可抑制缺氧性神經細胞凋亡。Bax 和Bcl-2 是凋亡調控基因Bcl-2 家族中備受關注的基因和蛋白,Bax-Bax 蛋白二聚體可促進凋亡,Bcl-2-Bax 可抑制凋亡,所以Bax 和Bcl 蛋白的表達量很關鍵。有研究對腦梗死大鼠腦內導入Bcl-2 基因,促進Bcl-2 蛋白過量表達,結果發現其能明顯減輕腦梗死程度[8]。本研究結果顯示,黃芪注射液1、2、3組Bax 蛋白表達隨著黃芪注射液的增加而降低,Bcl-2蛋白表達隨著黃芪注射液的增加而增加,黃芪注射液1、2、3 組Bcl-2/Bax 比值均高于凋亡陽性組,差異有統計學意義(P<0.05)。
綜上所述,黃芪注射液可有效通過提升Bcl-2/Bax比值來調節缺氧神經細胞避免凋亡。

