人工智能實施頭頸部患者組織結構自動勾畫的評價研究
鞏漢順 戴相昆 曲寶林 章 樺 徐壽平
精確放療時代下放療計劃中組織結構的準確劑量評估主要基于精確的三維輪廓勾畫,因此靶區及危及器官(organs-at-risk,OARs)勾畫的準確性是實現患者放療療效的重要前提條件之一[1]。但臨床工作中OARs勾畫的是一項極其耗時且繁瑣的工作;同時受勾畫者的主觀性及自身不同專業素質的限制[2-3],很難保證勾畫效果的一致性及準確度[4],這些差異不僅會影響治療計劃的優化及質量,并且會影響療效評估以及臨床模式的評估[5-6]。
頭頸部腫瘤尤其是鼻咽癌患者,其腫瘤靶區形狀復雜、周圍OARs結構眾多,OARs勾畫工作會更加繁瑣耗時。隨著科學技術的進步,不同類別的自動勾畫軟件越來越多地被開發出來。基于圖譜庫的自動勾畫軟件發展起步較早[7],主要包括ABAS(Elekta Medical System,Stockholm,Sweden)、SmartAdapt和Velocity(Varian Medical Systems,Palo Alto,USA)、RayDeformable(RaySearch Laboratories,Stockholm,Sweden)、MIM(MIM Software Inc,Cleveland,USA)等[8],但該類方法對圖譜庫的選擇策略以及通常耗時的配準本身的魯棒性非常敏感[9]。基于不同神經網絡機器學習的自動分割技術近年來也逐步應用于OARs的勾畫,在保證勾畫精度的前提下,大大提高勾畫效率、降低勾畫者之間的差異性[10-11],使得放療工作者從勾畫等大量重復性的工作中解脫出來,更高效地完成對患者的診療收治工作[12]。由于模型構建及算法的差異導致危及器官尤其是微小結構的勾畫結果與真實結構存在一定差異。本研究通過利用改進型U-Net神經網絡的眼周聯合分割優化模型對頭頸部患者的組織結構自動與人工勾畫進行分析比較。
1 材料與方法
1.1 臨床資料
隨機選取本院放療科同一主診組治療的鼻咽癌患者118例。患者取仰臥位,采用熱塑頭肩膜固定,雙臂平行放于身體兩側。在西門子CT(SOMATOM Definition AS)下模擬定位,掃描層厚為3 mm,層間距3 mm;掃描范圍一般從頭頂至隆突。
1.2 人工勾畫危及器官
將定位掃描所得圖像通過DICOM傳輸至Pinnacle計劃系統。由主診組經驗豐富的醫生在CT圖像上手動勾畫出危及器官。
1.3 基于人工智能危及器官自動勾畫
U-Net分割框架由Ronneberger等在全卷積神經網絡(fully convolutional neural networks,FCN)[13]基礎上提出的,與基于塊的深度卷積神經網絡(convolutional neural network,CNN)相比,U-Net框架的優勢在于使用跨層鏈接方式,通過裁剪與復制方式對整個圖像的上下文進行綜合考慮,將多尺度特征信息集成,最終實現對圖像低分辨率和高分辨率信息的完美融合;組織結構分割結果更加精確,圖像細節還原效果更好[14]。
本研究中利用改進型U-Net神經網絡的眼周聯合分割優化模型創建頭頸部患者危及器官自動勾畫模型。此深度學習網絡主要通過使用TensorFlow后端的Keras構建和實現,其中層分類網絡主要由深度可分離卷積和最大池化層組成;分割網絡是從2D U-Net的編解碼器結構中提煉出來。訓練集優選自三家不同醫院343例中勾畫質量好的72例,驗證集患者18例,測試集來源于本單位同一主診醫師收治的118患者,對所得結構勾畫效果與人工勾畫進行分析。
1.4 評價指標





2 結果
對于DSC指標,大部分器官分割效果較為穩定,其中眼球(Eye_L/R)、口腔(Oral Cavity)、腦干(Brainstem)、腮腺(Parotid_L/R)、頜下腺(Submandibular gland_L/R,SMG_L/R)分割效果較好,平均值均在0.820以上,眼球甚至達到0.900以上;耳蝸(Cochlea_L/R)、晶狀體(Lens_ L/R)、視神經(Optic_Nerve_L/R)、甲狀腺(Thyroid)、脊髓(Spinal Cord)、下頜關節(TMJ_L/R)分割效果一般;垂體(Pituitary)、視交叉(Optic_Chiasm)分割效果較差,最低僅為0.559。
HD值與危及器官大小相關,小體積器官均相對穩定;而脊髓自動勾畫效果較差,HD值為23.758。與HD相似,大部分器官的ASSD值較穩定,脊髓的ASSD系數較大。
由于RVD主要體現勾畫的體積偏差,對于體積較小的器官更容易造成偏差較大,其中垂體自動勾畫范圍偏小,偏差值為-0.445;視神經、視交叉勾畫效果也相對偏小。右下頜關節由于器官本身體積比較小,造成兩種勾畫體積差別較大。具體數據結果如表1。
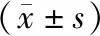
表1 118例頭頸部患者危及器官深度卷積神經網絡自動勾畫與手動勾畫分析結果
3 討論
目前,基于特征的深度學習方法通過捕獲不同組織間的差異并將其整合至預測模型中以解決臨床工作中遇到的相關問題,已是國內外放療學者的一項研究熱點[20-22]。Zhu等[23]基于AnatomyNet神經網絡對頭頸部不同組織結構進行自動勾畫所得DSC為0.7925;門闊等[24]利用深度反卷積神經網絡對頭頸部多個危及器官進行自動勾畫,平均DSC為0.81;Ibragimov等[25]使用卷積神經網絡對頭頸部相關危及器官進行自動勾畫,所得DSC值范圍為0.374~0.895;本研究中所得頭頸部各危及器官的平均DSC為0.559~0.905。通過對脊髓等各項指標進行分析,其DSC值較低,而HD及ASSD值較高,對比勾畫效果圖發現自動勾畫與人工勾畫的標準存在一定差異,目前該算法會把腰椎勾畫在內;修改脊髓的頭腳對比范圍,只對有勾畫的層面進行再次對比,DSC均值從0.747提升至0.850,而HD及ASSD值均有所降低。
對于體積較大的危及器官,較小的體積勾畫差異并不會造成整體器官體積指標參數的顯著差異,但對小體積的器官即使只在某一層面存在勾畫差異也可能會對整個器官結構體積造成較大的差別。雖然采用深度學習的方法能夠獲得危及器官較好的自動勾畫結果,但在實際臨床應用過程中仍然存在某些固有的局限性;深度卷積神經網絡對于解剖位置相對固定,但體積較小的危及器官的自動勾畫存在一定難度;由于網絡結構中存在多次卷積迭代及池化過程,較易造成小體積危及器官勾畫輪廓信息丟失;而頭頸部位本身就包含眾多的小體積危及器官,例如晶體、視神經、視交叉及垂體等,其結果對自動勾畫的整體精度造成一定負面影響。目前,為提高小體積危及器官的勾畫精度通常采用增加訓練樣本數量或改用計算精度更高的函數等兩種常規方法;通過創建患者個性化訓練模型也可提高模型勾畫精度。Ren等[26]交叉使用多個3D卷積神經網絡(3D-CNN)實現頭頸部CT圖像小組織的自動分割:視交叉、視神經的平均DCS分別為(0.58±0.17)、(0.71±0.08);HD95分別為(2.81±1.56)mm、(2.23±0.90) mm。本研究中對于晶體等小體積危及器官,為進一步地提高勾畫精度,利用改進型U-Net神經網絡的眼周聯合分割優化模型創建頭頸部患者微小危及器官自動勾畫模型,對于眼球,則取得了很好的勾畫效果,平均DSC在0.900以上;晶體DSC也接近0.800;而視神經及視交叉RVD值偏小,主要與訓練集勾畫數據較少存在一定關系。與人工勾畫相比,本研究中所采用的神經網絡進行OARs自動勾畫可以顯著降低時間消耗,頭頸部勾畫平均需要6 min;并且采用后臺工作模式,可一次將多個病例集中導入系統進行自動勾畫,進一步減少等待時間,提高勾畫效率。
深度卷積神經網絡在放療靶區勾畫方面的研究[27]相對較少;同時由于不同醫療機構甚至不同醫師之間對靶區勾畫具體準則差異性較大,以及目前用于深度學習的神經網絡結構在腫瘤靶區邊緣界定方面存在一定的不確定性,從而導致靶區自動勾畫精度的較大差異性。Li等[28]利用U-Net模型自動分割鼻咽癌患者腫瘤靶區,原發性腫瘤整體DSC為0.740,淋巴結為0.659;HD分別為12.85 mm和32.10 mm。Kuo等[29]使用深度反卷積神經網絡對鼻咽癌臨床靶區,原發病灶和轉移淋巴結進行自動勾畫,其DSC分別為:0.826、0.809及0.623。隨著技術進步及神經網絡結構的改進,靶區自動勾畫將是放療領域下一步研究的熱點。
總之,采用高精度優化模型的人工智能對解剖結構較為復雜的頭頸部腫瘤患者組織結構的自動勾畫基本可能夠滿足臨床需求,隨著模型中優質勾畫患者數量的增加及對構建模型的不斷優化,其勾畫準確性和精度將獲得進一步的提升;雖然對于某些結構輪廓仍需要進一步人工修改,但人工智能勾畫已在很大程度上把放療工作者從繁瑣而重復的工作中解脫出來,減少了在勾畫方面不必要的工作量,應該可作為一種高效的放療輔助工具。

