DOK3和DOK2在早期胃癌中的表達及其意義
方 玲 夏永欣 田春陽
胃癌是臨床上最常見的消化道腫瘤之一,當前胃癌每年新發病例在百萬人左右,而有效的早期檢測診斷方法缺乏,致使很多患者在確診時就已處于晚期,失去了根治性手術的可能,因此死亡率一直居高不下[1-2]。胃癌的發生機制還不明確,不過可能是先天性與后天性因素共同作用的結果,包括幽門螺桿菌感染、吸煙、肺炎、體細胞突變、基因擴增和缺失、基因失活和異常DNA甲基化、不良飲食習慣等[3-4]。而尋找胃癌發生的診斷標志物及探討胃癌發生的分子機制,對早期預防胃癌具有重要的價值[5]。DOK蛋白家族包括DOK1、DOK2、DOK3、DOK4等,都擁有DOK家族類似結構,含有多個酪氨酸蛋白激酶位點[6]。DOK3和DOK2為受體酪氨酸激酶和非受體酪氨酸激酶信號通路的常見底物,包括表皮生長因子受體、血小板源生長因子受體等。DOK3和DOK2的過度表達可負性調節ERK4、MYC等因素,從而參與細胞增殖、凋亡、生長和遷移等多種過程[7-8]。最近研究表明DOK蛋白為腫瘤抑制因子,可以抑制惡性腫瘤的發生[9-10]。本文具體探討了DOK3和DOK2的表達在早期胃癌診斷及與其病理變化中的意義,希望為胃癌的臨床診治干預策略提供生物學基礎。現總結報告如下。
1 材料與方法
1.1 一般資料
本研究獲得醫學倫理委員會的批準,且所有患者都自愿簽署了知情同意書。將2017年1月至2020年6月在本院診治的早期胃癌80例作為胃癌組,同期選擇在本院診治的胃癌前病變患者80例作為對照組。納入標準:經病理學檢查證實診斷為胃癌或胃癌前病變;年齡30~80歲;所有患者在獲取標本前未接受治療。排除標準:妊娠與哺乳期婦女;伴有其他部位惡性腫瘤者;全身感染性疾病者;臨床與檢測資料缺乏者。
對照組男性42例,女性38例;年齡32~78歲,平均年齡(48.02±5.22)歲;疾病類型:慢性淺表性胃炎29例,低級別上皮內瘤變31例,高級別上皮內瘤變20例。胃癌組男性45例,女性35例;年齡30~80歲,平均年齡(48.94±4.44)歲;臨床分期:Ⅰ期50例,Ⅱ期30例;淋巴結轉移25例;組織學分化:高分化42例,中分化18例,低分化20例;病灶直徑≥4 cm 40例,病灶直徑<4 cm 40例。2組患者的性別、年齡等對比差異無統計學意義(P>0.05)。
1.2 血清學檢測
采集所有患者的空腹外周靜脈血3~5 ml,室溫條件下待外周血自然凝固(30 min左右)后離心5 min(1 000 rpm/min),取上層血清在-80 ℃冰箱保存。提取血液的總RNA,逆轉錄為cDNA,內參照為U6,引物由上海生工公司合成。采用實時熒光定量PCR儀(瑞士羅氏診斷公司)檢測與計算DOK3和DOK2相對表達水平。上述檢測qPCR檢測試劑盒均購買于上海吉碼公司,逆轉錄試劑購自日本TaKaRa公司,DOK3引物(5'-TCAGCGGATATA-ATACAACCTGC-3',5'-TATCGTTGTTCTCCACTCCTTCAC-3'),DOK2引物(5'-ATTGGAACGAIACAGAGAAGATG-3',5'-GGAACGCTTCACGAATTTG-3')。
1.3 統計方法
計量數據以均數±標準差等表示,計數數據以百分比表示,選擇SPSS 19.00軟件進行統一分析,計量數據對比采用t檢驗,計數數據對比采用卡方分析,分析生存曲線通過Kaplan Meier方法與log-rank檢驗生成,相關性分析采用Pearson分析,檢驗水準為α=0.05。
2 結果
2.1 血清DOK3和DOK2表達水平對比
胃癌組中的血清DOK3和DOK2相對表達水平都顯著低于對照組(P<0.05)。見表1。
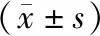
表1 2組血清DOK3和DOK2相對表達水平對比
2.2 DOK3、DOK2的表達與胃癌臨床病理特征的相關性
在胃癌組中,不同組織學分化、臨床分期、淋巴結轉移、病灶直徑的血清DOK3和DOK2表達水平對比差異都有統計學意義(P<0.05)。見表2。
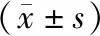
表2 早期不同病理特征胃癌患者血清DOK3和DOK2表達對比
2.3 相關性分析
在胃癌組中,Pearson分析顯示血清DOK3、DOK2表達與組織學分化、臨床分期、淋巴結轉移、病灶直徑都存在相關性(P<0.05)。見表3。
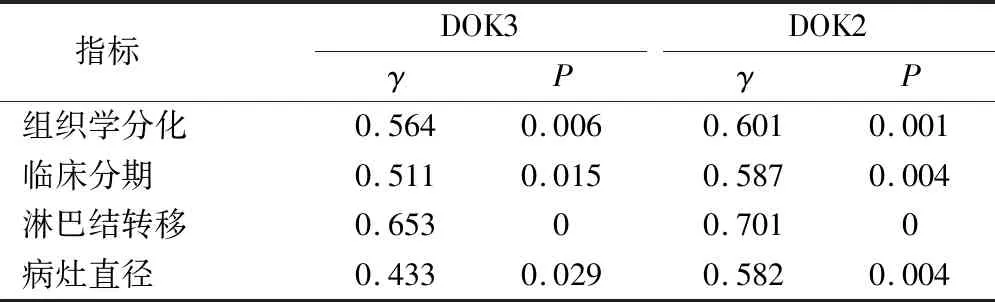
表3 早期胃癌患者血清DOK3、DOK2表達與病理特征的相關性(n=80)
2.4 預后情況
所有胃癌患者隨訪2020年8月,生存64例,死亡16例,死亡率為20.0%。死亡患者的血清DOK3和DOK2表達水平顯著低于生存患者(P<0.05)。見表4。
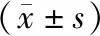
表4 早期胃癌不同預后患者的血清DOK3和DOK2表達對比
3 討論
胃癌是最常見的癌癥之一,主要分布在亞洲、歐洲與美洲等地區,早期胃癌的診斷率低于10%,不能進行根治性手術切除,因此死亡率一直居高不下。已有研究顯示胃癌的惡性進展速度已經超過治療的治愈速度,從而嚴重影響患者的身心健康[10]。胃癌的發生是一個復雜的、多階段、多因素相關的事件,也是一個胃炎-腸上皮化生-低級別上皮內瘤變-高級別上皮內瘤變的連續過程[11]。DOK3和DOK2都為一種接頭蛋白,參與負反饋調節酪氨酸激酶受體介導的信號傳遞[12]。抑制DOK3和DOK2的表達均可以促進惡性腫瘤的發生,提示它們為惡性腫瘤的抑癌基因[13]。本研究顯示胃癌組中的血清DOK3和DOK2相對表達水平都顯著低于對照組(P<0.05),表明胃癌患者多伴隨有血清DOK3和DOK2的低表達。從機制上分析,DOK2和DOK3是關鍵酪氨酸激酶的底物,兩者都可以下調人巨噬細胞集落刺激因子刺激的巨噬細胞反應,可以抑制PTK介導的致癌信號[14]。
胃癌的增殖、分化與轉移是1個多步驟的生物級聯的過程,尤其是癌基因的活化和抑癌基因的失活起著重要作用。胃癌早期主要轉移到淋巴結、肝臟、腹膜等部位,通過直接侵入或通過血液、淋巴系統等途徑進行更遠距離的播種[15]。DOK家族的成員都具有典型的結構特征:N端的PH結構域,負責將蛋白定位到細胞膜上;中間的磷酸化酪氨酸結合結構域,介導DOK家族蛋白與磷酸化酪氨酸的結合;C端序列富含脯氨酸,可作為活化的蛋白酪氨酸激酶誘導的信號復合物組裝的平臺[16]。本研究顯示不同組織學分化、臨床分期、淋巴結轉移、病灶直徑胃癌患者的血清DOK3和DOK2表達水平對比差異都有統計學意義(P<0.05);Pearson分析顯示胃癌患者的血清DOK3、DOK2表達與組織學分化、臨床分期、淋巴結轉移、病灶直徑都存在相關性(P<0.05)。當前也有研究顯示DOK3在低級別的消化道炎癥病變中呈現高表達狀況,而在消化道惡性腫瘤中呈現低表達狀況[17]。
胃癌的過渡增殖伴隨有一些生長因子的過度表達,生長因子與受體結合觸發位于胞膜上的受體形成二聚復合物,過度活化胞內區酪氨酸激酶,下游信號途徑中關鍵蛋白元件受到持續激活,引起信號轉導紊亂,從而導致惡性腫瘤的發生[18-19]。本研究顯示在胃癌組中,死亡患者的血清DOK3和DOK2表達水平顯著低于生存患者(P<0.05)。從機制上分析,DOK3和DOK2表達下降可能提高胃癌上皮細胞的粘附能力與浸潤能力,促進胃癌患者的病變進展,從而使得患者的死亡率上升[20-21]。本研究也有一定的不足,樣本數量較少,且隨訪時間比較短,將在后續研究中深入探討。
總之,早期胃癌患者血清DOK3和DOK2水平均顯著降低,且該兩個指標與患者的病理特征存在相關性,也可作為預測預后的有效標志物。

