TRPM2基因敲除通過調控GSK3β改善脂多糖誘導小鼠抑郁樣行為
張占琴 王輝 蔣永潑
西安交通大學第一附屬醫院1麻醉手術部&腦科學中心,2疼痛科(西安710061);3浙江大學臺州醫院重癥醫學科(浙江臺州317000)
抑郁癥是一種以對事物失去興趣或愉快感,持續性情緒低落或悲觀等為主要臨床特征的精神障礙性疾病[1]。臨床上目前常用的抗抑郁藥物多通過抑制去甲腎上腺素轉運體功能和5?羥色胺(5?HT)再攝取來改善抑郁癥狀,然而當前的抗抑郁藥物存在起效慢、有效率低、停藥易復發等缺點[2]。越來越多的證據表明炎癥反應與抑郁的發病密切相關,促炎細胞因子腫瘤壞死因子?α(TNF?α)、白細胞介素?6(IL?6)和白細胞介素?1β(IL?1β)在抑郁癥過程中發揮關鍵作用[3],抑郁癥患者外周血促炎因子TNF?α、IL?6 和IL?1β明顯升高[4]。另外,約30%左右的膿毒癥存活者表現出不同程度的抑郁樣癥狀,嚴重影響患者的生活質量[5]。瞬時受體電位通道M2(transient receptor potential melastatin 2,TRPM2)是細胞膜上的一種多功能鈣離子通透性的非選擇性陽離子通道,在中樞神經系統免疫細胞中高表達[6]。生理狀態下,TRPM2優先定位于中樞神經系統的小膠質細胞,在星形膠質細胞中較弱表達[7]。它同時又具有ADP 核糖及NAD 結合位點,能夠被H2O2及TNF?α調控,是體內氧化應激敏感的Ca2+通道[6]。研究發現缺血缺氧損害可以通過激活細胞膜上的TRPM2 通道介導Ca2+的出入胞活動,引起鈣超載和細胞凋亡,阻斷TRPM2 通道可顯著降低細胞凋亡[8]。膠質細胞激活及其介導的神經炎癥反應參與膿毒癥介導的小鼠抑郁樣行為[9],然而目前關于TRPM2是否在脂多糖(lipopolysaccharide,LPS)在誘導小鼠抑郁樣行為中的作用及其機制均不明確。本研究通過觀察TRPM2基因敲除(TRPM2-/-)對LPS誘導小鼠抑郁樣行為的影響,以期為其相關臨床應用提供新思路。
1 材料與方法
1.1 實驗動物及模型制備雄性C57 小鼠為背景的野生型和TRPM2-/-小鼠飼養于無病原體、12 h 光照循環(8:00 ~20:00)、室溫(24±2)℃的動物房,整個動物實驗遵從西安交通大學實驗動物倫理委員會要求進行。6 ~8 周齡(體質量20 ~25 g)的雄性WT 和TRPM2-/-小鼠共分為野生小鼠對照組(WT)、野生小鼠模型組(WT+LPS)、TRPM2-/-小鼠對照組(TRPM2-/-)和TRPM2-/-小鼠模型組(TRPM2-/-+LPS)四組。其中將60 只TRPM2-/-小鼠,分為TRPM2-/-組和TRPM2-/-+LPS組各30只;另取60只同基因型背景的野生型小鼠,分為WT 組和WT+LPS組各30 只。模型組腹腔注射0.83 mg/kg LPS[10],對照組腹腔注射等量體積的生理鹽水。參照文獻報道,4 組小鼠造模后24 h 觀察行為學(懸尾實驗和強迫游泳實驗)[10-12],隨后處死所有小鼠進行ELISA、免疫熒光和Western blot 等檢測。
1.2 主要試劑LPS(血清型:0127:B8,美國Sigma公司);5?HT 檢測試劑盒(美 國Abcam 公司);TNF?α和IL?1β酶聯免疫吸附(Elisa)試劑盒(欣博盛生物科技有限公司);Iba?1、GFAP、NeuN、t?GSK?3β和GAPDH 抗體(武漢三鷹生物技術有限公司);p?GSK?3β(美 國cell signaling technology 公司);BCA蛋白濃度測定試劑盒及ECL 發光試劑盒(美國Thermo 公司);熒光二抗(西安壯志生物有限公司);DAPI 和RIPA 裂解液(上海碧云天生物技術有限公司)。
1.3 實驗方法
1.3.1 5?HT 含量測定處死小鼠后冰上取出腦組織,分離海馬和前額葉皮層。按照5?HT 檢測試劑盒的操作步驟,檢測小鼠海馬和前額葉皮層5?HT的含量。
1.3.2 免疫熒光染色甲醛灌注及固定腦組織后依次用含20%和30%蔗糖的PB 溶液沉底。冰凍切片機進行冠狀切片,厚度為6 μm。5 % BSA 室溫封閉2 h 后,分別用Iba?1(1∶100)、GFAP(1∶200)和NeuN(1∶200)抗體孵育18 h。然后用相應的熒光二抗避光孵育2 h,DAPI(1∶300)核染色5 min。正置顯微鏡下拍照觀察,Image J 軟件統計每張腦片Iba?1、GFAP 和NeuN 陽性細胞數。
1.3.3 ELISA 法測定海馬組織TNF?α和IL?1β的含量處死小鼠后分離海馬組織并加入預冷的PBS,勻漿、4 ℃、8 000×g離心10 min,取上清。按照TNF?α和IL?1β檢測試劑盒的操作步驟,檢測小鼠海馬TNF?α和IL?1β的含量。
1.3.4 Western blot檢測采用RIPA 裂解液(10 mL/g)、廣譜磷酸酶抑制劑(1∶100)和PMSF(1∶100)提取海馬組織的總蛋白,冰上超聲破碎以及重新裂解后,4 ℃、13 000×g離心10 min,取上清行BCA蛋白定量。按照每孔60 μg 上樣量進行SDS?PAGE電泳,電泳結束后將蛋白轉移至PVDF膜上。加入一抗p?GSK?3β(1∶1 000)、t?GSK?3β(1∶1 000)和GAPDH(1∶3 000)后4 ℃過夜后,加入相應的二抗羊抗兔(1∶10 000)或羊抗鼠(1∶5 000)室溫孵育1 h,ECL 顯影,Bio?Rad 凝膠成像系統采集圖像并進行灰度值分析。
1.3.5 懸尾實驗固定小鼠尾部1 cm 處,將小鼠懸掛于30 cm 的觀察箱中,保持小鼠鼻尖距地面約20 ~25 cm。記錄6 min 內小鼠的不動時間,并計算不動時間百分比。
1.3.6 強迫游泳實驗將小鼠置于高20 cm,直徑12 cm,水深10 cm 的圓柱形透明缸中,水溫(24 ±2)℃。攝像機采集6 min,記錄后4 min 內累計不動時間。
1.4 統計學方法計量資料以均數±標準差表示,使用SPSS 20.0 軟件進行分析。多組間均數比較采用單因素方差分析,兩兩比較方差齊性采用t檢驗,方差不齊采用非參數秩和檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 TRPM2 基因敲除對LPS 模型前額葉皮層和海馬5?HT 含量的影響與WT 組比較,TRPM2-/-組小鼠前額葉皮層和海馬5?HT 含量無明顯差異,WT+LPS 組小鼠前額葉皮層和海馬5?HT 含量顯著降低(P<0.01);與WT+LPS 組比較,TRPM2-/-+LPS組小鼠前額葉皮層5?HT 含量無明顯差異,而海馬5?HT 含量顯著升高。見表1。
2.2 神經元和膠質細胞標志物表達變化與WT組比較,TRPM2-/-組小鼠海馬GFAP、Iba?1 和NeuN 陽性細胞數無明顯差異,WT+LPS 組小鼠海馬GFAP和Iba?1 陽性細胞數增多(P<0.05),而NeuN 陽性細胞數無明顯差異;與WT+LPS 組比較,TRPM2-/-+LPS組小鼠海馬GFAP和Iba?1陽性細胞數明顯減少(P<0.05),而NeuN 陽性細胞數差異無統計學意義。見圖1、表2。
表1 四組小鼠前額葉皮層和海馬5?HT 含量Tab.1 5?HT expressions of hippocampus and prefrontal cortex tissues in 4 groups of mice±s,ng/g

表1 四組小鼠前額葉皮層和海馬5?HT 含量Tab.1 5?HT expressions of hippocampus and prefrontal cortex tissues in 4 groups of mice±s,ng/g
注:與WT 組比較,##P <0.01;與WT+LPS 組比較,*P <0.05
組別 前額葉皮層 海馬WT 組618.92±45.17726.33±105.12 TRPM2-/-組625.16±34.53699.15±86.29 WT+LPS 組TRPM2-/-+LPS 組426.01±58.14##442.97±80.36 457.98±38.55##605.19±23.76*
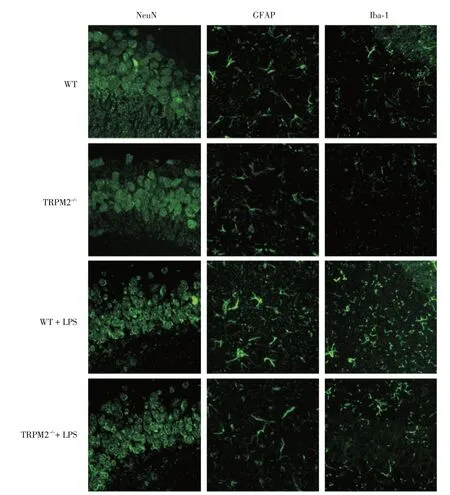
圖1 四組小鼠海馬CA3 區神經元和膠質細胞標志物表達變化情況Fig.1 Changes of neuronal and glial cell markers of hippocampal CA3 region in 4 groups of mice
2.3 TRPM2 基因敲除對LPS 模型海馬TNF?α和IL?1β水平的影響與WT 組比較,TRPM2-/-組小鼠海馬TNF?α和IL?1β水平無明顯差異,WT+LPS 組小鼠海馬TNF?α和IL?1β水平顯著升高(P<0.05);與WT+LPS 組比較,TRPM2-/-+LPS 組小鼠海馬TNF?α和IL?1β水平顯著降低(P<0.05)。見表3。
2.4 TRPM2基因敲除對LPS 模型海馬p?GSK?3β和t?GSK?3β蛋白表達的影響Western blot 檢測結果顯示,四組小鼠海馬組織的t?GSK?3β的相對蛋白表達水平差異無統計學意義,但WT+LPS 組小鼠海馬組織p?GSK?3β的相對表達與WT 組比較明顯下降。而TRPM2-/-+LPS 組小鼠海馬p?GSK?3β的相對表達水平較WT+LPS 組升高。見圖2、表4。
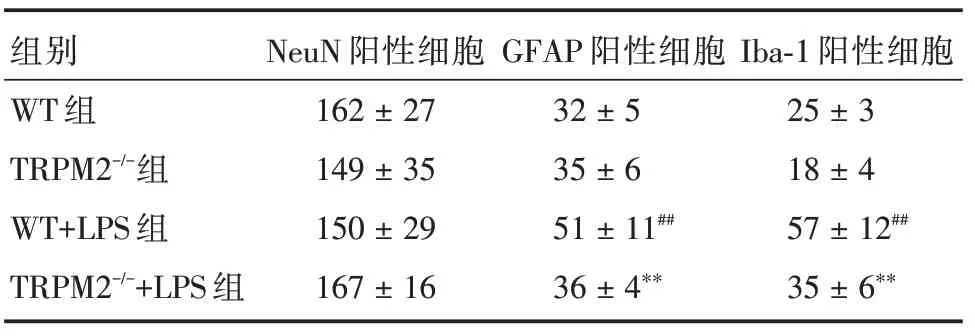
表2 四組小鼠海馬神經元和膠質細胞陽性細胞數(40×)Tab.2 The number of NeuN,GFAP and Iba?1 positive cells of hippocampus in 4 groups of mice(40×)
表3 四組小鼠海馬TNF?α和IL?1β含量Tab.3 TNF?α and IL?1β contents of hippocampus in 4 groups of mice ±s
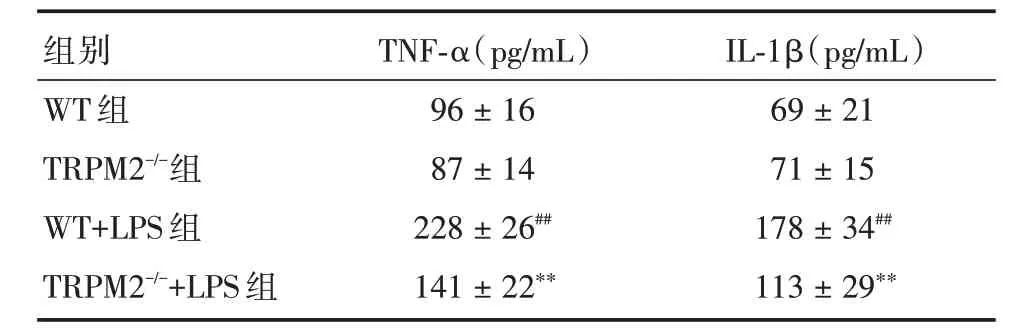
表3 四組小鼠海馬TNF?α和IL?1β含量Tab.3 TNF?α and IL?1β contents of hippocampus in 4 groups of mice ±s
注:與WT 組比較,##P <0.01;與WT+LPS 組比較,**P <0.01
組別WT 組TRPM2-/-組WT+LPS 組TRPM2-/-+LPS 組TNF?α(pg/mL)96±16 87±14 228±26##141±22**IL?1β(pg/mL)69±21 71±15 178±34##113±29**
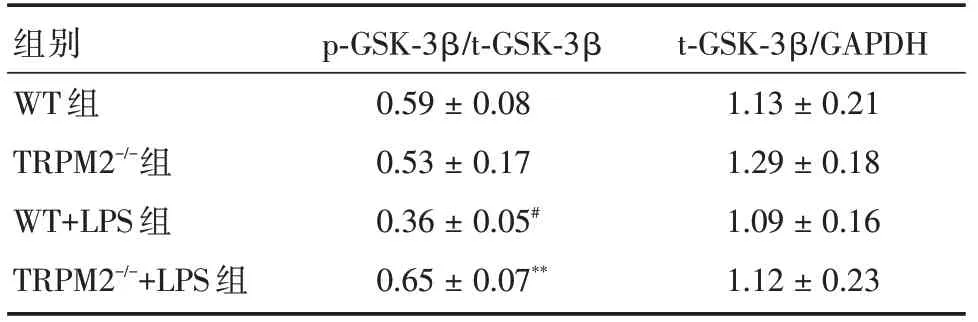
表4 四組小鼠海馬區p?GSK?3β和t?GSK?3β表達的相對光密度值Tab.4 Relative optical density value of hippocampal p?GSK?3β and t?GSK?3β expressions in 4 groups of mice x±s
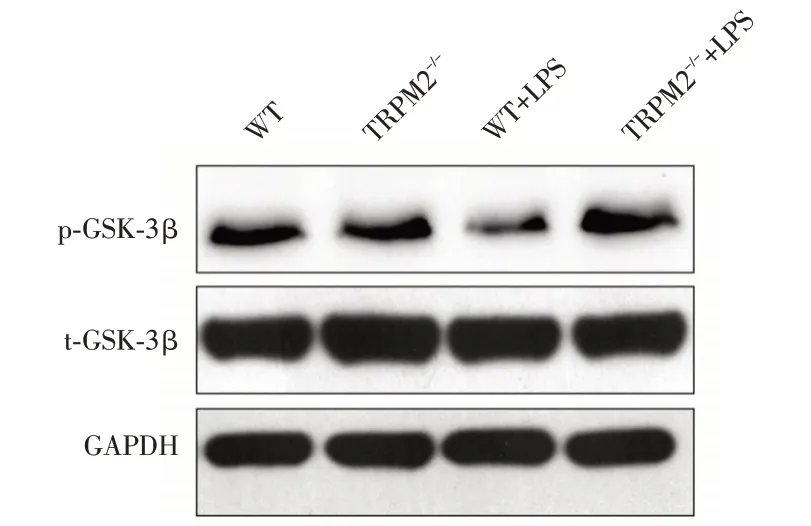
圖2 四組小鼠海馬區p?GSK?3β、t?GSK?3β和GAPDH 的電泳條帶圖Fig.2 p?GSK?3β,t?GSK?3β and GAPDH expressions of hippocampal tissues in 4 groups of mice
2.5 TRPM2基因敲除改善LPS誘導的小鼠抑郁樣行為與WT組比較,TRPM2-/-組小鼠在懸尾和強迫游泳實驗中的不動時間差異無統計學意義,WT+LPS 組小鼠在2 個實驗中不動時間顯著延長(P<0.05);與WT+LPS 組比較,TRPM2-/-+LPS 組小鼠在2 個實驗中不動時間顯著縮短(P<0.05)。見表5。
表5 四組小鼠在懸尾和強迫游泳實驗中的不動時間Tab.5 The mobility time of tail suspension test and forced swim test in 4 groups of mice ±s,s
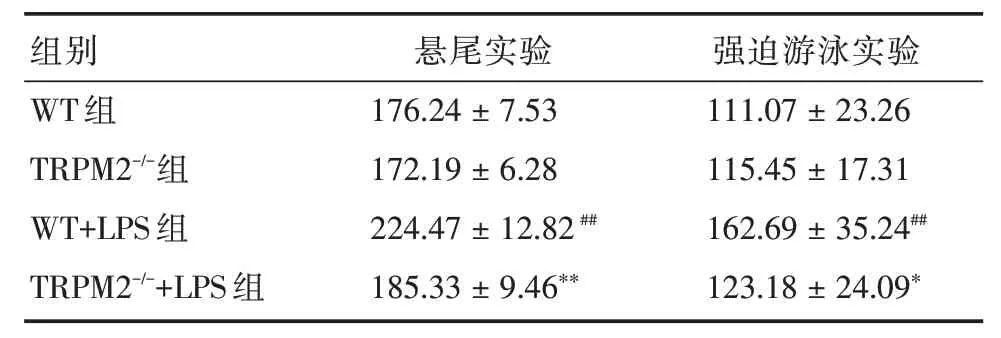
表5 四組小鼠在懸尾和強迫游泳實驗中的不動時間Tab.5 The mobility time of tail suspension test and forced swim test in 4 groups of mice ±s,s
注:與WT 組比較,##P <0.01;與WT+LPS 組比較,*P <0.05,**P <0.01
組別WT 組TRPM2-/-組WT+LPS 組TRPM2-/-+LPS 組懸尾實驗176.24±7.53 172.19±6.28 224.47±12.82##185.33±9.46**強迫游泳實驗111.07±23.26 115.45±17.31 162.69±35.24##123.18±24.09*
3 討論
抑郁癥的病因和發病機制目前尚不清楚,研究發現抑郁癥患者外周血炎性細胞因子濃度升高[4],各種動物抑郁模型顯示腦內炎癥因子表達升高[13],說明抑郁的發病與炎癥的發生密切相關。TRPM2 是一種非選擇性的鈣離子通道,廣泛表達于腦內的免疫細胞上。近年來發現TRPM2 基因敲除對神經系統疾病如阿爾茨海默病、癲癇及缺血性腦血管病均具有良好的保護作用,其機制可能與其抗炎、抗氧化和抗凋亡等作用有關[14]。本研究結果顯示,TRPM2 基因敲除顯著逆轉LPS 誘導的海馬5?HT 含量降低和不動時間延長,同時海馬異常升高的炎癥細胞因子TNF?α和IL?1β水平也明顯下降,說明TRPM2 基因敲除能夠改善LPS 誘導的小鼠抑郁樣行為,而且這種作用可能和降低海馬炎癥反應有關。
LPS 是一種常用的促炎內毒素,可觸發小膠質細胞激活,誘導免疫激活和行為改變,類似于人類抑郁的臨床癥狀[15],因此常經小鼠中樞或者外周給予LPS 誘導抑郁動物模型。研究證實LPS 誘導的抑郁行為包括懸尾和強迫游泳實驗不動時間增加[10],這與本研究結果一致。LPS 引起的小鼠病態行為(豎毛、眼瞼下垂和嗜睡等)通常在給藥后6 h 達峰值時進行測量,24 h 后小鼠自主活動便可恢復正常,此時LPS 誘導的抑郁樣行為可與LPS 誘導的病態行為分離[16],對抑郁樣行為的觀察多在24 h 這一時間點進行[10]。在本實驗中,0.83 mg/kg LPS 腹腔注射24 h 后,小鼠自發活動恢復正常,強迫游泳實驗中不動時間增多,與既往文獻報道一致[10]。先前的研究證實外周LPS 刺激誘導產生的炎性細胞因子能激活吲哚胺2,3-雙加氧酶(indole?amine2,3?dioxygenase,IDO),引起色氨酸代謝異常,最終導致5?HT 合成水平下降,并出現抑郁樣行為[17],給予小膠質細胞刪除劑米諾環素后可間接阻斷IDO 激活,阻止抑郁癥的發展[18]。炎性細胞因子可直接或/和間接損傷神經細胞,導致額葉皮層、海馬、杏仁核和基底核等與情緒有關腦區的神經細胞功能受損[19]。本研究結果顯示LPS 誘導小鼠海馬和前額葉皮層5?HT 含量顯著降低,而TNF?α和IL?1β水平升高,并出現抑郁樣行為,進一步說明炎癥反應在抑郁癥發病中發揮重要作用。
在新生兒缺血缺氧性腦損傷模型中,TRPM2基因敲除可以降低星形膠質細胞和小膠質細胞激活,其機制可能與促進GSK3β磷酸化有關[8]。本研究在LPS 模型中證實了TRPM2 基因敲除可以減輕小鼠抑郁樣行為,同時與抑郁發病密切相關的腦區海馬的TNF?α和IL?1β水平明顯下降,進一步揭示了TRPM2 基因敲除改善抑郁樣行為可能和降低腦內炎癥反應程度有關。GSK3β的活性受到5?HT 信號的影響,GSK3 是5?HT1B 受體調控的Giα信號的功能選擇性調制器,刺激5?HT1 和5?HT7 激活PI3K/AKT 通路,增加GSK3β的磷酸化[20-21]。細胞中GSK3β的活性和表達受到神經遞質、神經調質和神經營養因子等的調節,這其中有許多被作為抗抑郁的靶標,GSK3β蛋白激酶活性異常、表達改變和基因多態性與重度抑郁癥的發病機制、發病年齡和嚴重程度相關[22]。然而,GSK3β活性增強是情緒障礙的因還是果,仍需進一步的研究來充分闡明。腦內過度的氧化應激也是導致抑郁的原因[23],TRPM2 介導ROS 依賴的NLRP3 炎性體激活,TRPM2 基因敲除可以降低腦內氧化應激程度[6]。
綜上所述,TRPM2 基因敲除可以改善LPS 誘導的小鼠抑郁樣行為,可能與上調海馬p?GSK3β的蛋白表達有關,但確切的抗抑郁機制有待進一步研究。因此,仍需深入研究TRPM2 與GSK3β的聯系以及TRPM2 在抑郁等情緒調控中的作用,為抑郁癥的發病機制和治療提供新途徑。

