2014-2018 年安徽省中藥飲片生產企業執行藥品生產質量管理規范檢查的缺陷分析
尹鵬軍,胡士高 (安徽省藥品審評查驗中心,安徽 合肥 230051)
1 GMP 檢查總體情況概述
1.1 企業數量及其分布地區
截至2018 年12 月31 日,安徽省中藥飲片生產企業有226 家,分布于安徽省內16 個市區,其中,亳州市176 家,阜陽市16 家,占全省中藥飲片生產企業總數比重分別為78%和7%。
1.2 檢查結果
2014-2018 年安徽省共組織涉及中藥飲片生產范圍的藥品GMP 現場檢查293 家次。其中,通過GMP 檢查243 家次,未通過GMP 檢查50 家次,不合格率為17.10%,詳見表1。
2 缺陷項目構成情況
對50 家次未通過的GMP 現場檢查報告進行分析,共發現嚴重缺陷66 項,主要缺陷134 項。依據《藥品生產現場檢查風險評定指導原則》,其中5 家次GMP 現場檢查存在多項主要缺陷相互關聯,經綜合分析表明,質量管理體系中某一系統不能有效運行,合并升級為嚴重缺陷項。
2.1 嚴重缺陷項目
依據藥品GMP 及中藥飲片等附錄對缺陷進行分類,發現嚴重缺陷條款數量最多的GMP 章節為總則(15 項),其后依次為機構與人員(11 項)、質量管理(9 項)、質量控制與保證(8 項)等,其中,涉及中藥飲片附錄章節依次為原則(2 項),質量管理(1 項),見表2。
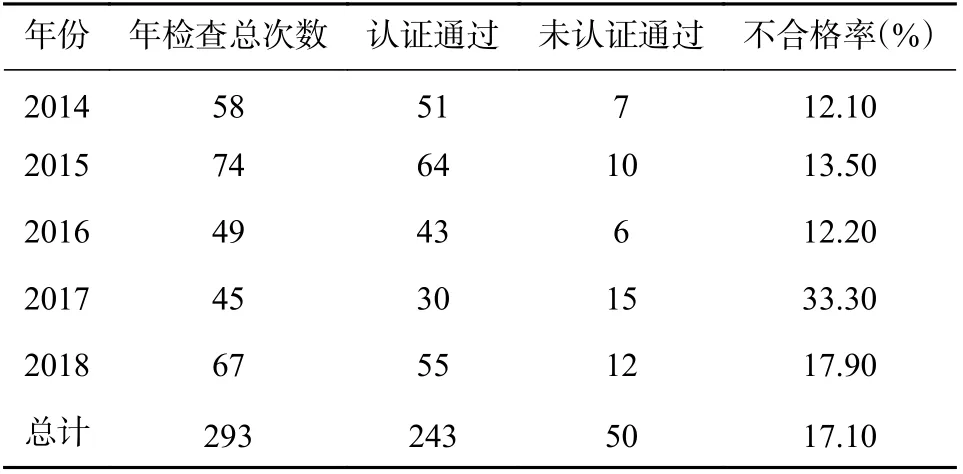
表1 2014-2018 年中藥飲片GMP 認證檢查結果(廠家/次數)
對66 項嚴重缺陷匯總分析發現,企業存在生產檢驗記錄和數據不真實,在未通過檢查的場所生產中藥飲片,人員、設施、設備與企業的生產經營規模不完全適應,存在關鍵崗位人員兼職或者不能有效履行職責,生產記錄或原始數據不能追溯,驗證生產品種沒有涵蓋申請認證范圍,物料管理混亂,許可檢查中發現的缺陷項目未進行整改等問題。
2.2 主要缺陷項目
依據GMP 正文及中藥飲片等附錄對134 項主要缺陷進行分類,發現主要缺陷條款數量最多的GMP 章節為機構與人員(22 項),其后依次為質量控制與保證(21 項)、文件管理(19 項)、中藥飲片附錄(19 項)、確認與驗證(16 項)、生產管理(8 項)等,其中,涉及中藥飲片附錄章節依次為人員(1 項)、廠房與設施(5 項)、物料與產品(1 項)、確認與驗證(6 項)、文件管理(3 項)、生產管理(1 項)、質量管理(2 項),見表3。
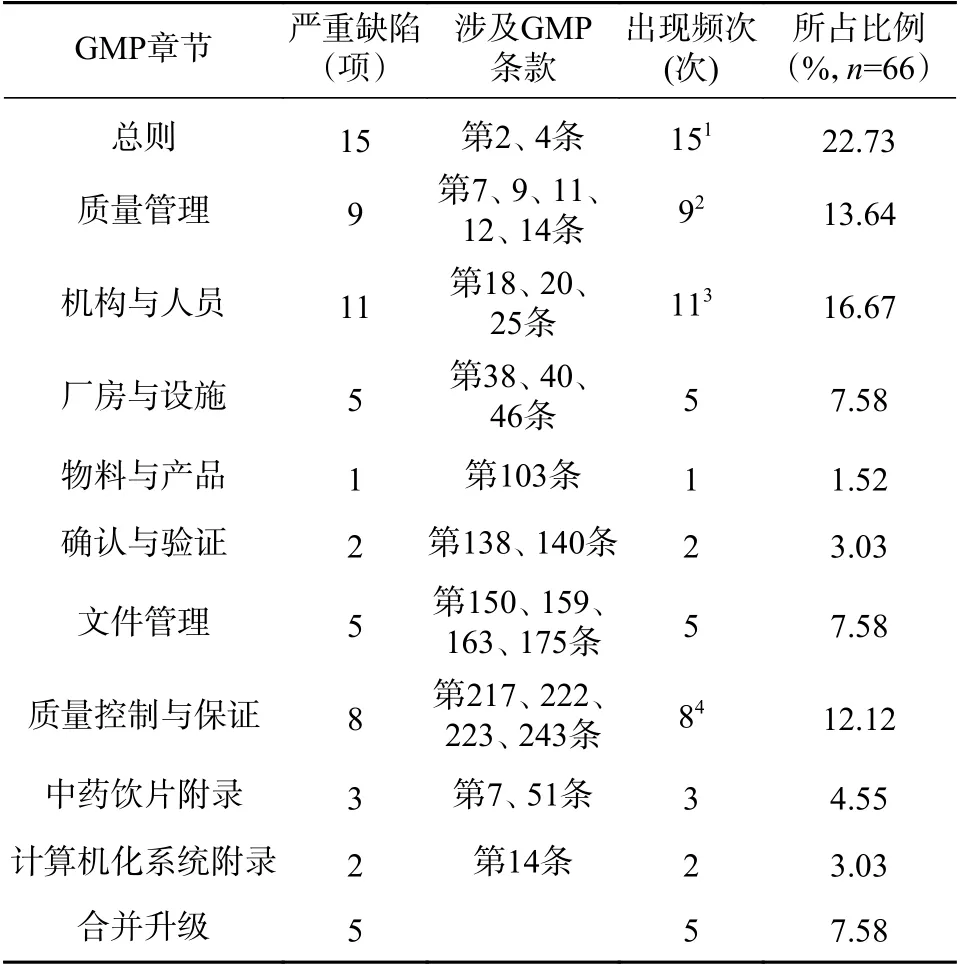
表2 嚴重缺陷項目分布情況
對134 項主要缺陷匯總分析發現,企業存在以下問題:關鍵崗位人員職責不清;對某方面的操作知識了解不夠,未能完全履行職責;開展培訓的內容針對性不強,與該崗位的要求不相適應;缺乏對照品或對照藥材不能對品種進行全項檢驗;偏差未采取有效的糾正和預防措施;未對檢驗方法進行確認,不能保證檢驗結果的準確性;工藝規程缺少關鍵的控制參數;生產檢驗記錄不及時、不準確;確認與驗證工作不充分等。
3 存在的主要問題
從缺陷項目的構成情況和頻次可以看出,缺陷相對集中在質量管理及質量控制與保證、機構與人員、文件與生產管理、確認與驗證、物料與產品5 個方面。以上統計數據一定程度上反映了目前中藥飲片生產企業實施新修訂藥品 GMP 過程中普遍存在的一些問題。
3.1 質量管理體系不能有效實施
在GMP 檢查過程中發現,部分中藥飲片企業法人和負責人思想重視程度不夠,法律意識淡薄,社會責任感不強,認為中藥飲片標準不高也不會產生安全問題,忽略了飲片是用于臨床的藥品。這類中藥飲片生產企業在執行GMP 的各個環節中,違反GMP 要求的情況頻繁發生,如在GMP 車間外生產中藥飲片;不按炮制工藝進行生產;生產檢驗記錄和數據不真實,質量把關流于形式,提升企業法人和負責人法律意識是保證中藥飲片質量的基石。
3.2 不重視人才與培訓
GMP 現場檢查過程中,多次發現關鍵人員生產負責人和質量負責人實際履職能力不足,采購、驗收、倉儲以及檢驗人員不熟悉藥材的分類種屬,藥材鑒別能力較弱,檢驗人員檢驗基本技能差。對藥品生產、質量有關的關鍵崗位人員培訓不到位,培訓次數少、時間短。另外,培訓目的性不強,培訓形式單一,內容簡單,不分層次和崗位,培訓效果不理想,同時也未對培訓效果進行評估。企業還未認識到在藥品生產中“人、機、料、法、環”最關鍵的生產要素是人,只有保證有足夠的訓練有素的人員,才能使質量管理體系順利運行。
3.3 文件與實際生產結合不足
重生產、輕管理的現象還是普遍存在,企業制訂的文件缺乏可操作性,工藝規程未根據工藝驗證內容進行修訂,批記錄設計不合理,如缺少工藝參數、設備編號、生產操作過程等信息;記錄填寫、修改不規范。原因是企業的負責人及質量管理人員對文件管理的重要性認識不足,特別是質量保證人員沒有充分發揮其在企業生產中的管理作用,使相關受控文件沒有得到有效的執行。

表3 主要缺陷項目分布情況
3.4 對確認與驗證認識不足
從目前來看,確認與驗證仍然是企業的一個薄弱環節。檢查中發現多數企業在驗證工作中帶有盲目性或應對性。為了認證而驗證,方案及驗證內容粗糙,有些僅做一組數據,沒有重現性,驗證的結果不能證明設備操作的可靠性和工藝規程的合理性。
3.5 中藥材供應商的審計流于形式
部分企業的中藥材供應商管理不完善,供應商的審計走形式,供應商檔案信息過于簡單,沒有對直接從農戶購入中藥材質量進行評估并建立質量檔案,不能從物料源頭抓起,保證藥品的質量。
4 做好中藥飲片GMP 生產和監管工作的建議
4.1 深入貫徹新修訂《藥品管理法》落實企業等各方責任
必須全面提升企業法人和負責人法律意識,藥品生產企業是藥品質量的責任主體,必須履行藥品生產經營的各項法律法規和技術規范,必須對自己生產經營的產品質量安全承擔法律責任,在強化責任中落實“四個最嚴”。
2019 年頒布實施的新修訂的《藥品管理法》對藥品違法行為處罰等都作出更嚴格的要求。一是切實“處罰到人”。明確對嚴重影響質量安全的違法行為,在對違法主體依法處罰的同時,對其法人、主要責任人、直接負責的主管人員和其他責任人員也予以處罰,包括沒收違法行為發生期間其所獲收入、罰款、一定期限甚至終身禁業,并可以處以拘留。二是提高財產罰幅度,處罰額度全面提升。三是專條規定刑事責任。設專條強調藥品違法行為構成犯罪的,要依法追究刑事責任,立場鮮明地保持對藥品安全犯罪行為的強力震懾和高壓態勢[1]。
4.2 注重引進中藥飲片生產和質量管理人才與實際培訓效果
藥品生產各要素中最關鍵的要素是人,尤其是生產負責人和質量負責人。由于中藥材品種繁多、來源復雜,各地用藥習慣不同,藥典和地方規范炮制過程時有不同,同物異名、同名異物的現象多,因此,中藥材的驗收、鑒別、檢驗以及中藥飲片的炮制生產過程是一項技術性、經驗性很強的工作[2]。2010 版中藥飲片附錄對生產和質量管理部門負責人專業、學歷、從業經驗、年限做出明確要求,要求質量保證和控制人員具備中藥材和中藥飲片質量控制和鑒別真偽優劣的實際能力,要求采購、倉儲驗收人員明確中藥材鑒別要求以及儲存養護知識。
企業應積極引進中藥生產和質量管理專業人才,制定切實可行的培訓計劃,針對不同崗位、不同層次的人員開展培訓。培訓內容包含法律法規、專業知識、操作技能等,讓員工明白做什么、怎么做、達到什么標準。培訓是提高企業員工素質的有效途徑和手段,只有積極開展注重實效的培訓,使最基層的員工到高管層全體人員真正理解GMP 的精髓,才能真正執行好GMP,更好地保證產品質量。
4.3 建立符合自身實際的文件體系與保證質量體系有效運行
一個有效的文件管理體系能夠很好地指導生產實踐。質量管理文件的制定者需深刻理解GMP 條款,基于風險管理和企業實際,反復修訂文件,確保系統文件具有規范性、系統性和可操作性,文字表達應清晰易懂,確保所有執行人員能獲得相關崗位工作的詳細指令并遵照執行。對于工藝規程和操作規程中的關鍵參數,要經過充分驗證,確定關鍵控制點,并保證生產和質量全過程的記錄可追溯,確保質量體系在企業中有效運行[3]。
4.4 從源頭抓起加強中藥材供應商的審計管理
中藥材質量直接影響中藥產品制劑,中藥飲片質量優劣直接影響臨床療效,其供應商的選擇和管理就顯得尤為重要。中藥生產企業應對中藥材供應商做好供應商審計,形成合格供應商目錄,對于發現不符合要求且有作假、摻假、以次充好的,取消其供貨資格。為確保藥品質量,中藥飲片生產企業必須建立良好的物料管理體系,從源頭抓起,保證藥品的質量。
4.5 有針對性做好生產管理工作
通過對缺陷項目進行統計分析不難發現,部分缺陷項目屬于“細節問題”,不被人們所重視,往往正是這些“細節問題”增加了藥品質量風險事件的發生率。企業必須按照法定標準和各省、自治區、直轄市中藥炮制規范制定工藝規程,并按照工藝規程編寫標準操作規程和批生產記錄,在生產過程中,及時填寫批生產記錄、數據完整、內容真實,由操作人及復核人簽字,控制好生產過程中每一個環節[4]。
4.6 統一檢查判定尺度,加強中藥飲片生產監管
中藥飲片GMP 監管工作是一項對檢查員工作技巧性、專業性、原則性較高的工作。這就需要充實人員,建立職業化檢查員隊伍,有針對性的加強培訓,提高對GMP 檢查工作的認知水平,加深對GMP 標準的理解,統一檢查尺度[5]。
5 結語
新修訂的GMP 已實施了10 年。我國從GMP認證發展到GMP 的持續符合性監管,提升的是管理理念,不變的是GMP 在藥品生產中的重要作用。中藥飲片生產企業應提高法律意識,加強誠信建設,注重人員培訓,根據中藥飲片的生產特點,真正將GMP 的思想貫徹到實處,提高硬件配置水平,建立規范的文件體系并控制實際執行情況,持續合規生產,最大程度地降低藥品生產風險,而GMP 監管應突出專業性和職業化,切實保證中藥飲片質量安全。

