耐熱β-木糖苷酶的可溶性表達及其應用
羅佳年華,董玉蓉,張珊珊,張小濛,趙林果*
(1.南京林業大學江蘇省南方現代林業協同創新中心,南京 210037;2.南京林業大學化學工程學院,南京 210037)
紫杉醇(Paclitaxel)是一種三環二萜類化合物,最早從短葉紅豆杉(Taxusbrevifolia)的樹皮中提取獲得[1]。紫杉醇對多種癌癥具有顯著的抑制作用[2-5],此外,還對中風、老年癡呆等具有很好的療效[6]。紫杉醇在臨床上的需求極大,但其在紅豆杉屬植物中的含量極低(僅為0.005%~0.015%)。迄今為止,紫杉醇的制備方法包括傳統的提取法、化學合成法、內生菌培養法和植物細胞培養法[7]等。然而,傳統提取法費時費力;化學合成法路線復雜,且合成得率低,不適合工業生產;內生菌培養法無法達到工業產量需求;植物細胞培養法存在植物細胞易變異、紫杉醇表達水平低且產量不穩定等問題[8]。
7-木糖-10-去乙酰基紫杉醇(7-XDT)主要存在于樹葉中,其含量遠高于紫杉醇和其他紫杉烷類化合物,是紫杉醇含量的20~50倍[9]。因此,提取含量較高的7-XDT,并將其轉化為紫杉醇,是一種有效利用植物資源的可持續途徑[10]。迄今為止,有關β-木糖苷酶應用于轉化7-XDT制備10-去乙酰基紫杉醇(10-DT) 的報道甚少。Cheng等[11]利用糖苷水解酶Lxyl-p1-2轉化7-β-木糖基紫杉烷;Dou等[12]利用新型的類纖維素多酶復合物,其能對7-木糖基-10-去乙酰基紫杉醇進行高效糖苷水解。而應用于轉化7-XDT制備10-DT的嗜熱菌來源的β-木糖苷酶資源匱乏,僅Li等[13]報道了有關嗜熱菌來源的且能用于7-XDT制備10-DT的β-木糖苷酶。
目前已報道的β-木糖苷酶多為低溫、中溫酶,其熱穩定性普遍不高。然而,工業生產中常需要較高的反應溫度來增加底物溶解度、降低污染風險、提高傳質速率等。因此,從嗜熱菌中篩選熱穩定性強的β-木糖苷酶已成為當前研究的熱點。β-木糖苷酶在大腸桿菌表達系統中異源表達時常會伴隨著包涵體過多的現象,尤其是來源于嗜熱菌的β-木糖苷酶,因其自身含有較多的二硫鍵,表達后若不能及時正確地折疊,更易形成包涵體,這將極大地影響目的蛋白的有效產量,并限制嗜熱菌來源的β-木糖苷酶在大規模水解7-XDT中的應用。分子伴侶能夠幫助異源表達的重組蛋白進行正確折疊,提高蛋白的可溶性表達,減少包涵體的形成[14]。因此,利用分子伴侶蛋白質粒(如pKJE6[15]、pTf16[16]等)與目的基因質粒共表達,是提高重組目的蛋白可溶性表達的一種有效手段。
以嗜熱菌ThermotogapetrophilaDSM 13995來源的β-木糖苷酶Tpexyl3為研究對象,借助分子伴侶共表達、培養條件優化等方法,提高了該酶在大腸桿菌中的可溶性表達量,在此基礎上,將其應用于轉化7-XDT制備10-DT,并對該反應工藝進行了優化。
1 材料與方法
1.1 菌種與質粒
β-木糖苷酶基因Tpexyl3(序列數據庫登錄號:ABQ46867.1)來源于嗜熱菌T.petrophila,重組質粒pET-28a-Tpexyl3由本實驗構建并保藏;分子伴侶質粒(pKJE6、pKJE7、pG-KJE8、pG-Tf2、pTf16和pGro7),購自日本TaKaRa公司;EscherichiacoliDH5α及E.coliBL21(DE3)感受態細胞,購自南京諾唯贊生物技術有限公司。
1.2 主要試劑
酵母提取物、蛋白胨,美國Oxoid公司;麥芽糊精,市售;蛋白含量檢測試劑盒,寶日醫生物技術(北京)有限公司;對硝基苯酚木糖苷(pNPX)、考馬斯亮藍G-250、考馬斯亮藍R-250,美國Sigma公司;蛋白電泳緩沖液、預混蛋白電泳Marker,南京天為公司;卡那霉素、氯霉素、四環素、異丙基-β-D-硫代半乳糖苷(IPTG)、L-阿拉伯糖,生物工程(上海)生物科技有限責任公司。
1.3 培養基
溶菌肉湯(LB)培養基:質量分數1.0%蛋白胨、質量分數0.5%酵母提取物、質量分數1.0%氯化鈉。富集肉湯(TB)培養基:A液(體積分數90%)為質量分數1.0%麥芽糊精(或其他碳源)、質量分數1.2%蛋白胨、質量分數2.4%酵母提取物;B液(體積分數10%)為磷酸二氫鉀17 mmol/L和磷酸氫二鉀72 mmol/L。
1.4 主要儀器與設備
Agilent 1260型高效液相色譜儀(HPLC)及S.No. USNH017518型C18 反向色譜柱(直徑和長分別為4.6和250 mm,填料顆粒直徑5 μm),美國安捷倫科技有限公司;超聲波細胞破碎機,寧波新芝生物科技有限公司;ZHWY-2102C搖床,上海智城分析儀器制造有限公司;SpectraMax190型酶標儀,美國分子儀器公司;凝膠成像系統,美國BIO-RAD公司;電泳儀,美國GE Health公司。
1.5 實驗方法
1.5.1 分子伴侶蛋白的篩選
6種分子伴侶質粒(pKJE6、pKJE7、pG-KJE8、pG-Tf2、pTf16、pGro7)的主要信息見表1。分別將6種分子伴侶質粒與重組β-木糖苷酶質粒pET-28a-Tpexyl3混合后熱擊轉化至E.coliBL21(DE3)感受態細胞中,利用含有50 μg/mL卡那霉素和20 μg/mL氯霉素抗性的LB平板進行篩選,37 ℃過夜培養。分別挑取6種共表達陽性轉化子于5 mL LB液體培養基中,于37 ℃、180 r/min搖床中培養,分別保存菌種。
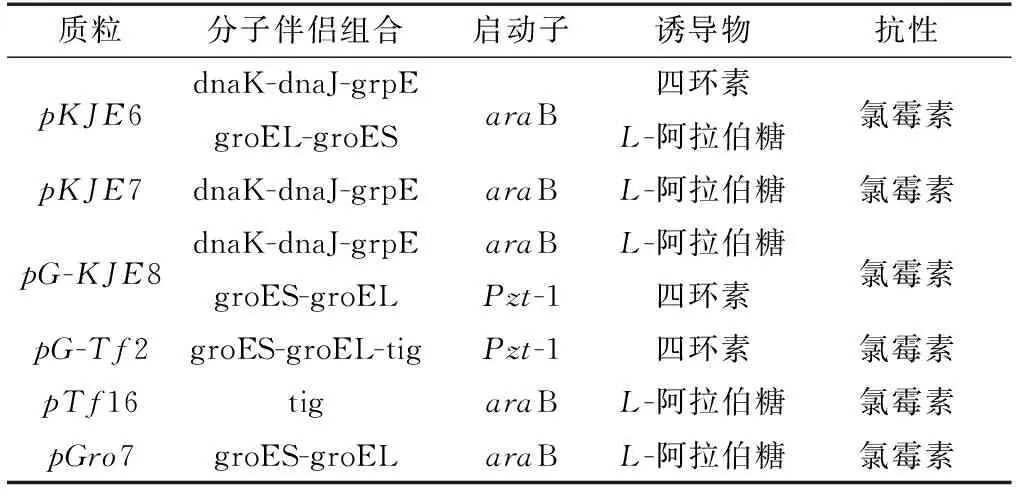
表1 分子伴侶質粒Table 1 Molecular chaperone plasmid
菌種復蘇后,轉接入含有50 μg/mL卡那霉素和20 μg/mL氯霉素的50 mL LB培養基中,添加0.5 mg/mLL-阿拉伯糖以及(或者)10 μg/mL四環素,于37 ℃、180 r/min搖床培養至600 nm下的吸光度(OD600)至 0.6~0.8,加入0.01 mmol/L的誘導劑IPTG,于37 ℃、180 r/min搖床培養7 h。收集菌液,10 000 r/min 離心10 min后收集菌體;再各用10 mL的20 mmol/L磷酸鹽緩沖液重懸菌體,超聲破碎后取樣為全細胞樣品;12 000 r/min離心10 min后收集上清液。分別測定各上清液酶活并進行酶活和聚丙烯酰胺凝膠電泳(SDS-PAGE)分析,篩選出能提高目的蛋白表達的分子伴侶。
1.5.2 培養條件對重組菌生長和蛋白表達的影響
將篩選的共表達菌種接種至5 mL LB培養基中,于37 ℃搖床過夜培養復蘇菌種。
TB培養基碳源種類優化:分別接種復蘇菌液500 μL至50 mL含有不同碳源(質量分數1%麥芽糊精、1%甘油、1%蔗糖、1%葡萄糖和1%菊粉)的5瓶TB培養基(均含有50 μg/mL卡那霉素、20 μg/mL氯霉素和0.5 mg/mLL-阿拉伯糖)中,保持其他培養條件一致,當OD600約為 0.6時,加入0.01 mmol/L IPTG進行誘導,于37 ℃搖床培養48 h。10 000 r/min離心分別收集菌體、重懸菌體、超聲破碎,破碎懸浮液取樣為全細胞樣品,12 000 r/min離心收集上清液。分別測定各上清液酶活并進行比較,篩選出TB培養基最佳碳源種類。
分別對TB培養基碳源質量分數(0.25%,0.50%,1.00%,2.00%,3.00%和4.00%)、IPTG濃度(0,0.01,0.02,0.05,0.10和0.20 mmol/L)、L-阿拉伯糖質量濃度(0,0.5,1.0,2.0,3.0和4.0 mg/mL)以及誘導溫度(20,25,28,32,37和42 ℃)進行優化。重組菌的培養和酶活測定方法同上。
1.5.3 酶活力的測定
以20 mmol/LpNPX為底物,水解得到的對硝基苯酚(pNP)與碳酸鈉發生顯色反應,在405 nm的波長下測定產物的吸光度。反應體系為:10 μL 500 mmol/L檸檬酸-磷酸氫二鈉緩沖液,5 μL底物,混勻預熱后加入5 μL游離酶,在酶的最適溫度和pH下反應5 min。以不加酶液的反應體系作空白對照,酶活力單位定義參照文獻[17],酶活計算公式如下:
β-木糖苷酶酶活 (U/mL) =c/(t×V)×N
(1)
式中:c為酶反應后的對硝基苯含量,μmol;t為酶與底物反應時間,min;V為反應體系中酶液的體積,mL;N為酶液的稀釋倍數。
1.5.4 重組蛋白的純化
將粗酶液于55 ℃下保溫30 min,12 000 r/min離心30 min,收取上清液為熱處理后酶液。將熱處理后酶液上樣至Ni+親和層析柱,使用含有不同濃度咪唑(30,100,200 和400 mmol/L)的洗脫緩沖液進行洗脫,并收集洗脫液。使用SDS-PAGE對純化的酶液進行分析,采用考馬斯亮藍法測定蛋白質含量。
1.5.5 反應條件對重組酶轉化底物的影響
向200 μL的25 mmol/L磷酸氫二鈉-檸檬酸緩沖反應體系中加入終質量濃度為500 mg/L 的7-XDT和不同添加量的Tpexyl3,在一定溫度下反應3 h后加入200 μL 甲醇終止反應,樣品過膜后用HPLC進行檢測。改變緩沖溶液的pH(4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5和8.0)、溫度(60,70,80,90和99 ℃)以及酶用量(10,25,50,75,100,250和500 U/mL),從而考察pH、溫度和酶用量對Tpexyl3水解7-XDT的影響。
Tpexyl3水解7-XDT的時間反應歷程檢測:Tpexyl3水解7-XDT于90 ℃下反應12 h,每個時間點取樣加入200 μL甲醇,樣品過膜后用HPLC進行檢測。
2 結果與分析
2.1 分子伴侶蛋白的篩選
將重組質粒pET-28a-Tpexyl3分別與6種分子伴侶質粒等體積混合后,共同轉入E.coliBL21(DE3)表達宿主中,獲得6種共表達菌株:pET-28a-Tpexyl3-pKJE6、pET-28a-Tpexyl3-pKJE7、pET-28a-Tpexyl3-pG-KJE8、pET-28a-Tpexyl3-pGro7、pET-28a-Tpexyl3-pG-Tf2和pET-28a-Tpexyl3-pTf16。培養后收集菌體,經SDS-PAGE對目的蛋白的表達進行分析,結果如圖1所示。其中,質粒pKJE6、pKJE7、pG-KJE8和pGro7分別與pET-28a-Tpexyl3共表達時,包涵體沉淀較pET-28a-Tpexyl3單獨表達時明顯減少。
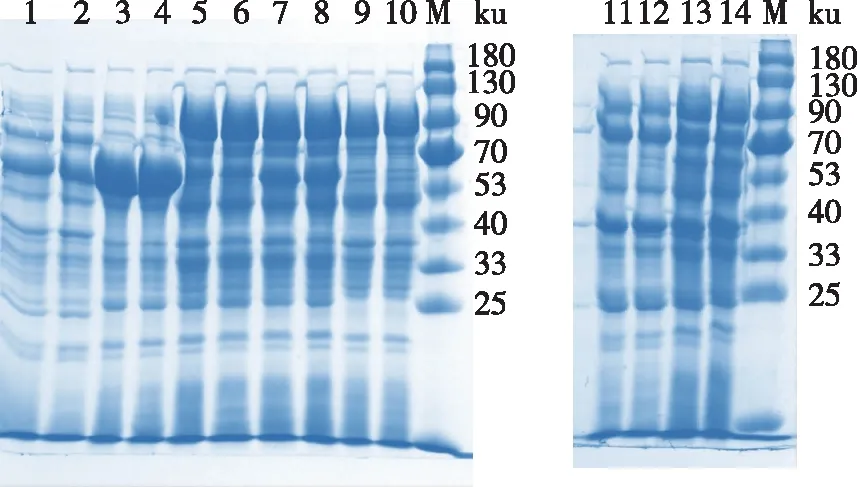
1)Tpexyl3全細胞;2)Tpexyl3上清液;3)pET-Tpexyl3-pG-KJE8全細胞;4)pET-Tpexyl3-pG-KJE8上清液;5)pET-Tpexyl3-pG-Tf2全細胞;6)pET-Tpexyl3-pG-Tf2上清液;7)pET-Tpexyl3-pTf16全細胞;8)pET-Tpexyl3-pTf16上清液;9)pET-Tpexyl3-pGro7全細胞;10)pET-Tpexyl3-pGro7上清液;M)蛋白Marker;11)pET-Tpexyl3-pKJE6全細胞;12)pET-Tpexyl3-pKJE6上清液;13)pET-Tpexyl3-pKJE7全細胞;14)pET-Tpexyl3-pKJE7上清液。圖1 分子伴侶篩選的SDS-PAGE分析Fig. 1 SDS-PAGE analysis of chaperones screening
分別測定各自上清液的酶活并進行比較,結果如圖2所示,pET-28a-Tpexyl3-pKJE7的酶活明顯高于其他共表達菌株,這表明當分子伴侶蛋白質粒pKJE7與重組質粒pET-28a-Tpexyl3共表達時能顯著減少包涵體含量,提高目的蛋白的有效表達。因此,選取pET-28a-Tpexyl3-pKJE7進行后續實驗。
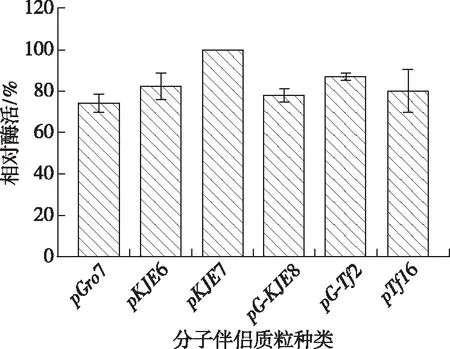
圖2 分子伴侶種類篩選酶活測定Fig. 2 Chaperones screening and enzyme activities
2.2 Tpexyl3與分子伴侶共表達的條件優化
為進一步獲得目的蛋白的高效表達,使用TB培養基對pET-28a-Tpexyl3-pKJE7進行培養條件優化,結果見圖3。由圖3可以得知,pET-28a-Tpexyl3-pKJE7表達目的蛋白的最優條件為:質量分數1.00% 的麥芽糊精作為TB培養基的碳源,不添加誘導劑,于32 ℃搖床培養48 h,最高表達量可至190 U/mL,是無分子伴侶參與下LB培養基中表達量(6.81 U/mL)的27.9倍,且高于其在7.5 L發酵罐中連續發酵10 h后的表達量(151.43 U/mL)。目的蛋白Tpexyl3在不添加誘導劑時即可達到高效表達。這可能是由于在培養基中微量的乳糖已足夠啟動目的基因的轉錄,其本底表達即可獲得極高的表達量,即使微量的IPTG都會降低目的蛋白的表達量,這在實際應用中更具有應用前景。
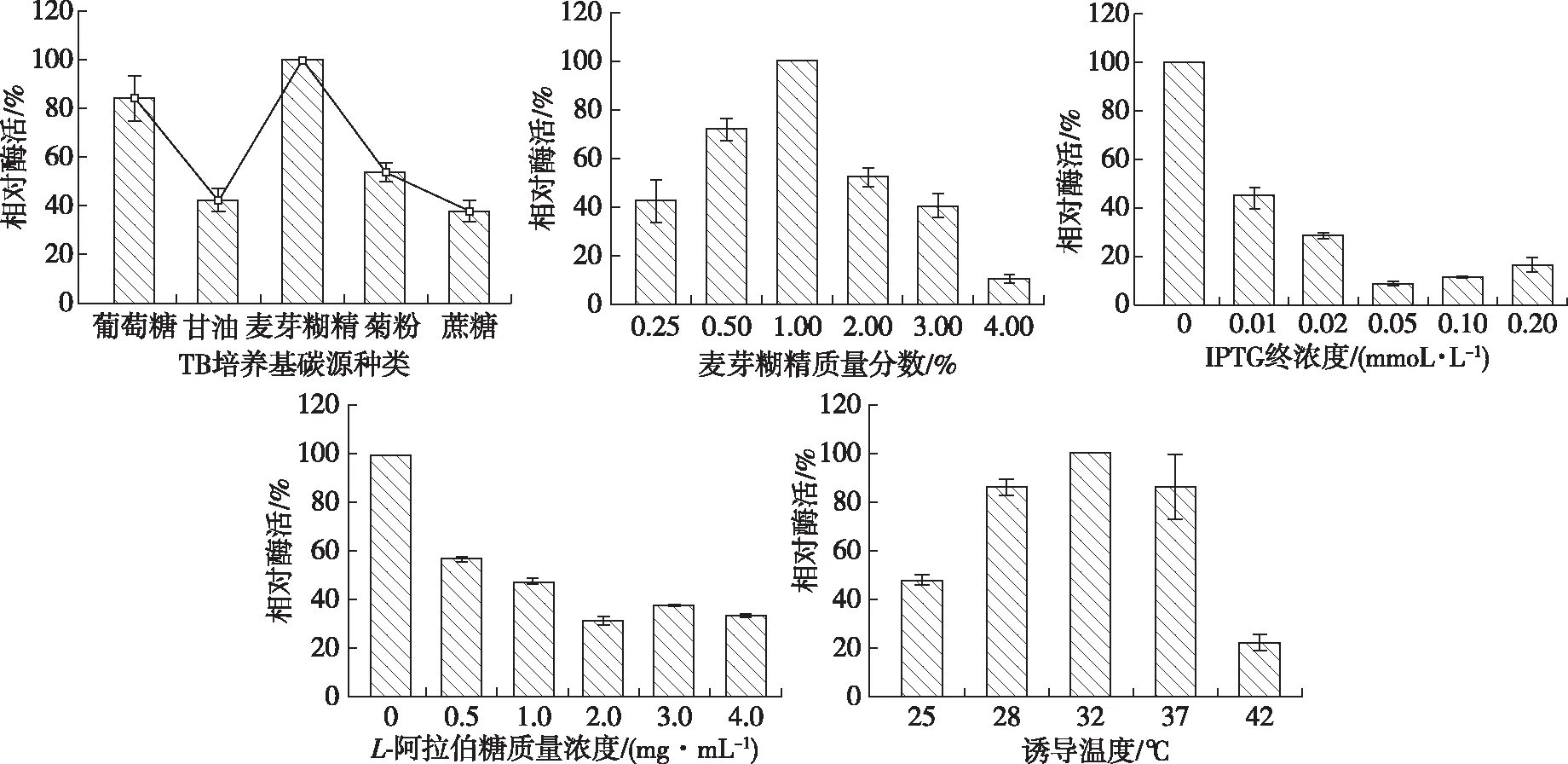
圖3 重組酶Tpexyl3的表達條件優化Fig. 3 Optimization of expression conditions and purification of recombinant Tpexyl3
2.3 Tpexyl3的純化及酶活性測定
誘導后的pET-28a-Tpexyl3-pKJE7,經超聲破碎、熱處理和親和層析純化后獲得了電泳純的目的蛋白,純化過程及結果如表2所示。由表2可知,pET-28a-Tpexyl3-pKJE7的比酶活為205.76 U/mg,得率為6.57%,純化倍數為2.46倍。經SDS-PAGE凝膠電泳分析,結果如圖4所示,在87 ku(預測目的蛋白理論大小)左右,有單一條帶,純化獲得電泳純重組酶Tpexyl3。
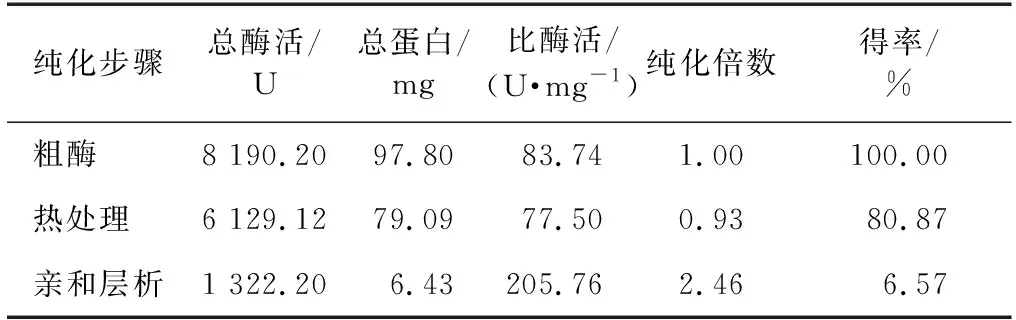
表2 重組酶Tpexyl3的純化Table 2 Purification of recombinant Tpexyl3
獲得純化酶后,對Tpexyl3的最適反應溫度與最適反應pH再次進行測定,結果表明,Tpexyl3的最適反應溫度為90 ℃,最適反應pH為6.0,結果與Zhang等[18]測定結果一致。可見與分子伴侶共表達時,Tpexyl3的基本性質未受影響,目的蛋白正確折疊。
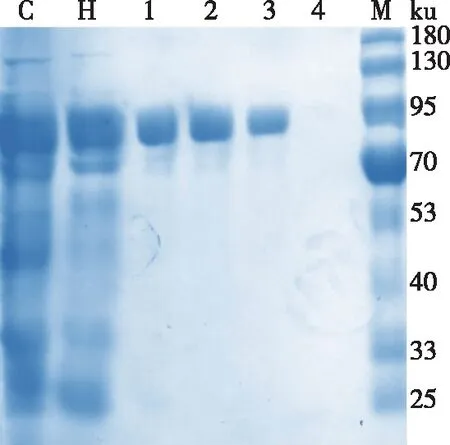
C為粗酶液;H為熱處理;1~4為咪唑洗脫液(30, 100, 200和400 mmol/L);M為蛋白Marker。圖4 重組酶Tpexyl3 SDS-PAGE分析Fig. 4 SDS-PAGE of recombinant enzyme Tpexyl3
2.4 Tpexyl3轉化7-XDT的反應條件優化
7-XDT與紫杉醇具有相同的母核結構(圖5),對7-XDT的C-7位去木糖基化,是以7-XDT為底物酶法制備紫杉醇過程中的關鍵步驟。為了獲得Tpexyl3水解7-XDT的最適pH、最適溫度、最適反應時間及最適用酶量,以滅活的Tpexyl3 處理7-XDT的含量為對照,結果如圖6所示。在pH 5.5、80 ℃溫度下,添加250 U/mL Tpexyl3反應4 h,可將500 mg/L 7-XDT轉化為162 mg/L 10-DT,物質的量轉化率可至45.59%。
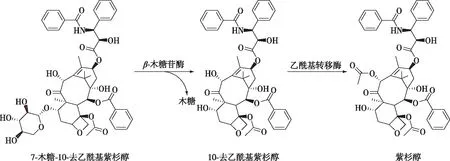
圖5 酶法轉化7-XDT生成紫杉醇流程圖Fig. 5 Biotransformation of 7-XDT into taxol
參考Tpexyl3的熱穩定性,4 h反應后體系中應仍有殘余酶存在。因此,為最大限度發揮添加酶的利用度及檢測反應過程中各組分的變化,通過分時段取樣,研究了延長反應時間至12 h的整體反應歷程,結果如圖6d所示。在整個轉化過程中,7-XDT含量逐漸降低,10-DT含量逐漸增高,2 h內產物量達到最高,2 h后反應體系各組分保持不變。底物未能完全轉化,這可能與反應體系中的產物抑制相關。
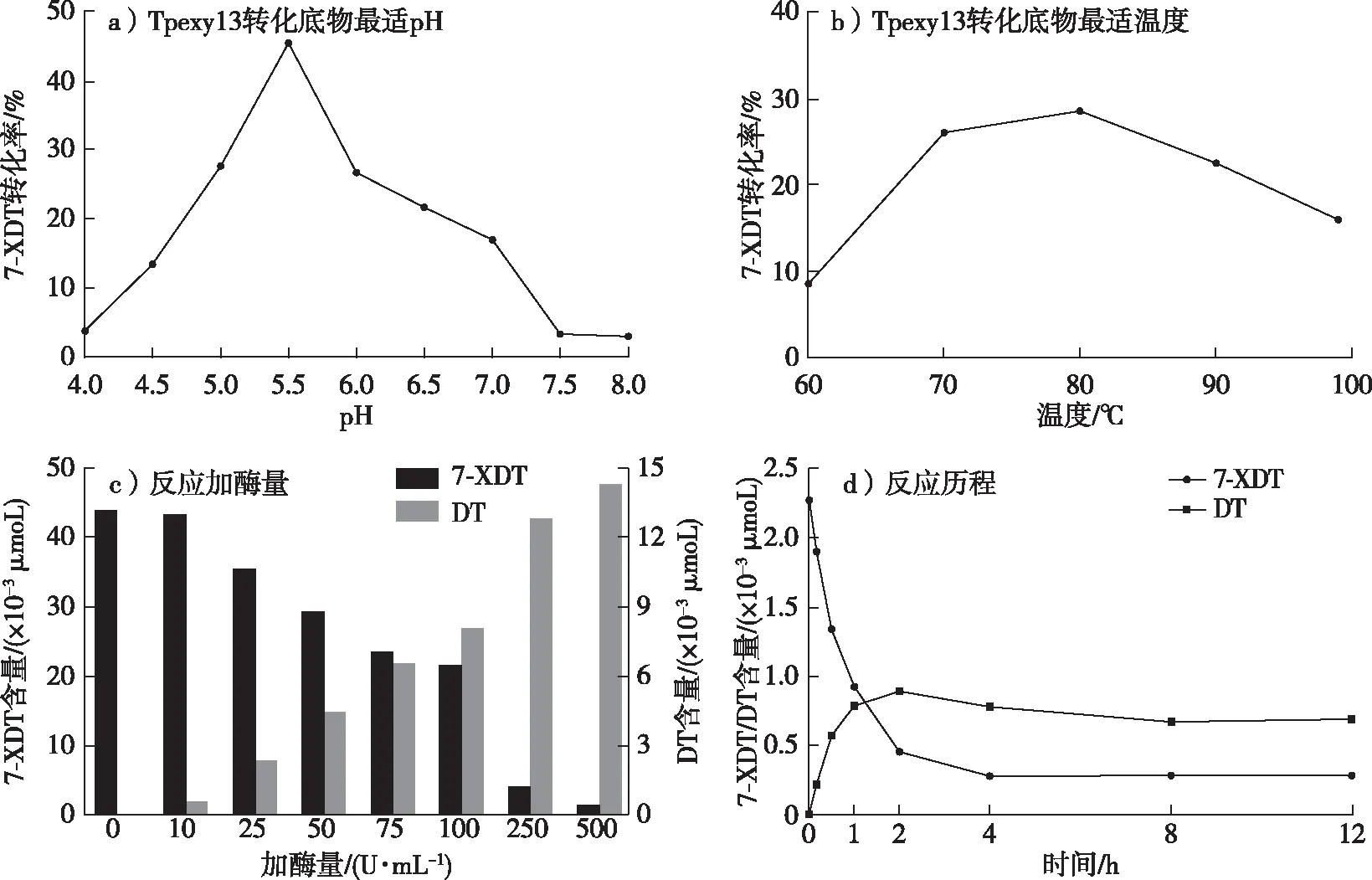
圖6 重組酶Tpexyl3轉化7-XDT生成10-DT反應條件優化Fig. 6 Optimization of reaction conditions for the transformation of 7-XDT to 10-DT by recombinant enzyme Tpexyl3
3 結 論
1)將分子伴侶蛋白質粒與目的蛋白質粒在大腸桿菌中共表達,經篩選后發現伴侶蛋白dnaK-dnaJ-grpE能成功幫助嗜熱菌T.petrophilaDSM 13995來源的β-木糖苷酶Tpexyl3正確折疊,提高目的蛋白可溶性表達量。經優化,Tpexyl3的表達量最高可達190 U/mL。研究結果為提高大腸桿菌表達系統中目的蛋白的可溶性表達,提供了一種較為可行的方法。
2)Tpexyl3能有效轉化7-XDT生成10-DT,在pH 5.5、80 ℃、酶用量 250 U/mL等適宜條件下反應4 h,可將500 mg/L 7-XDT轉化為162 mg/L 10-DT,物質的量轉化率為45.59%。下一步將通過酶的定向改造、催化轉化體系等方法進一步優化,提高7-XDT轉化為10-DT的效率,為以7-XDT為底物制備紫杉醇的技術創新提供支撐。

