UCP2在COPD患者中的表達及與T淋巴細胞亞群的相關性研究①
趙晨旭,楊曉東,馬雪梅,鮑文華
(1.佳木斯大學,黑龍江 佳木斯 154007;2.佳木斯大學附屬第一醫院呼吸與危重癥醫學科,黑龍江 佳木斯 154003)
解偶聯蛋白2(UCP2)是廣泛分布于人類及嚙齒類動物脂肪、肺、腦、胃腸道、脾和胰腺等器官組織線粒體內膜上的陽離子載體蛋白,其具有將線粒體氧化磷酸化解偶聯調節氧化應激、保護組織器官免受氧化損傷等作用[1]。近年來,UCP2與呼吸系統疾病的關系逐步受到關注,已經有研究表明UCP2參與肺癌、肺動脈高壓、急性肺損傷等多種肺部疾病的發生發展。慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以持續氣流受限為特征的肺部慢性疾病,其發病機尚不完全明確,目前已知與炎癥機制、氧化應激、蛋白/抗蛋白酶失衡、免疫功能異常等有關。進一步研究COPD的發病機制對控制疾病的進展及改善預后至關重要,故本文對UCP2在COPD患者中的表達及其與T淋巴細胞亞群之間的相關性進行研究,分析UCP2在COPD發病機制中的作用,現報道如下。
1 資料與方法
1.1 一般資料
實驗組選擇2019-05~2020-04在佳木斯大學附屬第一醫院住院治療的COPD急性加重期患者,所有患者均符合2019年GOLD指南中COPD的診斷標準。其中,患者表現為咳嗽、咳痰,呼吸困難加重者設為急性加重期組,共60例;前組患者經治療臨床癥狀緩解,恢復到本次發病前狀態,設為穩定期組,共60例。對照組選取符合納入標準的同時期正常體檢健康成年人30例。COPD患者組和健康對照組年齡分別為(68.17±5.43)歲、(63.86±7.95)歲,其中COPD組男33例、女27例; 健康對照組中,男16例,女14例。年齡、性別構成比差異無統計學意義(P>0.05)。本實驗經院倫理委員會審查、批準通過后實施。每一位受試者對實驗目的、內容等知情并同意后入選。
1.2 藥品及試劑
人解偶聯蛋白酶2(UCP2)ELISA檢測試劑盒購自于上海信帆生物科技有限公司;鼠抗人免疫熒光染色CD3+FITC/CD4+PE、CD3+PE/CD8+FITC單克隆抗體及FACS紅細胞溶血劑紅細胞裂解液均購自美國BD(Becton Dickinson)公司;人外周淋巴細胞分離液購自于北京索萊寶科技有限公司。
1.3 方法
COPD急性加重期組、COPD穩定期組和健康對照組分別于入院后首日晨、出院前一日晨和體檢當日晨行肺功能、血氣水平和血漿UCP2水平、外周血T淋巴細胞亞群CD4+(%)、CD8+(%)及CD4+/CD8+比值檢測。
1.3.1 肺功能檢測: 采用德國Jaeger ms-los digital肺功能檢測儀常規檢測FVC(Al/Pd %)、FEV1(Al/Pd %)、FEV1/FVC(Al %),以3次測定值中最高值作為最終肺功能測定值。
1.3.2 血氣分析: 安靜、呼吸穩定狀態下,不吸氧狀態或標注吸氧濃度,股動脈或橈動脈采血,立即采用德國西門子CA164型血氣分析儀檢測氧分壓(PaO2)和二氧化碳分壓(PaCO2)。
1.3.3 血漿UCP2水平檢測: 空腹抽取肘靜脈血2mL,置于二胺四乙酸(EDTA)抗凝管中,混勻后2h內4℃離心分離血漿(3000r/min,15min)置于-80℃冰箱中保存。按照人解偶聯蛋白酶2(UCP2)ELISA檢測試劑盒說明書方法操作,采用美國BioTektronix公司Epoch2微孔板酶標儀型酶標儀進行血漿UCP2水平檢測。
1.3.4 外周血T淋巴細胞亞群檢測 空腹肘靜脈采血2mL,應用美國BD公司FACS Calibur 流式細胞儀上機檢測,使用Simu1SET型軟件分析結果,報告CD4+(%)、CD8+(%),計算CD4+/CD8+比值。
1.4 統計學方法

2 結果
2.1 COPD患者肺功能及血氣指標的變化
COPD各組FEV1(Al/Pd %)、FEV1/FVC(Al %)、PaO2(mmHg)明顯低于健康對照組(P<0.01),穩定期組FEV1(Al/Pd %)、FEV1/FVC(Al %)、PaO2(mmHg)明顯高于急性加重期組(P<0.01)。COPD各組PaCO2(mmHg) 明顯高于健康對照組(P<0.01),穩定期組明顯低于急性加重期組(P<0.01)。見表1。
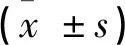
表1 3組COPD患者肺功能、血氣的變化
2.2 COPD患者外周血T淋巴細胞CD4+(%)、CD8+(%)、CD4+/CD8+、UCP2水平的變化
COPD各組外周血CD4+(%)、CD4+/CD8+比值明顯低于健康對照組(P<0.01),穩定期組明顯高于急性加重期組(P<0.01);COPD各組CD8+(%)、血漿UCP2明顯高于健康對照組(P<0.01、P<0.05),穩定期組明顯低于急性加重期組(P<0.01)。見表2。
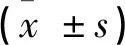
表2 COPD患者外周血UCP2水平、CD4+(%)、CD8+(%)、CD4+/CD8+比值的變化
2.3 COPD患者外周血UCP2含量與FEV1(Al/Pd %)及T淋巴細胞亞群相關性分析
COPD患者外周血血漿UCP2含量與FEV1(Al/Pd %)、外周血CD4+(%)及CD4+/CD8+比值均呈明顯負相關(P<0.01);與外周血CD8+(%)呈明顯正相關(P<0.01)見表3。

表3 COPD患者外周血血漿UCP2含量與T淋巴細胞亞群的相關性分析
3 討論
COPD發病率在我國呈逐年上升趨勢,目前20歲及以上人群COPD的總體患病率為8.6%,40歲及以上人群為13.7%[2]。世界衛生組織預計到2020年因COPD致死人數將位居全球第三,成為位于世界疾病經濟負擔第五位的疾病。COPD是以持續氣流受限為特征的慢性疾病,本實驗中COPD患者均存在明顯的氣流受限以及血氣指標改變,且以急性加重期最著,經過治療后肺功和血氣指標能得以改善,符合FEV1反映氣流受限程度且與COPD進展的嚴重程度相關的結果,再次證明FEV1是判斷患者預后的最佳指標之一。
COPD的發病機制復雜,現仍不能完全明確。有研究指出免疫機制和細胞因子失調共同參與COPD的發生發展,其中又以表達于CD4+的輔助細胞(TH)及調節性T細胞(Treg)等細胞免疫調節失衡尤為突出[3,4]。已有相關實驗發現COPD患者外周血CD4+細胞、CD4+/CD8+比值較正常對照組減少,CD8+細胞較對照組增加,反映機體免疫調節失衡,且與疾病進展程度相關,本實驗結果與之相符。此外,T淋巴細胞亞群的改變還與FEV1%預計值、FEV1/FVC%具有相關性,這可能由于T淋巴細胞減少使其對Th1、Th17的抑制作用降低,致機體高免疫應答,氣道及肺組織受損引起肺功能下降[5]。COPD的發病機制中存在自身免疫反應的參與。UCP2作為一種線粒體內膜質子載體蛋白,具有減少胰島素分泌、調節脂肪酸代謝、抗神經元凋亡等功能,且目前已有多項研究表明UCP2可通過調控Toll樣受體4介導的ROS信號,激活ROS依賴的ERK和p38通路形成正反饋環路[6~8]等途徑抑制ROS生成,在改善氧化應激損傷中發揮了重要作用。鑒于此,本實驗對各組血漿UCP2進行測定,COPD各組血漿UCP2明顯高于健康對照組(P<0.01),穩定期組明顯低于急性加重期組(P<0.01),說明UCP2參與COPD的發生發展過程。本實驗結果提示在COPD的進程中機體可能通過高表達UCP2 以抑制ROS生成,改善COPD患者的氧化應激損傷,這可能是UCP2在COPD疾病發生發展過程中發揮保護作用的機制。已有學者對受刺激T細胞中UCP2的表達模式和上調的時間進行研究發現UCP2參與免疫應答[9],本實驗中COPD患者外周血血漿UCP2含量與外周血CD4+(%)及CD4+/CD8+比值均呈明顯負相關(P<0.01),與外周血CD8+(%)呈明顯正相關(P<0.01),說明 COPD患者血漿UCP2與T淋巴細胞亞群存在相關性,這可能由于高表達的UCP2抑制了ROS生成,從而調節T細胞的功能活動,影響COPD的發生發展。此外,本實驗中COPD患者外周血血漿UCP2含量與FEV1%預計值呈明顯負相關,說明檢測UCP2含量或可作為判斷COPD患者病情、轉歸及預后的重要指標之一。
綜上所述,UCP2在COPD發病機制中扮演著重要角色,檢測COPD患者血漿UCP2含量或可作為另一判斷患者病情、轉歸及預后的重要指標,并為COPD的治療提供新的靶點。

