BRCA1和人線粒體轉錄終止因子3在非小細胞肺癌組織中的表達情況
楊天真 楊 軍 邱瑞成 王春梅
(四川省綿竹市人民醫院病理科,綿竹市 618200,電子郵箱:yangs_book@163.com)
非小細胞肺癌約占全球癌癥死因的80%,發病率及死亡率均居惡性腫瘤首位[1]。部分非小細胞肺癌患者確診時已為中晚期,已經不能進行手術治療,化療或放療是治療此類患者的主要方法。因體質的差異,不同患者對放療、化療的敏感性存在很大差異,根據生物標記物為患者選擇合適的治療方案不但可以提高療效,還可以減少不必要的毒副作用[2]。BRCA1蛋白是一種抑癌因子,參與惡性腫瘤的發生和發展,臨床上常用于非小細胞肺癌的診斷和預后判斷[3]。人線粒體轉錄終止因子3(human mitochondrial transcription termination factor 3,hMTERF3)基因編碼的蛋白質,屬于一種負調控細胞因子,可以在細胞內結合啟動子的序列元件,抑制基因轉錄,降低線粒體呼吸鏈酶活性[4]。本研究探究BRCA1和hMTERF3在非小細胞肺癌組織中的表達情況及其與患者病理特征的相關性,旨在為非小細胞肺癌患者的治療提供參考依據。
1 資料與方法
1.1 臨床資料 選取2017年10月至2018年10月在我院接受手術治療的70例非小細胞肺癌患者作為研究對象。納入標準:所有患者均經過手術病理確診;所有患者均符合2014版《NCCN非小細胞肺癌臨床實踐指南》[5]的診斷標準。排除標準:病歷資料不全者;心腎肺等功能不完全者;心腦血管疾病患者;并發其他惡性腫瘤患者。其中男性38例、女性32例,年齡48~69(57.3±7.6)歲;病理分期Ⅰ期12例,Ⅱ期22例,Ⅲ期20例,Ⅳ期16例。
1.2 研究方法
1.2.1 標本制作:術中留取癌組織標本以及距離癌組織5 cm以上的癌旁組織標本,使用4%中性福爾馬林固定后行常規石蠟包埋,厚度為3 cm,連續切片作免疫組化標記。
1.2.2 免疫印跡法檢測BRCA1、hMTERF3蛋白表達水平:取癌組織與癌旁組織標本,磷酸緩沖鹽溶液清洗標本3次后,采用分離緩沖液裂解0.5 h獲取蛋白,測定蛋白濃度。以20 μg/孔蛋白質上樣,進行十二烷基硫酸鈉—聚丙烯酰胺凝膠電泳,電泳結束進行轉膜,用10%的牛奶將轉有蛋白的膜在搖床上常溫封閉1.5 h;BRCA1(Abgent公司,批號:A-AO1812a,)、hMTERF3(Abnova公司,批號:H00050650-M)一抗孵育(稀釋比均為1 ∶1 000)37℃過夜,TBST洗膜后室溫孵育BRCA1、hMTERF3二抗(Hycult公司,批號:HM1002-01、HM1002-08;稀釋比均為1 ∶5 000)1 h,TBST洗膜后,加入顯影劑顯色(北京鼎國昌盛生物技術有限責任公司,批號:WB-0312),以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)為內參,采用凝膠圖像處理系統分析目的蛋白的相對表達量。
1.2.3 免疫組化染色:將待測標本進行脫蠟、水化后,浸泡在95℃ 0.01 mol/L的枸櫞酸緩沖液中,并進行熱修復,3%的H2O2培育20 min后,滴入山羊血清10 min后進行封閉,在25℃~27℃環境下孵育30 min,棄封閉液,加入BRCA1(Abgent公司,批號:A-AO1812a)、hMTERF3(Abnova公司,批號:H00050650-M)一抗,5℃孵育過夜,次日加入BRCA1、hMTERF3二抗(Hycult公司,批號:HM1002-01,HM1002-08),37℃恒溫箱中孵育30 min,磷酸緩沖鹽溶液沖洗后進行二氨基聯苯胺顯色、脫水、封片處理。所有病理切片均由2位以上經驗豐富的醫師采用雙盲法進行觀察并作出診斷。隨機選擇5個視野,根據染色程度和染色細胞百分比進行評估:陽性細胞數<10%為(-),10%~25%為(+),>25%~75%為(++),>75%為(+++)。
1.3 統計學分析 采用SPSS 21.0軟件進行統計學分析。計量資料以(x±s)表示,兩組間比較采用兩獨立樣本t檢驗或配對t檢驗,多組比較采用方差分析;計數資料以例數表示。以P<0.05為差異具有統計學意義。
2 結 果
2.1 癌組織和癌旁組織中BRCA1、hMTERF3蛋白表達水平的比較 BRCA1蛋白主要表達于細胞核,陽性表現呈棕褐色或淺褐色;hMTERF3主要表達于細胞質,陽性表現為棕褐色或褐色。癌組織中BRCA1、hMTERF3蛋白相對表達水平均高于癌旁組織(均P<0.05),見表1和圖1、圖2。
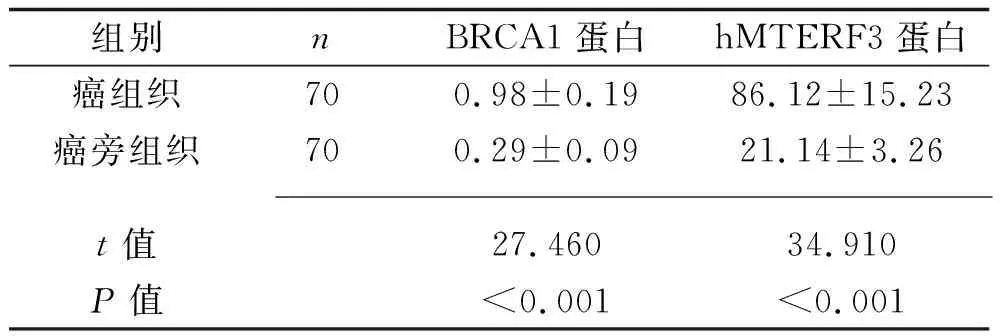
表1 癌組織、癌旁組織中BRCA1、hMTERF3蛋白相對表達水平的對比(x±s)

圖1 BRCA1和hMTERF3蛋白在癌組織及癌旁組織中的表達
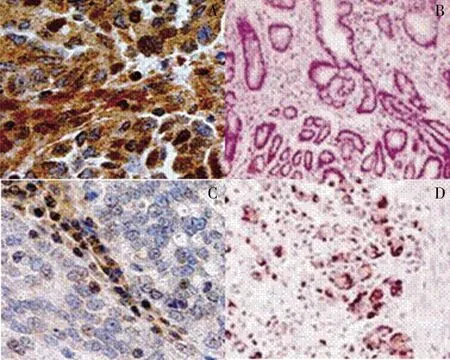
圖2 癌組織及癌旁組織中BRCA1和hMTERF3蛋白的免疫組化染色結果(×200)注:圖A、B分別為癌組織中BRCA1和hMTERF3蛋白癌旁組織的BRCA1檢測免疫組織化結果,圖C、D分別為癌組織、癌旁組織的hMTERF3檢測免疫組化結果。
2.2 不同病理特征患者癌組織中BRCA1、hMTERF3蛋白表達水平比較 侵及漿膜、腫瘤體積≥5 cm3、病理分期為Ⅲ+Ⅳ期、有淋巴結轉移、低分化的患者BRCA1、hMTERF3蛋白相對表達水平分別高于未侵及漿膜、腫瘤體積<5 cm3、病理分期為Ⅰ+Ⅱ期、無淋巴結轉移、中或高分化的患者(均P<0.05),見表2。

表2 不同病理特征患者癌組織中BRCA1、hMTERF3蛋白相對表達水平的比較(x±s)
3 討 論
據最新統計結果顯示,肺癌的發病率、死亡率位居全球癌癥首位[6-7],嚴重影響人類健康。在我國,肺癌屬于高發病,發病率、死亡率一直居高不下,在癌癥死亡病因中位居第一,并且發病呈年輕化趨勢[8]。非小細胞肺癌占所有肺癌的85%[9],但部分非小細胞肺癌患者在確診時已經屬于晚期,手術切除已經無法有效根治,只能通過化療或放療改善患者癥狀[10]。但因個體差異,術后輔助化療、放療或單獨化療、放療的個體獲益有所不同[11-12]。尋找肺癌放療、化療的敏感性和耐藥性相關基因,有助于對肺癌患者進行個體化治療,從而減少毒副作用、提高治療效果[13-14]。
有研究顯示,BRCA1、表皮生長因子受體、胸苷酸合成酶等分子標志物在預測非小細胞肺癌放療、化療敏感性等方面具有重要意義,在指導非小細胞肺癌患者個體化治療中發揮著重要作用[15]。BRCA1基因作為轉錄調控基因,C末端有酸性氨基酸,N末端有鋅指結構區,是一種與雙鏈DNA損傷修復相關的抑癌基因[16]。BRCA1基因所編碼的蛋白在DNA的損傷修復中扮演著重要角色,參與基因的轉錄調節、細胞凋亡、周期調控等過程[17]。在評估非小細胞肺癌化療藥物的療效時,BRCA1表達水平是非常重要的參考指標。有研究顯示,化療藥物的療效與BRCA1表達水平有關,如BRCA1基因呈低表達的肺癌患者對鉑類藥物較為敏感,BRCA1基因呈高表達時則機體易耐藥[18]。因此,了解BRCA1因子的特點及其在非小細胞肺癌中的表達情況,對選擇敏感的化療藥物有重要意義[19]。
hMTERF3基因定位于人類第8號染色體長臂,是唯一一個人類線粒體轉錄終止因子,其由10個內含子和11個外顯子組成[20]。hMTERF3基因編碼的蛋白產物共有417個氨基酸,其在人類惡性腫瘤、線粒體糖尿病、神經退行性疾病等線粒體相關疾病的診斷與治療中均具有重要的臨床意義[21]。
本研究結果顯示,相較于癌旁組織,非小細胞肺癌組織中BRCA1、hMTERF3呈現異常高表達,腫瘤體積大、侵及漿膜、病理分期為Ⅲ及Ⅳ期、有淋巴結轉移、低分化的非小細胞肺癌患者BRCA1、hMTERF3蛋白相對表達水平更高(P<0.05),說明BRCA1、hMTERF3可能與非小細胞肺癌的發生和發展密切相關。
綜上所述,BRCA1、hMTERF在非小細胞肺癌組織中呈現異常高表達,且與病理參數具有一定相關性,兩者或在非小細胞肺癌的發生和發展中發揮重要作用。

