腫瘤間質比在Ⅱ、Ⅲ期結直腸癌患者預后評估中的價值
李騰飛 楊彥 黃陳
結直腸癌(colorectal cancer,CRC)是全球范 圍內最常見的腫瘤之一[1],據中國國家癌癥中心2015年的癌癥統計數據顯示,CRC的發病率和死亡率在所有惡性腫瘤中分別位居第3位和第5位,Ⅱ期CRC比例約占25%,其中約15%~25%的患者出現復發[2],且大約有1/5的患者在首診時就存在著遠處器官轉移[3]。目前國際上統一使用TNM病理分期系統,但是出現了同一分期的不同患者預后有差異,ⅡB期患者的預后比ⅢA期患者差,在某些情況下導致Ⅱ期患者治療不足,Ⅲ期患者治療過度的情況。上述情況說明傳統的臨床病理高危因素不能很好地確定CRC預后差和高復發風險患者。而對于手術成功的結直腸癌患者來說,Ⅰ期結直腸癌根治患者5年復發率為5%,Ⅱ期為12%,Ⅲ期則為33%[4]。研究發現,腫瘤的侵襲生長受腫瘤微環境中的腫瘤細胞和腫瘤間質的互相協同作用,基于此,腫瘤間質比(tumor stroma ratio,TSR)的概念應運而生。TSR是指腫瘤組織內腫瘤細胞和腫瘤間質的比值,最早由Mesker提出,并指出其在大腸癌中具有臨床意義[5]。目前TSR已在多種上皮實體類腫瘤,如CRC、乳腺癌、胃癌、食管癌等都已有報道[6-8],然而TSR對II、Ⅲ期CRC預后預測價值仍存在爭議[9-10],鑒于此,本文旨在探討TSR對Ⅱ、Ⅲ期CRC患者預后評估中的指導價值。
資料與方法
一、一般資料
收集上海交通大學附屬第一人民醫院胃腸外科2014年1月~2018年12月期間經術后病理證實的Ⅱ、Ⅲ期CRC患者的臨床資料、術后病理和隨訪結果等,并進行回顧性分析。共納入820例Ⅱ、Ⅲ期CRC患者,年齡24~95歲,平均年齡(65.6±12.0)歲,其中<65歲372例,≥65歲448例;女性353例,男性467例;Ⅱ期497例,Ⅲ期323例;T1+T2期150例,T3+T4期670例;N0期495例,N1+N2共325例;神經侵犯606例,無神經侵犯214例;脈管浸潤559例,無脈管浸潤261例;高分化66例,中低分化754例;腫瘤直徑<5cm510例,≥5cm310例;右半結腸癌274例,左半結腸和直腸癌共546例;黏液腺癌103例,腺癌717例。
二、納入與排除標準
1.納入標準:(1)經活檢病理組織學證實的CRC;(2)完全治愈性切除(R0切除);(3)Ⅱ期(T3-4、N0、M0)或Ⅲ期(任何T、N1-2、M0);(4)年齡≥18歲。
2.排除標準:(1)新輔助治療(纖維化的形成影響腫瘤和基質的數量);(2)CRC病史或曾罹患其他惡性腫瘤,由于長期治療或早期原發腫瘤轉移的可能影響了CRC的預后;(3)多發性結腸腫瘤,其預后相對更差,需要不同的治療方法;(4)術后3個月內死亡的患者歸因于合并癥或手術并發癥。
三、切片掃描方法
將新鮮手術切除標本用福爾馬林固定、石蠟包埋后并將腫瘤浸潤最多的組織制成5 μm厚的HE染色玻片,利用KF-PRO系列全自動數字切片掃描系統中KF-PRO-120型號數字切片掃描儀,全視野數字病理切片(whole-slide image,WSI)以KFB格式導出,利用K-Viewer瀏覽軟件可實現圖片的放大,最大可至1 600倍。共完成Ⅱ、Ⅲ期CRC患者820張HE切片的掃描。
四、TSR評估方法
WSI圖片先在K-Viewer軟件X10倍下找到腫瘤浸潤明顯的區域,確保選取區域四周都有腫瘤組織包繞,然后在X40倍鏡下導出最具有侵襲性的圖片,每張WSI圖片從感興趣的區域(ROI)至少導出3張圖片,取平均值同時得出TSR數值。(詳見圖1)。當黏液壞死組織區域出現在符合我們評分標準的視野內時,黏液壞死組織區域被排除在外。兩位經驗豐富的病理學家對導出的圖片整個腫瘤區域的TSR進行視覺評估,在沒有一致結果的情況下,第三位病理學家介入并提供決定性意見。統計分析以50%作為截斷值,患者根據TSR被分為“高TSR組”(TSR>50%)和“低TSR組”(TSR≤50%)[5]。

圖1 從WSI圖中導出3張最具有侵襲性的區域,病理學家行視覺評估TSR
五、隨訪方式
所有患者均通過門診或電話隨訪等方式進行隨訪,隨訪至2019年7月31日或患者死亡截止。研究過程中排除了失訪病例。生存時間定義為初次手術至患者死亡或隨訪截止,統計患者5年總體生存率。
六、統計學方法
應用SPSS 24.0軟件進行統計學分析,采用COX回歸模型進行單因素和多因素分析,確定對預后有獨立影響的因素;采用Kaplan-Meier法繪制生存曲線并計算生存率,生存率比較采用Log-Rank檢驗。P<0.05為差異有統計學意義。
結 果
一、隨訪及生存情況
820例Ⅱ、Ⅲ期CRC患者的隨訪資料完整,隨訪時間為1~68個月,中位隨訪時間為32個月。820例Ⅱ、Ⅲ期CRC患者中,高TSR組307例,低TSR組513例,五年總生存率為81.3%(667/820),男性和女性分別為78.9%和74.8%;<65歲和≥65歲的五年生存率為分別為90.3%和72.9%;高分化和中低分化的五年生存率分別為95%和79.7%;Ⅱ期和Ⅲ期的五年生存率分別為78.9%和73.4%;T1+T2期和T3+T4期分別是89.7%和78.4%;N0和N1+N2分期的五年生存率分別為87.4%和69.7%;腫瘤最大徑<5 cm和≥5 cm的五年生存率分別為78.4%和80.8%;右半結腸癌和左半+直腸癌的五年生存率分別為73.9%和84%;神經侵犯和神經未侵犯的五年生存率分別為69.1%和84%;脈管浸潤和脈管未浸潤的五年生存率分別為68.5%和86.6%;黏液腺癌和腺癌的五年生存率分別為85.6%和80%。
二、腫瘤間質比與患者臨床病理特征的相關性分析
本研究將入組患者的TSR高、低與其臨床資料進行比較,發現TSR高的患者的臨床指標與TSR低的患者差異均無統計學意義(均P>0.05)。(見表1)。

表1 Ⅱ、Ⅲ期CRC患者TSR與臨床病理相關因素分析[例(%)]
三、間質高和間質低Ⅱ、Ⅲ期CRC患者總體生存率的差異
Kaplan-Meier生存曲線分析顯示,TSR低的Ⅱ、Ⅲ期CRC患者的5年總體生存率為83.2%(427/513),TSR高的Ⅱ、Ⅲ期CRC患者的5年總體生存率為76.2%(243/307)。Log-Rank檢驗顯示,TSR低組的Ⅱ、Ⅲ期CRC患者總體生存率顯著高于TSR高組(χ2=7.991,P=0.0047)。(見圖2)。
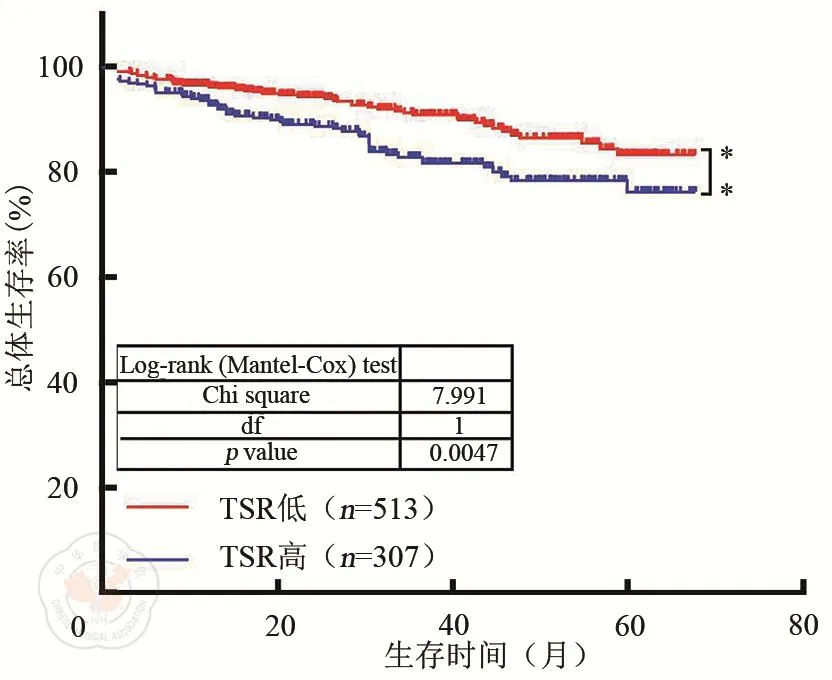
圖2 TSR高和TSR低Ⅱ、Ⅲ期CRC患者總體生存率比較
四、Ⅱ、Ⅲ期CRC患者總體生存率影響因素分析
單因素COX回歸分析顯示,年齡、TNM分期、T分期、N分期、淋巴結轉移、神經侵犯、脈管浸潤、腫瘤分化狀態和TSR與Ⅱ、Ⅲ期CRC患者的總體生存率有顯著相關性(P<0.05);多因素COX分期顯示,年齡、腫瘤位置、脈管浸潤和TSR是Ⅱ、Ⅲ期CRC患者總體生存率的獨立危險因素(P<0.05)。(見表2、3)。

表2 Ⅱ、Ⅲ期CRC患者總體生存率影響因素的單因素COX回歸分析
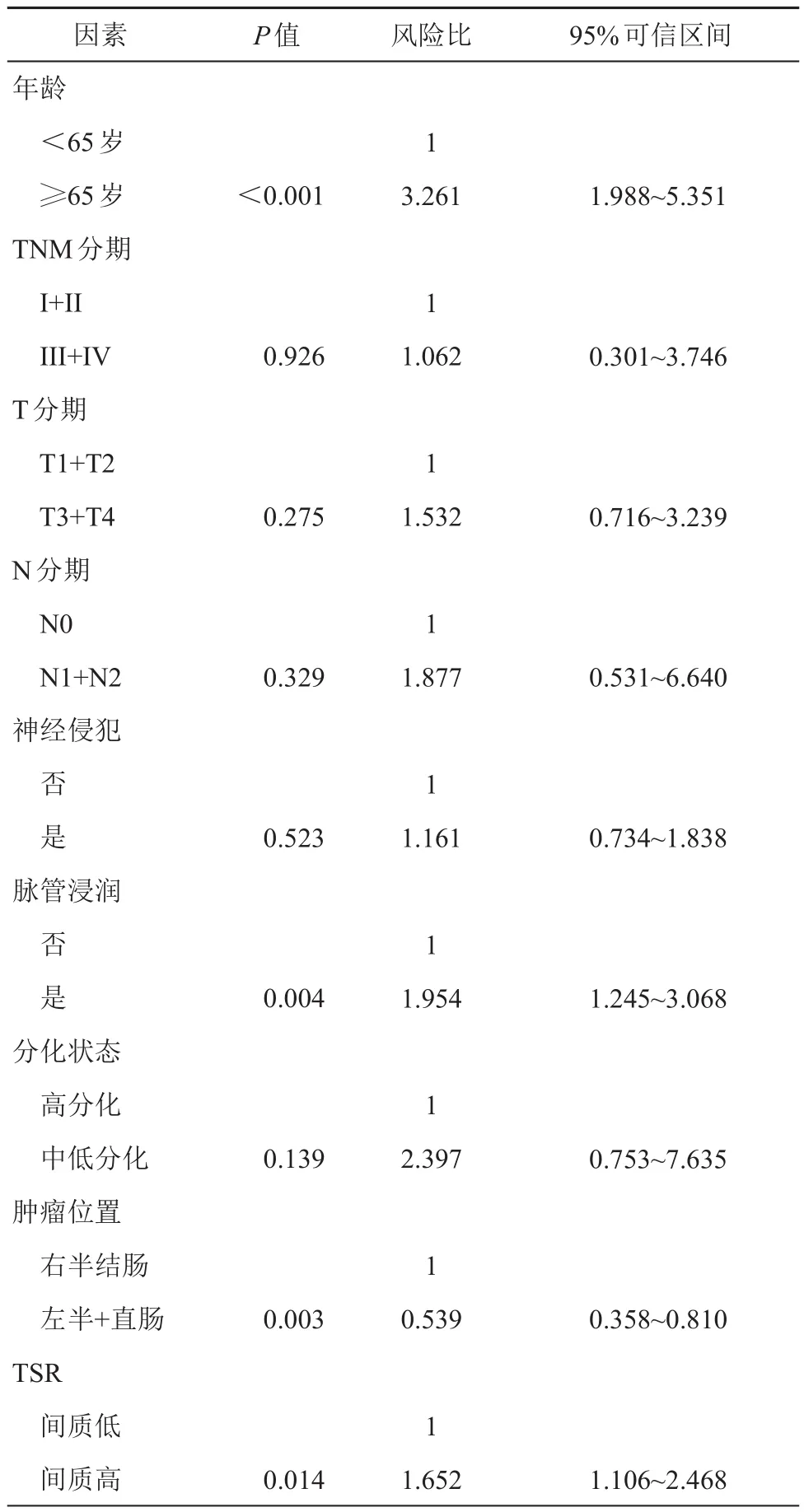
表3 Ⅱ、Ⅲ期CRC患者總體生存率影響因素的多因素COX回歸分析
討 論
腫瘤微環境包括腫瘤實質細胞、間質細胞、細胞外基質和細胞分泌的細胞因子等,其在腫瘤的發生、發展和轉移中起著重要作用。腫瘤微環境在腫瘤行為中起著積極的作用,通過與腫瘤細胞相互作用影響腫瘤的進展和腫瘤的轉移能力,研究認為TSR可能反應了這種相互作用。鑒于現有對TSR的研究,CRC不應只根據腫瘤細胞特征進行分類,還應根據腫瘤微環境特征進行分類,目前已經有學者證實TSR與CRC患者的預后相關,并且可作為獨立的預后因素,高TSR組的CRC患者預后不良。TSR是CRC強有力的獨立預后工具,為目前臨床使用的TNM分類提供了額外的價值。
目前根據國際TNM病理分期標準,同一期的不同患者預后有很大差異,有的Ⅱ期CRC的患者預后比Ⅲ期CRC患者預后差,表明現有的TNM分期不能很好的發現某些潛在的“高危”患者[11]。此外針對CRC的治療,很多需要手術治療后進行輔助放化療,預防腫瘤復發和轉移,而輔助治療的方案和時間取決于TNM分期,而目前的TNM分期也不能完全精準的預測CRC患者對輔助放化療的敏感性。基于此,我們從腫瘤微環境出發,在病理學水平尋找更有臨床價值的高危因素。大量研究表明原發性腫瘤中TSR是一個很有潛在價值的腫瘤預后因素[12-13],TSR高的患者預后更差。
我們回顧了上海交通大學附屬第一人民醫院的2014年至2018年的Ⅱ、Ⅲ期CRC患者,在腫瘤浸潤前沿的常規蘇木精和伊紅染色石蠟切片上評估TSR。Kaplan-Meier生存曲線分析顯示,TSR低組Ⅱ、Ⅲ期的5年總體生存率為83.2%(427/513),TSR高組Ⅱ、Ⅲ期的5年總體生存率為76.2%(243/307),Log-Rank檢驗顯示,TSR低組總體生存率顯著高于TSR高組(χ2=7.991、P=0.0047)。我們研究證明了TSR在Ⅱ、Ⅲ期CRC的預后意義。目前由于TSR識別的簡單性和可靠性,在當前的常規病理學診斷中,TSR的實施醫療負擔較輕,且成本較低。
目前針對II、Ⅲ期CRC患者,指南建議可以輔助卡培他濱單藥或者卡培他濱聯合奧沙利鉑治療,這種組合已顯示出顯著改善無病生存率和總生存率的極大價值[14]。目前國內外指南均認為輔助化療中增加奧沙利鉑只能使高危復發風險Ⅱ期患者受益,因此我們需要尋找Ⅱ期CRC中高危亞群患者。NCCN指南推薦[15]在高危Ⅱ期腸癌中應用含奧沙利鉑的輔助化療方案,對于不含高危因素的中危和低危Ⅱ期腸癌患者,推薦觀察或單藥卡培他濱治療。對于Ⅲ期CRC輔助化療是主要及絕對適應證,也是目前CRC輔助化療的主要受益人群。NCCN指南認為所有Ⅲ期結腸癌患者都需要輔助化療。2018年的NCCN指南基于IDEA研究結果[16]指出:(1)低危Ⅲ期CRC患者輔助化療首選包括CAPOX 3個月或FOLFOX 3~6個月;(2)高危Ⅲ期CRC患者輔助化療首選包括CAPOX 3~6個月或FOLFOX 6個月,對于Ⅲ期患者如何區分高危和低危,IDEA研究指出這種根據TNM分期進行危險分層方法具有很大的局限性。基于我們的研究表明TSR可以作為Ⅱ、Ⅲ期CRC患者預后獨立的因素,可以為將來的Ⅱ、Ⅲ期CRC進行高危因素亞組分組,推薦TSR高的Ⅱ期CRC進行卡培他濱聯合奧沙利鉑輔助化療方案,推薦TSR高的Ⅲ期CRC進行6個月輔助化療,這將為Ⅱ、Ⅲ期CRC患者的輔助化療提供精準方案。
有學者研究表明[17],TSR高組的Ⅱ期CRC輔助化療可明顯改善患者預后,TSR低組的Ⅲ期CRC通常不需要輔助化療。也有學者研究探索性分析表明[18],在以奧沙利鉑為基礎的靜脈化療中加入貝伐單抗后,TSR低組的腫瘤的DFS和OS顯著縮短,而TSR高組的腫瘤則相反,在TSR高組的腫瘤中觀察到了有益的趨勢。這些研究表明,TSR在Ⅱ、Ⅲ期CRC乃至其他惡性腫瘤中具有重要預后價值[13]。我們的多因素COX分期研究結果表明,年齡、腫瘤位置、脈管浸潤和TSR是Ⅱ、Ⅲ期CRC患者總體生存率的獨立危險因素(P<0.05),這和國外學者[11]報道具有一致性。
我們的研究對TSR在Ⅱ、Ⅲ期CRC中預后判斷得出了初步的結論,TSR高組的Ⅱ、Ⅲ期CRC的預后明顯比TSR低組的CRC患者預后差,TSR可以作為Ⅱ、Ⅲ期CRC評估患者獨立預后的指標。TSR有望為CRC的TNM分期提供有力補充,并為Ⅱ、Ⅲ期CRC患者輔助放化療提供精準的方案。

