BMSCs對IRI大鼠腎小管病理、ROCK蛋白水平的影響
孫瑞華,都 渝,鮑巧玲
急性腎衰竭(Acute Renal Failure,ARF)在臨床上非常多見,占ICU的10%~30%,雖然腎臟替代治療技術有了很大的提高,但在過去的10年內病死率仍然在50%以上[1]。缺血再灌注損傷(Ischemia Reperfusion Injury,IRI)是臨床上導致缺血性ARF的主要原因之一,在腎移植過程中IRI不可避免,且會影響術后腎功能恢復,引起急、慢性排斥反應,也會影響移植物長期的存活[2],因此,研究IRI的病理生理過程,探索其中的分子生物學機制,尋找有效的保護和干預措施具有重要意義[3]。Gholamreza等[4]研究發現,在心臟、肝臟、腎臟和肺中注入骨髓間充質干細胞(Bone Marrow Mesenchymal Stem Cells,BMSCs)可減輕器官的IRI。BMSCs和其它細胞相比獲得的渠道更廣,并且分離后更容易傳代培養[5]。Zare等[6]證實,BMSCs可有效的治療腎小管損傷,主要的治療機制為BMSCs能分化腎小管的上皮細胞,并且促進腎內細胞的增殖,從而改變細胞因子的環境和旁分泌水平。Rho相關卷曲螺旋形成蛋白激酶(Rho Associated Coiled Coil Forming Protein Kinase,ROCK)又稱Rho激酶,屬于絲氨酸/蘇氨酸激酶,與Rho組成Rho/ROCK信號[7],研究發現ROCK與干細胞生物學密切相關[8]。ROCK信號活化在干細胞的增殖、遷移、分化及干性維持等方面發揮重要作用[9]。研究顯示[10],ROCK信號主要與BMSCs的成骨分化、角化細胞分化、神經系統損傷修復和遷移有關,而ROCK在腎組織中的表達還尚不明確,本研究建立腎IRI大鼠模型,對模型大鼠進行BMSCs移植,分析其對大鼠的腎小管病理影響,觀察ROCK蛋白在腎組織中的表達并分析BMSCs對ROCK蛋白的調控情況。
1 材料和方法
1.1 實驗動物 本實驗所用雄性大鼠共30只,購自廣東省醫學實驗動物中心,生產許可:SCXK(粵)2013-0002。所有大鼠均健康沒有任何疾病,體質量在180~200 g之間,大鼠常溫下適應性飼養7 d。
1.2 試劑和儀器 ROCK抗體(美國Sigma公司);DMEM-F12、10%胎牛血清(美國Gibco公司);DAPI、TUNEL檢測試劑盒(上海羅氏制藥有限公司);電熱恒溫水浴箱(北京長安科學儀器廠);圖像掃描儀(美國A1pha公司)。
1.3 BMSCs的分離、培養、鑒定和標記 分別取出大鼠的股骨和脛骨的骨髓,用Percoll分離液進行分離,全部過程要求在無菌條件下進行。用胎牛血清的DMEM-F12懸浮液將細胞懸浮,放置在37 ℃、5% CO2孵育箱中培養。48 h后,棄掉未貼壁的細胞,當所有的細胞長到80%時,將細胞進行消化并轉代,進行擴增培養,多次進行傳代后對細胞進行純化處理。流式細胞儀檢測第三代細胞CD34、CD44、CD45和CD166的表達,細胞活力采用臺盼籃染色方法進行測定。取出3~6代大鼠的BMSCs后,加入無菌DAPI,最終的濃度為50 mg/mL,37 ℃孵育30 min后進行離心處理,用PBS溶液進行洗滌,6次后將沒有完全結合的DAPI全部除去。收集離心后的細胞用無血清的DMEM-F12進行稀釋,將稀釋后的細胞用熒光顯微鏡觀察,當DAPI顯示為藍色熒光時,冰浴保存,1 h后將細胞注入到大鼠的體內。
1.4 動物分組與模型建立 把實驗所用的30只健康大鼠隨機分為三組,sham組為假手術組,IRI組為腎IRI大鼠模型組;BMSCs組為腎IRI大鼠模型加BMSCs干預組,每組各10只。所有大鼠術前禁食12 h,用2%的戊巴比妥鈉溶液腹腔注射麻醉,大鼠固定在操作臺上,用恒溫加熱墊控制大鼠的體溫保持在37 ℃,沿大鼠的腹部中位線切開,分離大鼠的左側腎蒂,用無損傷的血管夾阻閉腎蒂,并用定時器進行計時,用4-0絲線進行間斷縫合,暫時關閉大鼠腹腔。阻斷左側腎蒂1 h后,把血管夾移除,開放腎動脈血流,可觀察到腎臟迅速或在短時間內由暗黑色逐漸變為鮮紅色,表示再灌注成功。Sham組大鼠除不用血管夾阻閉腎蒂外,其它的手術步驟同另外兩組相同。手術后三組大鼠連續注射3 d青霉素溶液,以防止術后感染。
再灌注1 h后,將4×106個BMSCs制作成1 mL的細胞懸浮液,經大鼠的尾靜脈注射;sham組和IRI組大鼠注射1 mL的生理鹽水,三組大鼠連續注射7 d進行后續實驗。
1.5 標本采集 用10%的水合氯醛溶液腹腔注射麻醉所有大鼠,每只大鼠取心臟內全血3 mL,放置在抗凝管內靜置,4 ℃靜置6~8 h,7 000 r/min離心5 min,分離血漿用以檢測血肌酐(Serum Creatinine,SCr)和尿素氮(Blood Urea Nitrogen,BUN)含量。取部分的腎臟組織,用于大鼠的腎組織病理檢測、細胞增殖、凋亡檢測及蛋白檢測。
1.6 生化指標檢測 分別取出大鼠的血清,對三組大鼠的SCr和BUN進行檢測。用苦味酸法檢測大鼠的SCr水平,酶法測定大鼠的BUN水平,所有的步驟嚴格按照試劑盒的說明書進行。
1.7 腎組織病理學形態觀察 對三組大鼠的生化指標檢測后,分別處死大鼠,取出大鼠腎臟組織,用甲醛固定梗死組織,固定24 h后切片,石蠟切片的厚度為4 μm,脫蠟后進行HE染色并觀察。
1.8 免疫組化(SP)檢測腎小管上皮細胞增殖細胞核抗原的表達 將腎組織石蠟包埋后進行切片處理,并對切片組織進行脫蠟和脫水處理,用枸櫞酸緩沖液緩沖后放置在高溫的微波爐中進行修復,時間為20 min。將山羊血清加入其中,封閉后加入一抗,將其放置在4 ℃的環境中過夜,然后加入二抗,最后用DAB和蘇木素進行染色,脫水后進行透明處理,用中性樹膠將其封片,最后會發現呈棕黃色的陽性產物。在高倍顯微鏡下,隨機選取每個切片的20個清晰視野,對增殖細胞核抗原(Proliferating Cell Nuclear Antigen,PCNA)陽性細胞進行計數。PCNA=陽性細胞數/所有細胞的總數×100%。
1.9 TUNEL檢測腎小管上皮細胞凋亡 取出大鼠的腎組織,分別切成0.5 cm的塊狀,將塊狀組織固定后用石蠟進行包埋,最后把塊狀的組織進行切片。用TUNEL法把石蠟切片進行染色,所有的步驟按照試劑盒上的說明嚴格進行。每張石蠟切片選取5個不交叉的視野進行觀察,凋亡的心肌細胞為深棕色。
1.10 Western Blot檢測大鼠RhoA和ROCKⅠ蛋白的表達 將三組大鼠的腎組織分別提取100 mg,將細胞進行裂解并提取核蛋白,并對核蛋白的濃度進行測量,分裝后,保存在-20 ℃的環境中。將提取出的蛋白溶液和緩沖溶液進行混勻,按照4∶1的比例進行,為了讓蛋白質變性需將蛋白溶液全部進行煮沸處置。在電泳板內分別注入50 μm的蛋白樣品,把電泳后的樣品轉移到PVDF膜上,加入脫脂奶粉后封閉,時長為1 h。加入一抗后進行TTBS漂洗,每次漂洗10 min,漂洗3次,最后加入二抗對溶液進行稀釋,常溫的環境中封閉1 h。取出PVDF膜,TTBS每次漂洗10 min,漂洗3次,DAB溶液顯色后數碼相機照相。
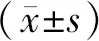
2 結果
2.1 三組大鼠生化指標比較 IRI組大鼠的生化指標SCr和BUN水平顯著高于sham組(tSCr=7.850,tBUN=23.61,均P<0.001);BMCSs組大鼠的SCr和BUN水平明顯低于IRI組大鼠(tSCr=6.031,tBUN=12.58,均P<0.001),表1,圖1。

表1 三組大鼠SCr和BUN生化指標比較


圖1 三組大鼠SCr和BUN生化指標比較與sham組比較,*P<0.05;與IRI組比較,#P<0.05
2.2 三組大鼠的腎組織病理學形態比較 Sham組大鼠的腎小管和腎小球的結構沒有任何損傷現象。與sham組比較,IRI組大鼠的腎小管出現了嚴重損傷,腎小管的官腔有明顯的擴張現象,腎小管上皮細胞也出現了腫脹和壞死現象,管型呈紅細胞或顆粒狀,腎間質有大量的出血和水腫。和IRI組大鼠比較,BMSCs組大鼠的腎單位損傷較輕,腎組織情況得到了明顯的改善,圖2。

圖2 三組大鼠腎組織病理學變化(HE染色,×400)
2.3 三組大鼠腎小管上皮細胞PCNA的比較 和sham組比較,IRI組大鼠PCNA陽性表達顯著降低(t=5.774,P<0.001);BMSCs組大鼠的陽性細胞數量顯著多于IRI組大鼠(t=3.979,P<0.001),提示BMSCs能有效的促進腎小管上皮細胞的增殖,加快腎臟組織修復,圖3、圖4。

圖3 三組大鼠免疫組化染色比較腎小管上皮細胞增殖(免疫組化染色,×400)

圖4 三組大鼠PCNA陽性表達比較與sham組比較,*P<0.05;與IRI組比較,#P<0.05
2.4 三組大鼠腎小管上皮細胞凋亡 與sham組比較,IRI組大鼠腎小管上皮細胞出現大量的凋亡(t=14.80,P<0.001);BMSCs組大鼠腎小管上皮細胞的凋亡數量得到顯著抑制(t=9.079,P<0.001),圖5、圖6。

圖5 三組大鼠腎小管上皮細胞凋亡(TUNEL染色,×400)

圖6 三組大鼠腎小管上皮細胞凋亡情況比較與sham組比較,*P<0.05;與IRI組比較,#P<0.05
2.5 Western Blot檢測大鼠RhoA蛋白和ROCKⅠ蛋白表達比較 與sham組大鼠的比較,IRI組表達顯著增加(tRhoA=3.631,tROCKⅠ=3.258,均P<0.05);BMSCs組大鼠的RhoA蛋白和ROCKⅠ蛋白表達顯著低于IRI組(tRhoA=2.543,tROCKⅠ=2.627,均P<0.05),圖7、圖8。

圖7 三組大鼠RhoA蛋白和ROCKⅠ蛋白表達

圖8 三組大鼠RhoA蛋白和ROCKⅠ蛋白表達比較與sham組相比較,*P<0.05;與IRI組比較,#P<0.05
3 討論
IRI是指組織缺血后的再灌注不能緩解組織損傷,反而加重組織結構破壞和代謝障礙,其可能的機制有氧自由基生成、能量代謝障礙、炎性遞質含量和活性改變等[11]。腎臟急性IRI是發生急性腎功能衰竭的重要危險因素,急性腎功能衰竭致死率高,治愈率低,一部分患者在治療后會長期存在腎功能不全或發展至終末期腎病[12]。缺血和缺氧等多種因素都會引起腎小管損傷,當腎小管上皮細胞內聚集大量的代謝終產物或者外源性的化學物質時,會引發細胞的毒性反應,損傷腎小管功能,嚴重時會導致腎小管出現急性壞死,甚至導致腎功能衰竭[13]。所以,在臨床上找到有效治療腎臟IRI的方法是目前的研究熱點。BMSCs是成體干細胞中的一種,目前己被證實在組織損傷中具有良好的保護作用。本研究建立腎臟IRI大鼠模型,移植BMSCs干預后觀察大鼠腎小管病理改變,以及腎組織中ROCK蛋白的表達。
腎臟功能會隨著腎臟IRI的發生而降低,而機體血清中BUN和SCr的水平能有效的反應腎功能變化[14]。腎小球的濾過率會隨著腎功能不全而逐漸降低,腎小管重吸收和分泌功能出現障礙會聚集過多的含氮代謝產物,進而會增加血液中非蛋白氮含量。本研究結果顯示,IRI組大鼠的SCr水平和BUN水平顯著增高;BMCSs組大鼠的SCr和BUN水平明顯低于IRI組大鼠。提示,BMSCs可有效抑制IRI大鼠血液中非蛋白氮的含量,并且降低BUN水平,從而改善大鼠腎功能。腎組織病理結果顯示,IRI組大鼠腎小管出現了嚴重損壞,腎小管的官腔有明顯擴張現象,其上皮細胞出現了腫脹和壞死的現象,管型呈紅細胞或顆粒狀,腎間質大量出血和水腫。與IRI組大鼠比較,BMSCs組大鼠的腎單位損傷較輕,腎組織情況得到了明顯的改善。提示BMSCs移植對大鼠腎小管結構的破壞有一定的防護作用,同時有效的改善了IRI導致的腎損傷,為BMSCs移植用于臨床治療提供了理論依據。劉紅等[15]通過對IRI大鼠研究發現,低氧預處理后的BMSCs移植,對改善IRI大鼠的腎功能更為有效,同時還能對腎組織損傷進行有效修復,這種修復能力可能與其分泌HGF和bFGF等有關。
真核細胞DNA在合成時需要一種核蛋白,而PCNA就是其中最重要的一種[16]。當細胞在靜置狀態時,其中PCNA含量非常低;當細胞進入增殖周期時,PCNA表達會顯著增高,所以可以用PCNA的表達來反應細胞的增值狀態,細胞增值的活躍程度也可以用PCNA表達的高低來反映[17]。本研究發現,BMSCs移植后該組大鼠的PCNA陽性細胞數量顯著增加。王志劍等[18]通過對急性缺血腎損傷的大鼠研究發現,移植BMSCs后大鼠腎小管上皮細胞PCNA陽性細胞數量顯著多于對照組,PCNA是評價細胞增殖狀態的一個較為成熟的指標,因此,提示BMSCs移植可以促進缺血性損傷后腎小管細胞的增殖,更有助于缺血性損傷后腎小管結構完整性的維持與修復。
Rho激酶是參與細胞運動的主要激酶之一,調節細胞的分裂、遷移、分泌等活動。Rho高表達和過度激活與許多心臟、腎臟血管疾病密切相關,ROCK是最早發現的Rho效應物,在分子水平,ROCK表達上調促進炎癥、氧化應激、血栓形成和纖維化的各種因子,下調內皮型一氧化氮合酶。在細胞水平ROCK介導血管平滑肌細胞收縮,促進增殖和遷移;在腎臟中主要以ROCK-Ⅰ形式存在,ROCK-Ⅰ抑制劑能抑制腎臟纖維化,進而改善IRI。本研究結果顯示,與sham組大鼠RhoA蛋白和ROCKⅠ蛋白表達比較,IRI組大鼠的表達顯著增加;BMSCs組大鼠RhoA蛋白和ROCKⅠ蛋白表達顯著低于IRI組。可見,移植BMSCs可有效的抑制RhoA蛋白和ROCKⅠ蛋白表達,從而保護腎臟IRI。李忠偉等[19]研究發現,BMSCs移植和Rho/Rock信號通路阻斷劑均可促進脊髓修復及神經功能的恢復,且BMSCs移植聯合Rho/Rock信號通路阻斷劑具有更好的療效,兩者之間存在一定的協同效應。孟建中等[20]通過對IRI大鼠研究發現,阻斷Rho/Rock信號通路可有效的改善IRI內皮免疫微環境,減輕腎組織損傷。
綜上,BMSCs可有效保護腎臟IRI導致的腎小管損傷,同時抑制腎組織中ROCK蛋白表達,從而對腎臟起到保護作用。

