迭代重建技術結合低劑量掃描在CT 引導肝癌微波消融術中的運用
袁 回,李 達,徐瑞瑞,張 巖
肝癌是我國最常見的腫瘤之一,大多數患者確診時已經失去手術切除的機會,在延長患者生存期的局部治療中,肝癌的介入治療尤為重要[1-2]。 肝癌微波消融(MWA)手術具有創傷小、費用低、術后恢復快、及手術時間短等優勢[3-6]。 在單發小肝癌的治療中,能夠達到與肝切除術治療相同的效果[7],即便是在大肝癌失去手術切除機會的患者中,也能獲得令人滿意的局部控制效果[8]。 由于CT 掃描的速度快,對小病灶檢出率高,對碘油沉積、氣體等顯示清晰[9-10],目前CT 引導下肝癌MWA 手術在臨床上應用已經非常成熟[5]。 但是CT 存在電離輻射,在引導肝MWA 手術中需要多次掃描,這對于患者所接受的輻射劑量是疊加的[11-12]。 含有金屬成分的MWA針會使CT 圖像存在較為嚴重的偽影。 探討迭代重建技術(iDose4)結合低毫安值掃描能否提高CT 圖像質量,減少患者輻射是本文研究的目的。
1 材料與方法
1.1 一般資料
回顧性分析我院2019 年4—8 月進行CT 引導肝癌MWA 治療的患者205 例。 根據患者治療時CT 掃描毫安值及圖像重建方式的不同,將其分為對照組84 例(標準重建+200 mAs)、iDose4組59 例(iDose4+200 mAs)、低劑量組62 例(iDose4+140 mAs)。
1.2 方法
1.2.1 成像方法 各組患者均在Philips Brilliance Big Bore CT 引導下行肝MWA 手術,并隨機選用維京、長城、億高3 家MWA 治療儀。所有患者均無CT增強掃描,除毫安值及圖像重建方式不同外,其他掃描參數完全一致,管電壓120 kV,層厚5 mm,層間距5 mm,FOV 350 mm,螺距0.94。 對照組、iDose4組、 低劑量組患者分別采用管電流200 mA 和標準算法、200 mA 和iDose4算法、140 mA 和iDose4算法掃描重建CT 圖像。 選取微波針到達腫瘤區域為針到位層面、進針前及拔針后的腫瘤區域圖像為進針前層面和拔針后層面。
1.2.2 圖像評價分析
1.2.2.1 客觀評價 在飛利浦后處理工作站,采用軟組織窗(窗寬60、 窗位360)分別對進針前層面、針到位層面、拔針后層面的圖像進行測量,測量的興趣區(ROI)大小為(50±3) mm2放在同層腹主動脈和背景區域上,并避開血管邊緣及偽影區,記錄腹主動脈的平均CT 值為CT血管,標準差SD 為SD血管,背景區的平均CT 值為CT背景。圖像噪聲SD 采用腹主動脈SD血管,計算信噪比(SNR)和對比噪聲比(CNR):SNR=CT血管/SD血管CNR=(CT血管-CT背景)/SD血管。分別記錄對照組、iDose4組、低劑量組的SD、SNR、CNR。
1.2.2.2 主觀評價 由2 名主治醫師職稱及以上介入科醫師采用雙盲法進行對圖像評判,出現分歧請上級醫師綜合分析并達成共識。 考慮到主動脈,下腔靜脈,腫瘤區域、正常肝實質及肝臟相鄰器官的視覺顯著性,以5 點李克特量表對整體圖像質量進行了評分。5 分,圖像無任何偽影,噪聲少,上述5 種組織結構顯示非常清晰,能很好地引導手術進行;4分,圖像無偽影或少量金屬偽影,噪聲稍多,以上5種組織結構至少4 種顯示清晰,能較好地引導手術進行;3 分,圖像存在金屬偽影,噪聲多,以上5 種組織結構至少3 種顯示良好,且不影響微波手術進行;2 分,圖像存在較多金屬偽影,噪聲多,以上5 種組織結構多個顯示欠清,但根據多個層面分析,能勉強引導手術進行;1 分,圖像金屬偽影非常嚴重,以上5 種組織結構顯示不清楚,不能引導手術進行,需重新掃描。
1.2.3 輻射劑量分析 分別收集每例患者進針前、針到位、 拔針后這3 個序列的CTDIvol、DLP、ED 及掃描層數,DLP 與ED 分別表示每例患者3 個序列DLP 總和與ED 總和。有效劑量ED=DLP×K,K 為腹部轉換系數,采用歐洲CT 質量標準指南腹部平均值為0.015。 分別收集對照組、iDose4組及低劑量組每例患者的CTDIvol、DLP、ED。
1.3 統計分析
運用SPSS Statistics 17.0 軟件對各項數據進行統計學分析,所有數據用k-s 檢驗是否為正態分布。除微波針型號、性別采用卡方檢驗以外,3 組患者其他數據采用單因素方差分析或者Kruskal-Wallis 檢驗比較組間主效應是否顯著,組間比較采用獨立樣本t 檢驗或非參數Mann-Whitney U 檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 一般情況評估
根據入組和排除標準共收集患者205 例,其中男166 例,女39 例;年齡為26~84 歲,平均(56.3±11.0)歲,根據患者治療時CT 掃描毫安值及圖像重建方式的不同,將其分為對照組、iDose4組、低劑量組,分別對3 組患者的性別、年齡、體重、身高、體質量指數(BMI)、體表面積(BSA)、掃描層數和微波針型號進行統計學分析,差異均無統計學意義(P>0.05)(表1)。
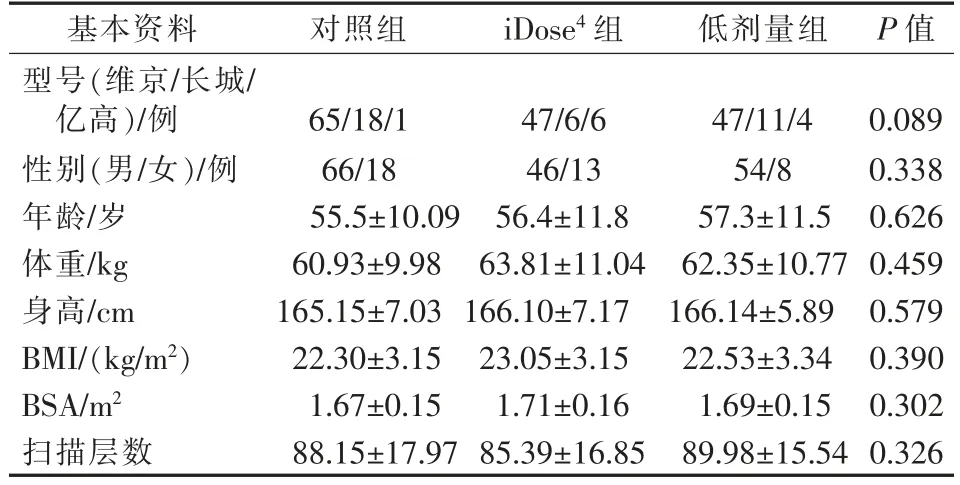
表1 3 組患者的基本資料統計學分析
2.2 圖像質量的客觀指標及主觀評分
客觀評分中,與對照組對比,iDose4組術中3 個序列圖像SD、SNR、CNR 及主觀評分的差異均有統計學意義(P<0.05);低劑量組針到位時圖像SD、SNR、CNR、主觀評分的差異有統計學意義(P<0.05),進針前、拔針后時圖像SD、SNR、CNR、主觀評分的差異無統計學意義(P>0.05)(見表2)。 主觀評分中,iDose4組的圖像質量明顯高于對照組(見圖1)。 低劑量組在消融針到位時圖像質量優于對照組(見圖2),進針前及拔針后時圖像質量無明顯差異(見圖3)。
2.3 輻射劑量
由于各組均采用固定的毫安秒及千伏值,對照組與iDose4組每次掃描的CTDIvol 均為11.8,兩組DLP、ED 差異無明顯統計學意義(P>0.05);而低劑量組的CTDIvol 為8.3,DLP、ED 差異均有統計學意義(P<0.05)(見表2)。
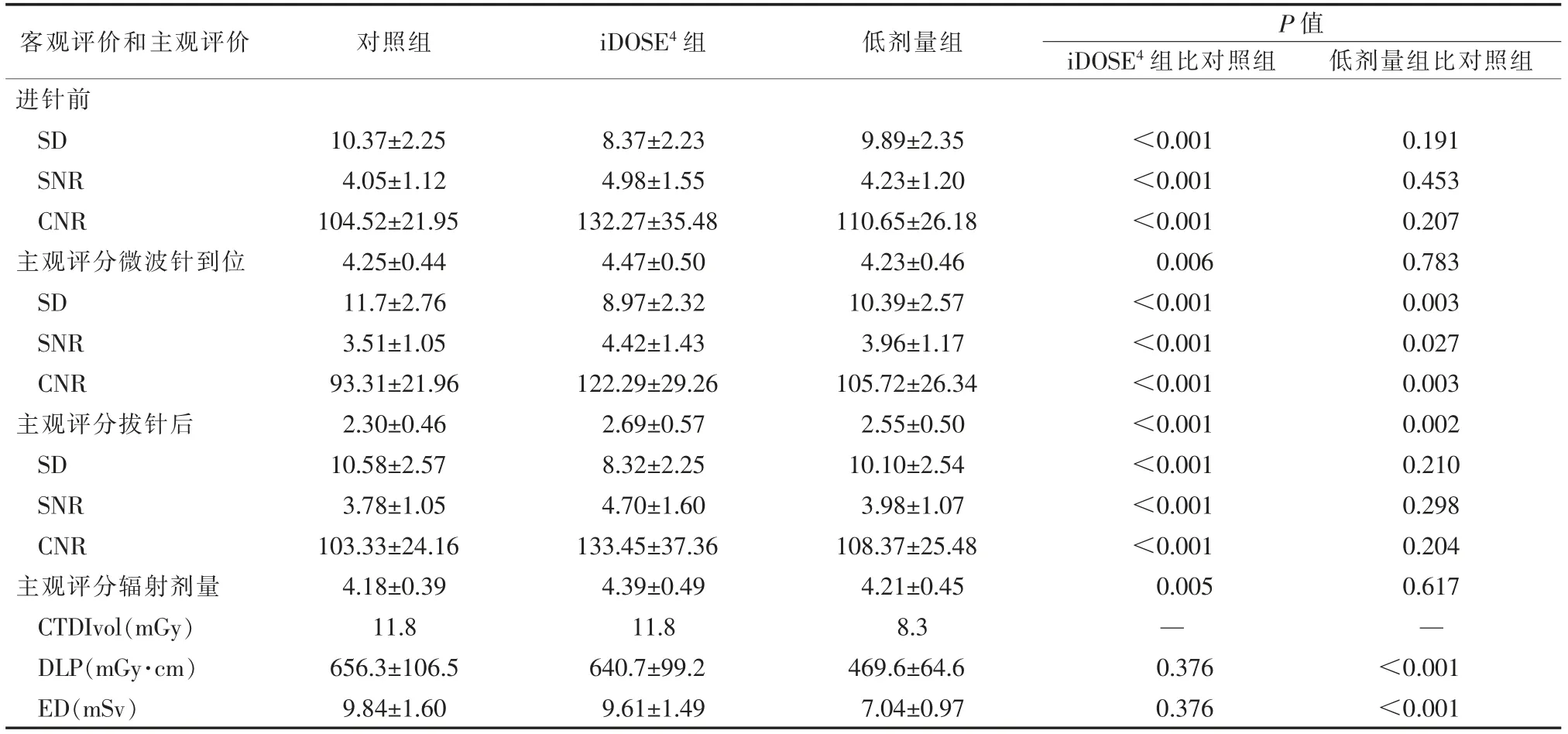
表2 3 組患者圖像SD、SNR、CNR、主觀評分及輻射劑量的比較
3 討論
3.1 迭代重建技術的發展
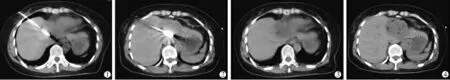
圖1 iDose4 組與對照組圖像質量比較

圖2 低劑量組與對照組進針到位時圖像質量

圖3 進針前與拔針后圖像質量比較
由于CT 技術的更新發展,在基于迭代重建的基礎上,目前有新一代軟件來用于降低圖像噪聲,減少圖像偽影。 有文獻指出[13-14]IMR(全模型迭代重建)能進一步降低圖像噪聲,提高圖像質量,減少患者的輻射劑量,但IMR 重建圖像存在失真現象。 金屬偽影去除技術(Orthopedic Metal Artifact Reduction,O-MAR)能更好地去除金屬偽影,但O-MAR 算法在減少金屬偽影的同時可能又會引入其它新的偽影。 研究顯示迭代去金屬偽影算法(iterative reconstruction algorithm and dedicated metal artifact reduction,iMAR)能減少MWA 針的金屬偽影,提高含有MWA針的圖像質量[15]。 每種新技術的運用都能更好地提高CT 圖像質量,但是隨著在臨床運用的普及,遇到的問題也需更進一步去歸納、總結及完善。
3.2 iDose4 重建技術對CT 引導下肝癌MWA 術的意義
iDose4重建是一種在投影空間和圖像空間均進行重建的方法,在重復迭代的過程中逐漸使圖像的噪聲數據減少,從而使圖像的質量得到提高,是目前改善圖像質量的普遍運用方法[13,16]。 有文獻報道iDose4在CT 檢查掃描時的運用能有效降低患者的輻射劑量,減少圖像噪聲,提高圖像的質量,包括在胸部、腹部、盆腔、肝臟、鼻竇不同部位及嬰幼兒心血管的運用[13,17-19]。 CT 是肝癌MWA 術常規引導方式之一,CT 圖像質量對肝癌MWA 術前路線的規劃,術中進針的引導,術后效果的評估都非常重要。由于MWA 針含有金屬材質,在術中進針的CT 掃描圖像上存在大量金屬偽影[15],另外因為病灶的位置、大小及術者的經驗水平的因素,術中CT 掃描次數又較多,隨之患者所受輻射劑量也相應增加。iDose4迭代重建技術結合低毫安值的運用,在保證了CT 圖像的質量不下降的前提下,減少了患者所受的輻射劑量。 此外在含有金屬偽影嚴重的針到位層面,低劑量組圖像的客觀指標及主觀評分均優于對照組,這與王茹等[20]報道的文獻iDose4重建技術借助了多噪聲模型可以抑制條帶狀偽影的生成,來減少TACE 術后肝內碘油沉積所致硬化偽影是一致的。
3.3 降低CT 引導肝癌MWA 患者的輻射劑量
有文獻報道可以通過導管鞘輔助穿刺技術來減少穿刺次數,雖然此文獻沒有報道輻射劑量方面的影響,但穿刺次數的減少可以直接減少CT 掃描次數,來降低患者的輻射劑量[9]。 有文獻報道在CT引導肝MWA 術中,在病灶有碘油沉積的患者,可以降低毫安值來減少患者的輻射劑量,但此方法會導致圖像的分辨率降低,圖像的整體質量下降,但運用iDose4重建技術,能夠很好的避免圖像質量降低等問題,在無碘油沉積病灶也能正常行低劑量的消融手術[21]。
綜上所述,iDose4重建技術能夠降低圖像噪聲,提高圖像的質量,結合低劑量掃描,能保證CT 圖像質量不下降且能有效降低患者的輻射劑量。 盡管有更新一代的IMR 迭代重建技術,但是作為普遍運用的iDose4迭代重建技術更加成熟,iDose4結合低劑量掃描在CT 引導肝MWA 術中的運用值得推廣。

