聯合血肌酐及抗腎小球基底膜抗體水平變化作為療效監測指標1例報道
尹德明,張會敏,陳小三,李紀陽,鄭玲玲△
首都醫科大學附屬北京潞河醫院:1.皮膚性病中心;2.腎內科,北京 101100;3.江蘇省免疫診斷工程技術研究中心,江蘇蘇州 215123
抗腎小球基底膜病是一種罕見的以影響腎臟和肺部基底膜毛細血管為主的小血管炎癥疾病,該病的特征為咯血、肺部浸潤、腎小球腎炎,以及體內可檢測到抗腎小球基底膜抗體(anti-GBM)。采用血漿置換、糖皮質激素和環磷酰胺等聯合治療,可有效清除或降低體內anti-GBM水平,從而減輕和改善腎臟和肺部的病變。臨床實踐中,如何有效監測患者治療效果并適時調整治療方案是一種挑戰。現報道1例通過連續觀測血肌酐和anti-GBM水平變化,從而實現患者治療效果監測的臨床病例。
1 臨床資料
患者,女,58歲,退休工人。因“不明原因肉眼血尿20余天,伴尿中泡沫增多”,于2018年9月12日入院。患者發育正常,神志清楚,飲食欠佳,睡眠尚可,近半個月體質量下降4 kg,否認高血壓、糖尿病、冠狀動脈粥樣硬化性心臟病及心腦血管疾病。尿常規檢查:潛血3+,蛋白3+,白細胞1+,紅細胞3 596/μL,白細胞243/μL;生化檢查:清蛋白36.7 g/L,血肌酐299 μmol/L,尿素氮11 mmol/L,尿酸428 μmol/L,C反應蛋白58.31 mg/L。尿微量清蛋白/尿肌酐檢查:尿微量清蛋白1 004.81 mg/L,尿微量清蛋白/尿肌酐比值2 014.18。抗核抗體篩查和自身抗體譜檢查(間接免疫熒光法):抗核抗體弱陽性。自身抗體譜定量檢測(化學發光法):anti-GBM強陽性(>400 RU/mL)。泌尿系超聲:雙腎實質回聲增強,右腎多發囊腫。結合患者自述、腎功能檢查及相關實驗室輔助檢查,臨床診斷為急進型抗腎小球基底膜病。入院后,生化復查顯示1周內血肌酐由299 μmol/L上升至460 μmol/L,患者病情進展較快。
患者自9月15日至10月4日,連續接受激素沖擊、免疫球蛋白輸注和血漿置換等治療措施。期間,激素0.5 g,每天1次,共3 d,沖擊逐漸減量,同時隔天開展血漿置換,合計10次。治療期間,以血肌酐和anti-GBM等指標水平改變作為患者腎功能改善及免疫治療和血漿置換療效監測的重要依據。9月21日,經過激素沖擊和4次血漿置換后,患者血肌酐和anti-GBM水平明顯下降至398 μmol/L和104.79 RU/mL。9月28日,在完成第3天甲潑尼龍0.5 g沖擊治療及另外4次血漿置換后,患者血肌酐和anti-GBM水平再次下降至374 μmol/L和62.59 RU/mL。10月10日,經過激素沖擊和8次血漿置換強化治療后,患者血肌酐和anti-GBM水平明顯下降至290 μmol/L和43.39 RU/mL,尿量正常,無肉眼血尿等,其臨床癥狀明顯改善,按醫囑準予出院,但需規律隨診。患者出院后,按照醫囑要求每兩周到醫院隨診直至2019年2月。期間,通過每天1次強的松60 mg口服和環磷酰胺靜脈滴注的方式繼續開展免疫抑制治療,同時輔以補鈣和利尿治療。在隨診治療期間,患者每隔兩周接受血肌酐和anti-GBM水平的監測,直至2019年2月11日結束治療。12月4日,患者anti-GBM水平已經明顯轉陰且低于檢測范圍最低限(>2 RU/mL),而血肌酐也下降到正常范圍以內(153 μmol/L)。患者的各項指征明顯改善。患者整個治療期間,血肌酐及anti-GBM水平變化見圖1。
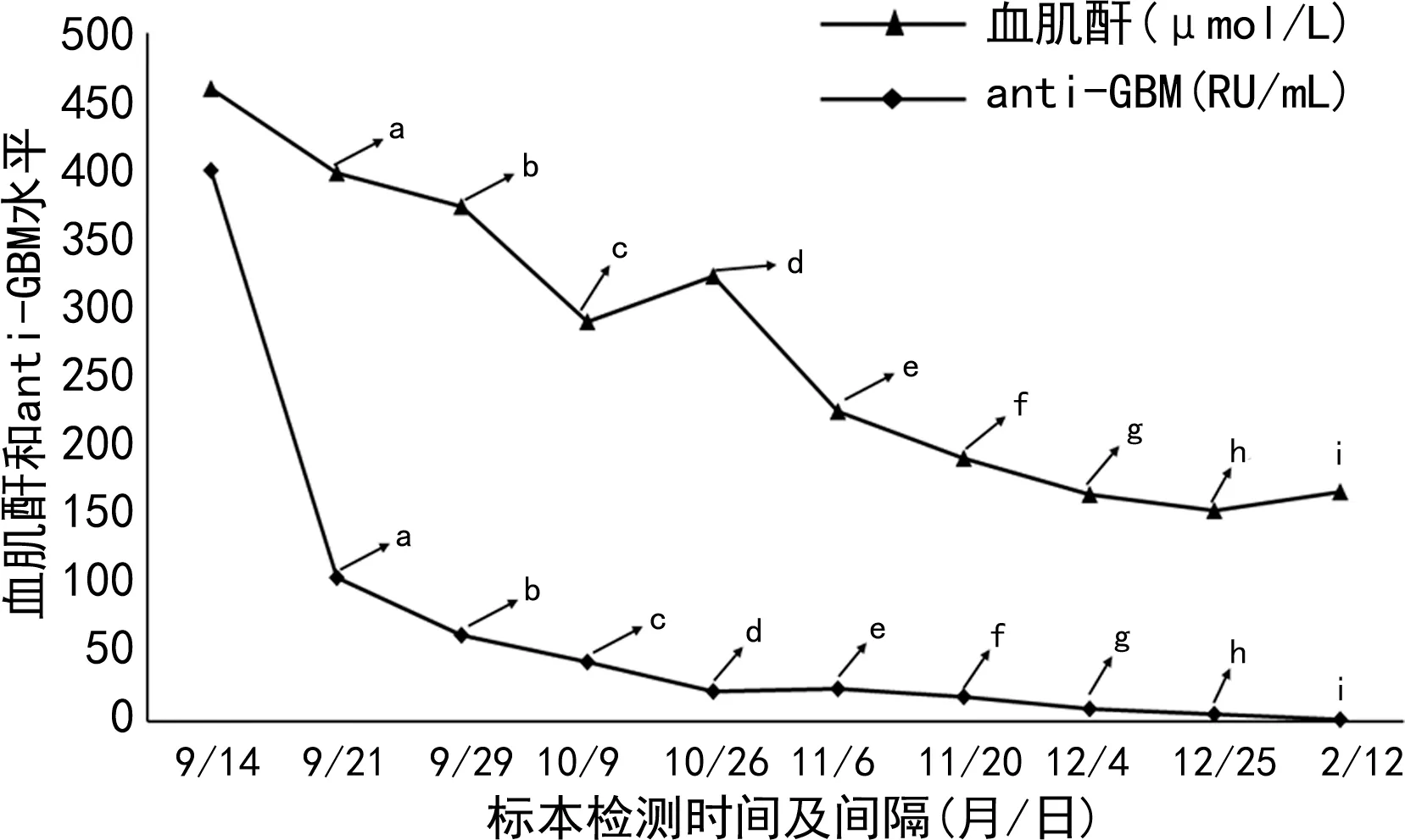
注:a為激素沖擊、免疫球蛋白輸注及血漿置換(共計4次)治療后測值;b為激素減量及血漿置換(共計8次)治療后測值;c為強的松口服、環磷酰胺靜脈點滴及血漿置換(共計10次)治療后測值;d~g為強的松口服及環磷酰胺靜脈點滴治療后測值;h~i為口服激素、補鈣和利尿治療后測值。
2 討 論
抗腎小球基底膜病是一類疾病進程發展迅速的自身免疫性疾病,該病每年發病率為1/1 000 000~2/1 000 000[1]。盡管該病發病率不高,但由于其主要受累腎小球和肺部毛細血管,可引起急性腎小球腎炎和肺泡出血等嚴重臨床表現,若不及時采取有效的治療措施,往往可能危及患者生命[2]。抗腎小球基底膜病的臨床診斷主要依靠腎功能檢查、腎臟病理活檢及自身抗體檢測等多個方面綜合判斷。患者一經診斷后往往需要采取強化治療方案,包括以快速清除致病性抗體為治療目的的血漿置換,同時輔以環磷酰胺和激素結合的免疫抑制治療,從而進一步抑制致病性抗體的持續產生和改善受累器官的炎癥[3]。正確的診斷和及時有效的治療措施對抗腎小球基底膜病患者的腎功能改善及良好的預后結果極其重要[4]。
由于抗腎小球基底膜病患者體內可以檢測到anti-GBM,因此該抗體已經成為抗腎小球基底膜病與其他腎臟疾病鑒別診斷的特征性指標[5]。目前,國內大部分臨床實驗室針對anti-GBM的實驗室檢測方法主要包括間接免疫熒光法(IFA)、免疫印跡法(IB)、酶聯免疫吸附試驗(ELISA)和磁微粒化學發光法(CLIA)等。IFA以靈長類腎組織切片為基質,存在操作繁瑣、結果判讀主觀性強及報告結果無法定量等明顯局限性。而IB和ELISA等方法采用傳統免疫檢測,同樣存在靈敏度低、檢測結果以定性為主和無法開展急診快速檢測等問題[6]。與上述方法學比較,采用重組抗原的磁微粒化學發光法在檢測anti-GBM時可實現全自動、定量及快速急診檢測,能夠更好地滿足臨床檢測的需求。本案例中,在疾病診斷時通過CLIA開展anti-GBM的定量檢測,結果顯示患者體內存在高水平的anti-GBM,抗體檢測結果為患者的明確診斷提供了重要的依據。在患者接受強化治療(包括血漿置換、激素沖擊及免疫抑制治療等)期間,對患者定期開展anti-GBM定量檢測,借助血肌酐和anti-GBM水平的改變情況,為臨床診療方案的調整提供重要依據。9月21日,患者經過第1輪激素沖擊和4次血漿置換后,anti-GBM水平出現了大幅度下降,但血肌酐仍顯示處于較高水平。為了盡快降低具有致病性的anti-GBM水平并改善腎功能,患者仍然需要維持激素沖擊和血漿置換的強化治療。10月9日,經過激素沖擊和8次血漿置換強化治療后,患者血肌酐水平明顯下降的同時,anti-GBM水平繼續呈下降趨勢。結合上述兩項指標的改善,針對患者的治療方案適時調整為口服激素和環磷酰胺免疫抑制治療。12月4日,患者血肌酐水平下降至正常值上限范圍,anti-GBM則由陽性轉為陰性,提示患者腎功能改善,且免疫治療效果良好。后續僅需定期開展激素口服、利尿和補鈣治療即可實現腎功能的維持。
綜上所述,本文報道了1例聯合血肌酐和anti-GBM水平作為治療效果監測的案例。患者為急進型抗腎小球基底膜病,在持續半年的診療過程中,血肌酐和anti-GBM水平隨著患者臨床癥狀的改善而呈現下降趨勢。目前,國內大部分臨床實驗室在開展anti-GBM檢測時仍然停留在傳統的定性方法學上,而定性檢測結果無法對患者治療效果持續監測,因此作者建議腎科醫生在針對抗腎小球基底膜病患者的診斷和治療過程中,應高度重視anti-GBM定量檢測的臨床意義和價值。

