小檗堿對糖尿病認知功能障礙模型小鼠AGEs/RAGE/NF-κB 信號通路的影響*
馬月娥,劉春秋
重慶三峽中心醫院,重慶 萬州404000
近年來,我國糖尿病的發病率日益增加,據統計,2015年我國糖尿病患病人數已經達到1.09億人,到2040年我國糖尿病患者數量將達到1.51億人[1-2]。糖尿病會引起認知功能障礙,已成為全球性醫學和公共衛生問題。據統計約有65%的2 型糖尿病患者伴有認知功能障礙[3-5]。但目前尚無治療2 型糖尿病伴認知功能障礙的有效藥物,因此亟待解決。相關研究發現AGEs/RAGE/NF-κB 信號通路是引起糖尿病伴認知功能障礙的重要機制[6-7]。小檗堿(Berberine)為黃連中主要有效成分,具有廣泛的藥理作用,如降血糖、降脂、降膽固醇、抗炎、抗菌和拮抗神經系統功能障礙的作用[8]。前期研究發現,小檗堿可緩解2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠學習記憶障礙,但尚不能確定其是否是通過調節AGEs/RAGE/NF-κB信號通路,進而改善認知功能障礙[9-11]。為進一步探明小檗堿改善糖尿病認知功能障礙的作用機制,本實驗擬采用腹腔注射鏈脲佐菌素(streptozotocin,STZ)建立糖尿病認知功能障礙模型,用Real time-PCR和Western bolt檢測海馬中晚期糖基化終末產物(advanced glycation end products,AGEs)、晚期糖蛋白終末產物受體(receptor for advanced glycation end products,RAGE)、核因子κB(nuclear factor-κB,NF-κB)的基因和蛋白的表達,以期為小檗堿改善糖尿病認知功能障礙提供實驗依據。
1 材料與方法
1.1 實驗動物70 只SPF 級雄性KM 小鼠,體質量為20~25 g,由湖北省實驗動物研究中心提供,實驗動物許可證號:SCXK(鄂)2015-0018。喂養條件:溫度控制在23~25℃,相對濕度控制在50%~60%。
1.2 藥品及試劑鏈脲佐菌素(streptozotocin,STZ)(美國Sigam 公司,批號:18883-66-4);小檗堿(上海源葉生物科技有限公司,純度:98%,批號:B21379);葡萄糖測定試劑盒、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)和白細胞介素1β(interleukin-1β,IL-1β)試劑盒(武漢伊萊瑞特生物科技股份有限公司,批號分別為EBC-K234、E-EL-R0019c、E-EL-R0012c);Trizol(美國Thermo Scientific,批號:15596018);Takara逆轉錄試劑盒(大連Takara 公司,批號:RR430S);SYBR Premix Ex Taq[TM](大連Takara 公司,批號:638319);一抗:AGEs(1∶1000)、RAGE(1∶1000)、NFκB(1∶1000),均為兔多克隆抗體(美國Santa Cruz 公司,批號分別為:sc-4527、sc-365154、sc-7178);二抗,HRP 標記山羊抗兔抗體(武漢谷歌生物技術有限公司,批號:20180516)。
1.3 實驗儀器EnVision 型多功能酶標儀(美國Perkin Elmer 公司),AL204 型電子天平(梅特勒-托利多儀器公司),DU730 型核酸蛋白分析儀(美國Beckman coulter 公司),CFX96 型實時熒光定量PCR 擴增儀(美國Bio-Rad 公司),Universal Hood Ⅲ型凝膠圖像成像分析系統(美國Bio-Rad公司)。
1.4 實驗方法
1.4.1 造模及分組 70 只小鼠適應性飼養1 周后,除空白組10只外,其他60只參考文獻[5]制作糖尿病認知功能障礙模型:造模組進食24 h后,一次性腹腔注射STZ 40 mg/kg,注射后第5 天禁食12 h后尾靜脈取血,測定葡萄糖含量,選取空腹血糖值大于11.1 mmol/L的小鼠,最終獲得符合條件的37 只小鼠為模型小鼠,分為模型組10 只,小檗堿低、中、高劑量組各9只。
1.4.2 給藥方法 小檗堿低、中、高劑量組分別按照按20、40、80 mg/(kg·d)的劑量灌胃小檗堿,模型組和空白組以等體積的生理鹽水灌胃,每日1次,持續給藥30天。
1.5 觀察指標
1.5.1 Morris水迷宮實驗 灌胃結束后12 h,進行Morris水迷宮實驗,前4天進行獲得性訓練,第5 天進行正式檢測,檢測定位航行實驗和空間探查實驗。
1.5.2 小鼠海馬尼氏染色 行為學檢測完畢后,以6%水合氯醛經腹腔注射麻醉(6 mL/kg),部分小鼠用4%多聚甲醛溶液經心臟灌注,待心臟發白后,端頭取腦,置4%多聚甲醛固定24 h,用尼氏染色觀察各組小鼠海馬病理形態變化。
1.5.3 ELISA 檢測血清中TNF-α、IL-1β表達水平 部分小鼠摘眼球取血,取血后置4℃離心機,以3500 r/min,離心半徑:14 cm,離心15 min,取上清液,按照ELISA 試劑盒說明書檢測各組小鼠血清中TNF-α、IL-1β的表達水平。
1.5.4 Realtime-PCR 檢 測 海 馬 中AGEs、RAGE、NF-κB mRNA 表達水平 取血后,斷頭取腦,冰上分離海馬,置液氮速凍,24 h 內移至-80℃冰箱保存。取20 mg海馬,加Trizol提取海馬總mRNA,提取后用核酸蛋白儀檢測純度,純度為1.8~2.0 即可逆轉錄合成cDNA;參照Takara逆轉錄試劑盒說明書逆轉錄合成cDNA;參照SYBR Premix Ex Taq[TM]試劑盒說明書依次添加試劑,置PCR 儀進行基因擴增。用2-△△Ct表示mRNA 相對表達水平。AGEs、RAGE、NF-κB及內參β-actin序列見表1。

表1 引物序列
1.5.5 Western bolt檢測海馬中AGEs、RAGE、NF-κB蛋白表達水平 取海馬20 mg,加RIAP 裂解液和PMSF,冰上研磨,置4℃離心機,以12 000 r/min離心25 min,取上清,用BCA 蛋白質試劑盒檢測各樣本蛋白濃度;制作SDS-PAGE凝膠,依次加樣、電泳、轉膜;按抗體說明書孵育一抗AGEs、RAGE和NF-κB,置4℃冰箱過夜,洗膜,加入二抗,洗膜,ECL 顯色。最后置于凝膠圖像成像分析系統,曝光各組蛋白條帶,拍照。
1.6 統計學方法采用統計軟件SPSS 19.0處理數據,計量資料以(±s)表示,組間比較采用單因素方差分析,多組間比較采用LSD-t法,P<0.05表示差異有統計學意義。
2 結果
2.1 Morris 水迷宮實驗結果與空白組比較,模型組小鼠上平臺潛伏期、游泳總路程和第1 次抵原平臺時間明顯增加(P<0.01),穿越平臺次數、目標象限時間則明顯減少(P<0.01)。與模型組相比,小檗堿高劑量組小鼠上平臺潛伏期、游泳總路程和第1 次抵原平臺時間均有不同程度減少(P<0.05),穿越平臺次數、目標象限時間則有不同程度增加(P<0.05)。小檗堿低、中劑量組小鼠上平臺潛伏期、游泳總路程和第1 次抵原平臺時間有不同程度較少,穿越平臺次數、目標象限時間有不同程度增加,但差異無統計學意義(P>0.05)。見表2—3。
表2 各組小鼠定位航行實驗結果比較(±s)
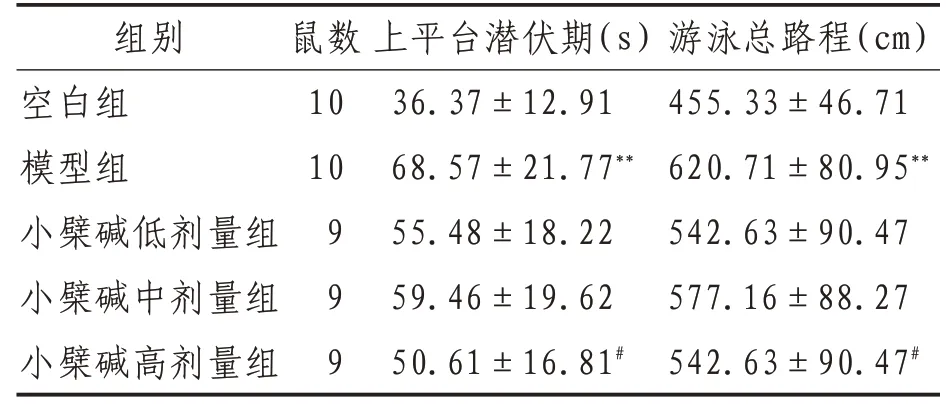
表2 各組小鼠定位航行實驗結果比較(±s)
注:**表示與空白組比較,P<0.01;#表示與模型組比較,P<0.05
游泳總路程(cm)455.33±46.71 620.71±80.95**542.63±90.47 577.16±88.27 542.63±90.47#組別空白組模型組小檗堿低劑量組小檗堿中劑量組小檗堿高劑量組鼠數10 10 9 9 9上平臺潛伏期(s)36.37±12.91 68.57±21.77**55.48±18.22 59.46±19.62 50.61±16.81#
表3 各組小鼠空間探查實驗結果比較(±s)
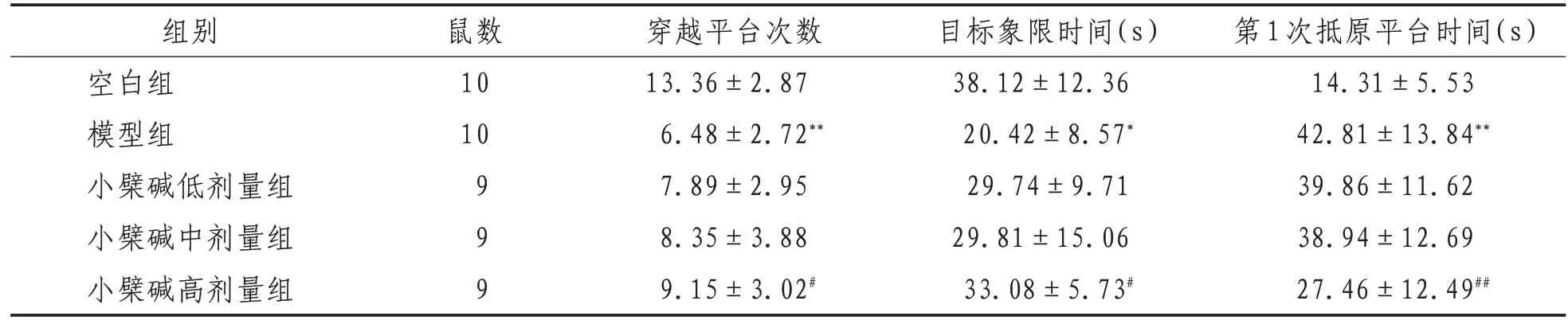
表3 各組小鼠空間探查實驗結果比較(±s)
注:與空白組比較,**表示P<0.01;與模型組比較,#表示P<0.05,##表示P<0.01
第1次抵原平臺時間(s)14.31±5.53 42.81±13.84**39.86±11.62 38.94±12.69 27.46±12.49##組別空白組模型組小檗堿低劑量組小檗堿中劑量組小檗堿高劑量組鼠數10 10 9 9 9穿越平臺次數13.36±2.87 6.48±2.72**7.89±2.95 8.35±3.88 9.15±3.02#目標象限時間(s)38.12±12.36 20.42±8.57*29.74±9.71 29.81±15.06 33.08±5.73#
2.2 海馬尼氏染色空白組小鼠海馬CA3 區神經元排列均勻整齊,細胞核飽滿,尼氏體染色均勻,大小均一。模型組小鼠海馬CA3 區神經元減少,尼氏體固縮、深染。小檗堿高劑量組神經元恢復較好,排列較整齊,尼氏體固縮、深染明顯好轉。小檗堿低劑量組和中劑量組神經元也有所恢復,但不如高劑量組明顯。見圖1。
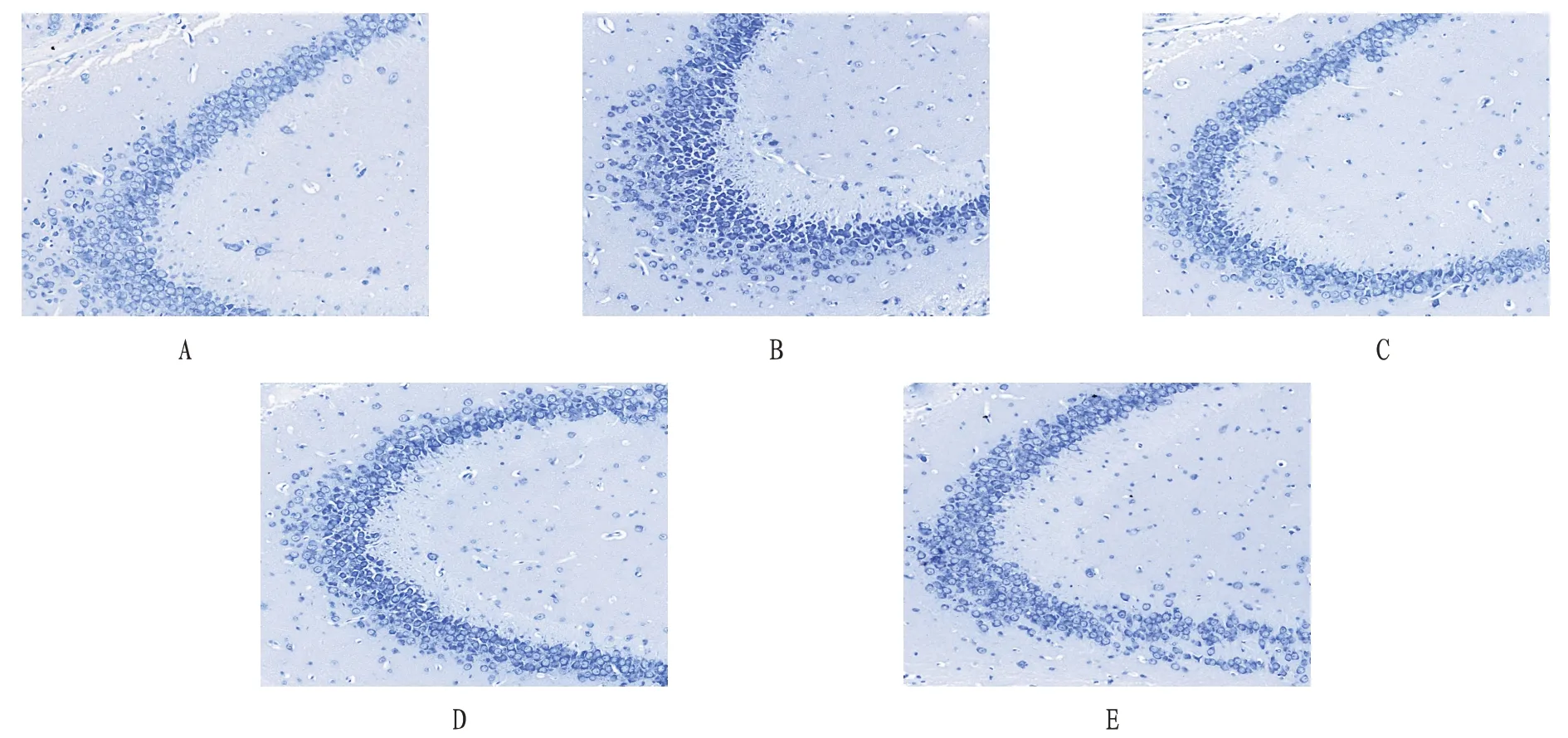
圖1 各組小鼠海馬CA3區尼氏染色圖(×200)
2.3 血清TNF-α、IL-1β水平與空白組相比,模型組小鼠血清中TNF-α、IL-1β表達水平升高(P<0.01);與模型組相比,小檗堿高劑量組小鼠血清中TNFα、IL-1β表達下降(P<0.05),小檗堿低、中劑量組小鼠血清中TNF-α、IL-1β也有不同程度降低,但差異無統計學意義(P>0.05)。見表4。
表4 各組小鼠血清TNF-α、IL-1β水平比較(±s)ng/L
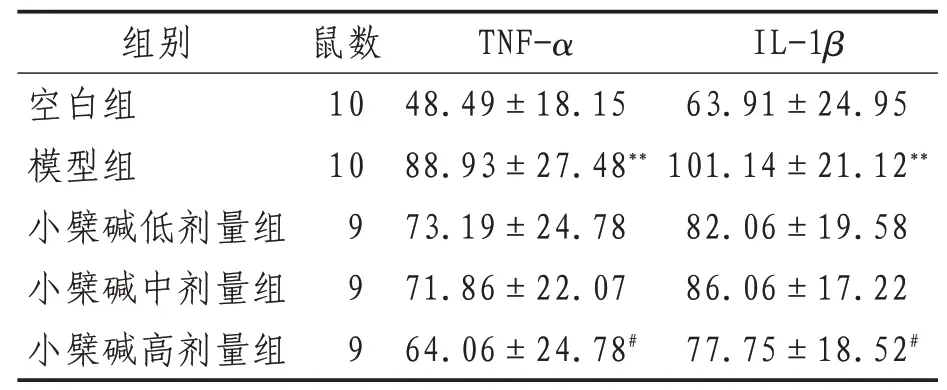
表4 各組小鼠血清TNF-α、IL-1β水平比較(±s)ng/L
注:與空白組比較,**表示P<0.01;與模型組比較,#表示P<0.05
IL-1β 63.91±24.95 101.14±21.12**82.06±19.58 86.06±17.22 77.75±18.52#組別空白組模型組小檗堿低劑量組小檗堿中劑量組小檗堿高劑量組鼠數10 10 9 9 9 TNF-α 48.49±18.15 88.93±27.48**73.19±24.78 71.86±22.07 64.06±24.78#
2.4 海馬中AGEs、RAGE、NF-κB mRNA表達水平與空白組比較,模型組小鼠海馬中AGEs、RAGE、NFκB mRNA 表達水平升高(P<0.01,P<0.05);與模型組比較,小檗堿高劑量組小鼠海馬中AGEs、RAGE、NF-κB mRNA 表達下降(P<0.01,P<0.05),小檗堿低、中劑量組小鼠海馬中AGEs、RAGE、NFκB mRNA 也有不同程度降低,但差異無統計學意義(P>0.05)。見表5。
2.5 海馬中AGEs、RAGE、NF-κB蛋白表達水平與空白組比較,模型組小鼠海馬中AGEs、RAGE、NF-κB的蛋白表達水平升高(P<0.01);與模型組相比,小檗堿高劑量組小鼠海馬中AGEs、RAGE、NF-κB 的蛋白表達下降(P<0.01,P<0.05),小檗堿低、中劑量組小鼠海馬中AGEs、RAGE、NF-κB 的蛋白也有不同程度降低,但差異沒有統計學意義(P>0.05)。見表6、圖2。
表5 各組小鼠海馬中AGEs、RAGE、NF-κB mRNA表達水平比較(±s)

表5 各組小鼠海馬中AGEs、RAGE、NF-κB mRNA表達水平比較(±s)
注:與空白組比較,**表示P<0.01;與模型組比較,#表示P<0.05,##表示P<0.01
組別空白組模型組小檗堿低劑量組小檗堿中劑量組小檗堿高劑量組NF-κB mRNA 0.58±0.31 0.91±0.36*0.74±0.26 0.69±0.22 0.64±0.25#鼠數10 10 9 9 9 AGEs mRNA 1.10±0.26 1.76±0.23**1.53±0.38 1.61±0.29 1.28±0.41##RAGE mRNA 0.74±0.31 1.07±0.37*0.84±0.19 0.99±0.17 0.79±0.31#
表6 各組小鼠海馬中AGEs、RAGE、NF-κB灰度值比較(±s)
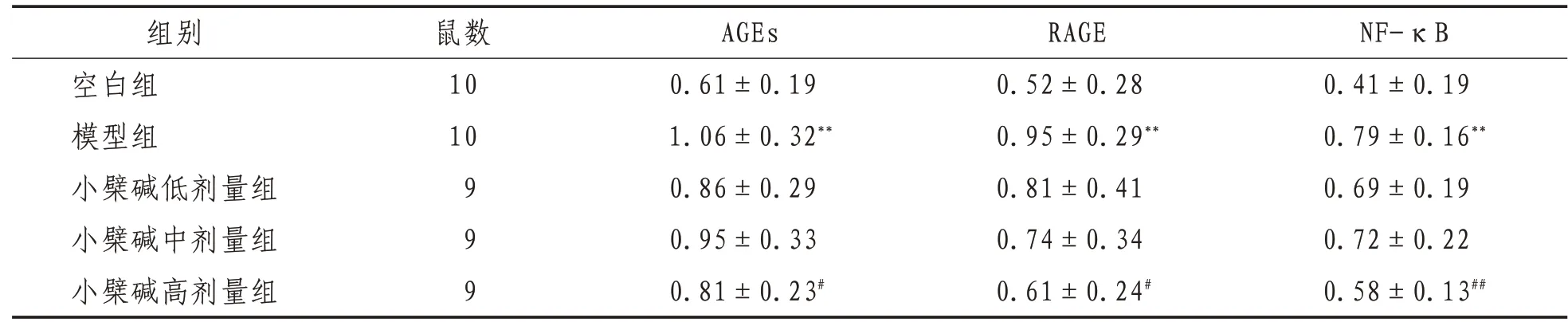
表6 各組小鼠海馬中AGEs、RAGE、NF-κB灰度值比較(±s)
注:與空白組比較,**表示P<0.01,*表示P<0.05;與模型組比較,##表示P<0.01,#表示P<0.05
組別空白組模型組小檗堿低劑量組小檗堿中劑量組小檗堿高劑量組NF-κB 0.41±0.19 0.79±0.16**0.69±0.19 0.72±0.22 0.58±0.13##鼠數10 10 9 9 9 AGEs 0.61±0.19 1.06±0.32**0.86±0.29 0.95±0.33 0.81±0.23#RAGE 0.52±0.28 0.95±0.29**0.81±0.41 0.74±0.34 0.61±0.24#

圖2 各組小鼠海馬中AGEs、RAGE、NF-κB的蛋白條帶
3 討論
糖尿病患者體內長時間高血糖狀態會促使葡萄糖發生糖化反應,進而產生AGEs 及其中間產物甲基乙二醛(methylglyoxal,MG)[12]。AGEs 和MG 具有細胞毒性,可以毒傷神經元,促進神經元凋亡[13]。體內沉積的AGEs 和MG 會促使中樞神經系統發生氧化應激反應,導致與學習記憶相關的海馬神經細胞凋亡,進而引起認知功能障礙[14-16]。RAGEs是AGEs的受體,主要存在于巨噬細胞及神經細胞中,可以介導機體對AGEs 進行蛋白修飾、蛋白降解及蛋白清除[17-18]。存在于錐體神經細胞和神經膠質細胞中RAGEs 能維持血腦屏障的完整性、減少神經炎癥反應和Aβ的沉積[19-21]。AGEs 在腦內過度沉積時,AGEs 會與其受體RAGE 結合,兩者結合后會激活氧化應激,進而激活氧化還原反應敏感轉錄因子NF-κB,導致TNF-α、IL-1β等炎癥因子水平升高,從而引起神經突觸可塑性減低以及軸突樹突分支減少等,最終引起認知功能障礙[22-23]。腹腔注射STZ 后,通過Morris 水迷宮實驗,我們發現小鼠上平臺潛伏期、游泳總路程和第1 次抵原平臺時間明顯增加,這說明本實驗成功通過STZ 建立了糖尿病認知功能障礙模型。腹腔注射STZ 后,小鼠血清中TNF-α、IL-1β表達水平升高,海馬CA3 區神經元減少,尼氏體固縮、深染,海馬中AGEs、RAGE、NF-κB的mRNA和蛋白表達水平也升高,這說明STZ可以激活AGEs/RAGE/NF-κB信號通路,從而引起認知功能障礙。
小檗堿為黃連的主要有效成分,具有降血糖、降脂、降膽固醇、抗炎、抗細菌和拮抗神經系統功能障礙等作用[23]。本實驗發現,給予模型小鼠小檗堿后,小鼠神經元恢復,排列較整齊,尼氏體固縮、深染好轉,血清中TNF-α、IL-1β表達下降,海馬中AGEs、RAGE、NF-κB 的mRNA 和蛋白表達水平也下降。這說明小檗堿能改善糖尿病認知功能障礙,其機制可能與其下調AGEs/RAGE/NF-κB 信號通路有關。

