IRF5通過對巨噬細胞極化的調節影響脂質攝取及排出的探究
于敏?劉志河?華興?韋建瑞
【摘要】動脈粥樣硬化(AS)是嚴重危害人類生命健康的一類慢性血管疾病,局部膽固醇的大量蓄積和炎癥的發生是其主要原因。現已證明許多細胞因子通過調節巨噬細胞向M1及M2型的轉化,影響巨噬細胞對脂質的攝取及排出。該文將闡述干擾素調節因子5(IRF5)是否通過調節巨噬細胞的極化而對巨噬細胞的脂質攝取及排出產生影響,從而為以IRF5為作用靶點治療AS的可能性提供一些前期理論研究。
【關鍵詞】動脈粥樣硬化;干擾素調節因子5;巨噬細胞;極化;脂質
IRF5 influences the uptake and excretion of lipid in macrophage through regulating macrophage polarization Yu Min, Liu Zhihe, Hua Xing, Wei Jianrui. School of Clinical Medicine, Guizhou Medical University, Guiyang 550004, China
Corresponding author, Wei Jianrui, E-mail: jianruiw@ 163. com
【Abstract】Atherosclerosis is a chronic vascular disease that seriously endangers the life and health of human. The accumulation of local cholesterol and the recurrence of inflammation are the major causes.Through the transformation to M1 and M2, macrophages play an important role in regulating the uptake and excretion of lipid.In this article, whether the interferon regulatory factor 5 (IRF5) can influence the function of uptake and excretion of lipid of the macrophage by regulating the polarization of macrophage or not was discussed,aiming to explore the possibility of IRF5 as a target for the treatment of atherosclerosis.
【Key words】Atherosclerosis;Interferon regulatory factor 5;Macrophage;Polarization;Lipid
由動脈粥樣硬化(AS)引起的急性心腦血管事件的發病率和致死率呈逐年上升的趨勢,其發病基礎以大量蓄積的脂質和難以控制的炎癥為主。巨噬細胞在調節脂質及炎癥反應中發揮著重要作用。本文主要闡述巨噬細胞攝取及排出脂質的過程及干擾素調節因子5(IRF5)是否通過對巨噬細胞極化的調控進一步影響此過程,探討治療AS的新靶點。
一、IRF5可能通過干擾巨噬細胞內脂質的攝取及排出影響AS
動脈內皮下沉積的脂質吸引單核細胞遷移、附著并逐漸分化成巨噬細胞,隨后其細胞表面的清道夫受體(SR)攝取氧化型低密度脂蛋白(oxLDL)進入細胞內,經膽固醇酰基轉移酶-1和中性膽固醇酯水解酶的酯化、水解等處理后轉化為游離膽固醇,堆積在巨噬細胞內。正常情況下,巨噬細胞內約80%的游離膽固醇經膜孔擴散流出細胞外,還有一部分游離膽固醇在細胞中被膽固醇轉運蛋白轉移至細胞外。這種將膽固醇攝取及排出的過程是維持細胞內膽固醇平衡的關鍵,當膽固醇的攝取大于排出時,這一平衡即被破壞,游離膽固醇將在巨噬細胞內大量蓄積,加劇巨噬細胞泡沫化程度并在血管內皮下逐漸形成脂質條紋,最終導致AS形成[1-2]。
越來越多的研究表明在AS形成過程中,IRF5發揮了重要的作用;IRF5是參與免疫反應、細胞分化、細胞信號傳導的IRF家族成員之一(共有IRFl ~ IRF9),其表達水平的異常與心血管疾病、自身免疫性疾病、神經系統疾病、代謝性疾病、腫瘤等密切相關[3]。近年來,IRF5在炎癥環境中發揮的核心作用對AS產生影響逐漸成為研究熱點。IRF5基因位于染色體7q32上,由50個非翻譯區(UTR)及8個編碼外顯子組成,經不同剪接可產生9個IRF5轉錄異構體(v1 ~ v9)。不同轉錄異構體在不同細胞類型中具有差異性表達,單核細胞、巨噬細胞和樹突狀細胞中的IRF5為高表達狀態[4]。實驗證明AS的發生與IRF5基因表達異常有關,利用具有IRF5基因的小鼠與缺乏IRF5基因的小鼠進行對比分析,發現前者較后者更容易發生AS的變化,提示IRF5基因敲除能夠減少AS斑塊炎癥和壞死范圍的大小,這有利于降低心血管疾病中臨床并發癥的風險。因此,通過調控IRF5基因表達水平能夠影響AS的進程,而明確IRF5基因表達水平是否對巨噬細胞的脂質攝取及排出產生影響,為開發出針對AS發病機制的選擇性治療方案提供一些新思路[5]。
二、IRF5通過調控巨噬細胞極化功能影響AS
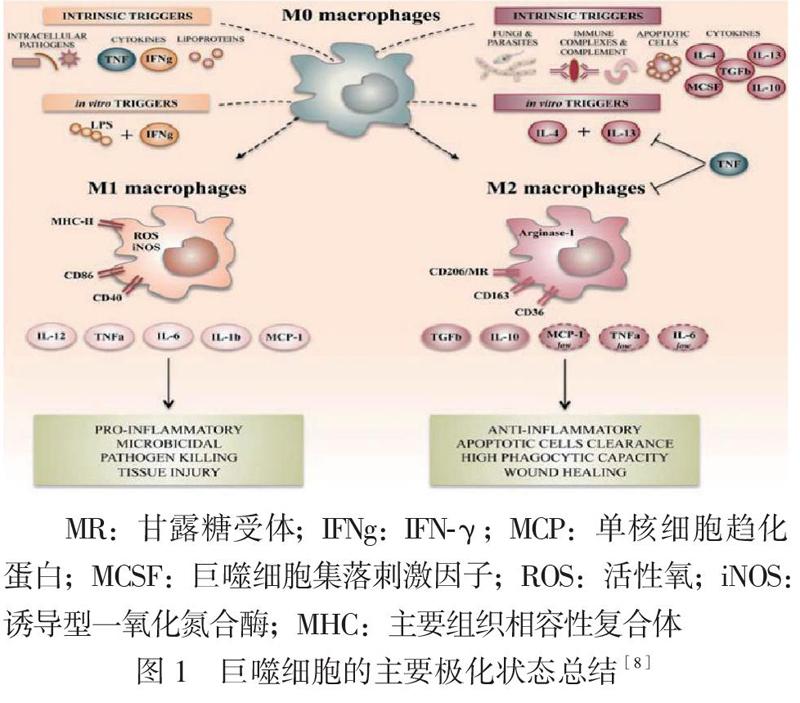
巨噬細胞是AS形成過程中的重要參與者,它受周圍不同因素影響呈現出功能不同、表面標記差異的亞型,即M1型及M2型巨噬細胞,兩者在調節炎癥反應中發揮不同作用。其中,M1型巨噬細胞由脂多糖(LPS)或IFN-γ等激活,通過經典活化途徑產生細胞因子TNF-α、IL-6、IL-12、IL-23等,以引起促炎反應和抗腫瘤等作用為特征;M2型巨噬細胞由IL-4、IL-13等因子誘導形成,通過替代激活途徑產生抗炎性細胞因子IL-10、轉化生長因子-β(TGF-β)等,以發揮抗炎、促進組織愈合及免疫調節等作用為特征(見
圖1)[6-8]。十幾年來,許多研究者已探索出巨噬細胞與機體發生AS有密切聯系,他們在小鼠模型實驗中發現,使用一種具有抗炎功能的血漿蛋白減少小鼠AS斑塊形成的同時檢測到IL-10、精氨酸酶1等M2型巨噬細胞相關因子的表達增加,且局部炎癥反應減輕,提示調控巨噬細胞至M2型可有效延緩AS的損傷程度[9]。在另一項關于冠狀動脈粥樣硬化性心臟病(冠心病)患者及非冠心病患者的心外膜脂肪組織與巨噬細胞極化的關系研究中顯示,冠心病患者的心外膜脂肪組織中有較高含量的M1型巨噬細胞,并伴有明顯的炎癥反應[10]。以上實驗表明,改變巨噬細胞極化表型能在很大程度上影響AS的進展,這將是一項延緩動脈粥樣硬化性心腦血管疾病的有效治療措施。
大量研究已證明,IRF5是調控巨噬細胞極化的關鍵因子之一,并且對炎性因子的產生至關重要,它能通過結合髓樣分化因子88、控制Toll樣受體、激活核因子-κB等機制誘導不同表型的巨噬細胞形成而發揮促炎反應或抗炎反應[11]。國內外許多實驗發現,通過上調IRF5的表達能誘導M1型巨噬細胞形成,促進大量炎性細胞因子(IL-6、IL-12和TNF-α等)的產生;反之,IRF5的表達水平下調則誘導M2型巨噬細胞形成,同時發現M1型巨噬細胞數量及炎癥因子的釋放含量均降低[12-15]。因此,通過調節IRF5的表達水平而改變巨噬細胞的極化,可以改善或加重AS的嚴重程度。
三、IRF5通過調節巨噬細胞相關炎癥反應影響膽固醇代謝的可能
基于IRF5能夠改變巨噬細胞的極性,進而誘發炎癥反應這一事實,以及大量蓄積的脂質和難以控制的炎癥為AS的發病基礎,探索IRF5是否影響巨噬細胞脂質的攝取及排出有一定必要性。Orekhov等[16]提供了一份頗具創新意義的關于基因表達的報告,分析了100多個引起細胞內膽固醇蓄積的主要基因,發現10個泡沫細胞形成的關鍵調節因子包括IL-7、IL-7受體、IL-15、趨化因子配體8、具有Ig和ITIM結構域的T淋巴細胞免疫受體、類凝血因子Ⅱ受體1、真核翻譯起始因子2α激酶3、睪丸特異性蛋白Y編碼樣蛋白2、膜聯蛋白A1和雙特異性磷酸酶1,其中有7個屬于炎癥途徑因子,而出乎意料的是沒有屬于膽固醇代謝途徑的基因,表明促炎免疫反應增加細胞內膽固醇的積累,或者至少說明了炎癥反應有助于脂質堆積的過程。該報告理論上支持了促炎性M1型巨噬細胞通過誘發炎癥反應而促進細胞內膽固醇蓄積的可能性,因此,靶向治療炎性成分將成為緩解AS的有效途徑。隨后,該作者在實驗中利用巨噬細胞與修飾的LDL相互作用時,發現了能夠刺激巨噬細胞內膽固醇大量蓄積的5個主要炎癥基因,即IL-15、真核生物翻譯起始因子2α激酶3、膜聯蛋白A1、類凝血因子Ⅱ受體1和睪丸特異性蛋白Y編碼樣蛋白2,并且利用小片段干擾核糖核酸(siRNA)技術將前3個基因表達敲低后,檢測到巨噬細胞中膽固醇含量明顯減少[17]。由此可知,炎癥因子的表達水平能夠引起或者促進巨噬細胞內膽固醇的蓄積。目前,細胞因子IRF5已被證明能夠通過改變巨噬細胞的極性而表現出其促炎因子的特性,因此,IRF5可能具備與上述報告中的炎癥因子相似的作用,即增加巨噬細胞內膽固醇的蓄積。
已有實驗表明M1型巨噬細胞分泌大量TNF-α,通過上調細胞表面的SR而增加oxLDL的攝取[18]。在研究人類THP-1巨噬細胞中,使用TNF-α及IL-6處理細胞可下調其膽固醇轉運蛋白的表達而抑制膽固醇的排出[19]。有學者發現M2型巨噬細胞分泌的IL-10可下調SR的表達而進一步減少脂質的攝取[20]。IL-4誘導巨噬細胞向M2型極化后通過下調膽固醇攝取基因及上調膽固醇外排基因,可導致脂質攝取減少、排出增加,有效降低細胞內脂質的蓄積[21]。因此,探索IRF5調控巨噬細胞極化及脂質代謝的遺傳學操作及藥物干預是控制AS的重要切入點。
四、IRF5對巨噬細胞攝取和排出脂質的影響
1.巨噬細胞攝取脂質
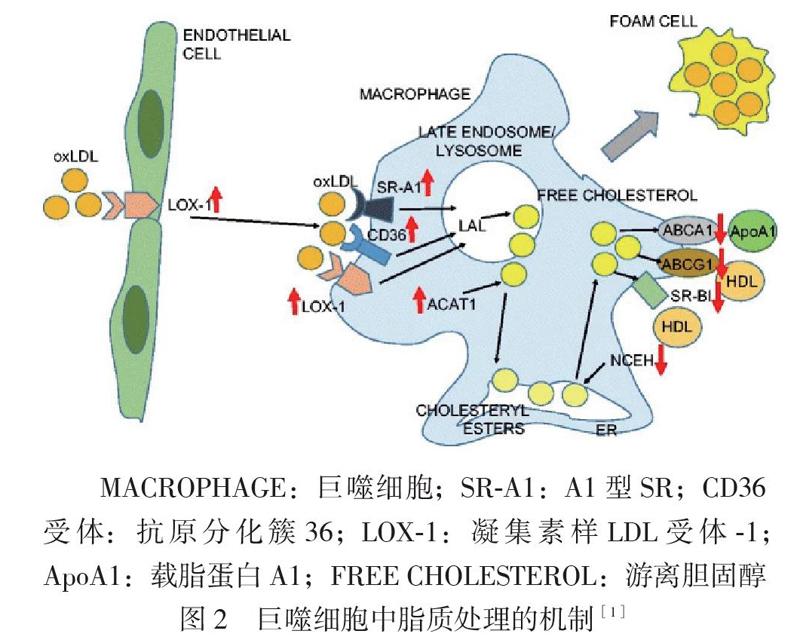
IRF5對巨噬細胞極化的調控可誘導促炎細胞因子及抗炎細胞因子的產生,這可能在脂質的代謝中扮演重要角色。巨噬細胞表面有多種負責介導oxLDL進入細胞的SR,包括A1型SR (SR-A1)、白細胞抗原CD36和凝集素樣LDL受體-1(LOX-1)(見圖2),這些受體均是巨噬細胞表面的跨膜糖蛋白,對脂質的攝取及AS形成有重要作用[1]。大量研究證明,促炎因子TNF-α及IL-6誘導巨噬細胞表面SR-A1、CD36和LOX-1的表達上調,進而增強巨噬細胞對脂質的攝取,促進AS的形成[18, 22]。而抗炎因子IL-10明顯抑制SR-A1、CD36和LOX-1的表達,降低巨噬細胞對脂質的攝取,抑制泡沫細胞的形成并發揮對抗AS作用[19, 23-24]。因此,IRF5可通過誘導不同極化表型的巨噬細胞分泌促炎及抗炎細胞因子而調節SR的表達水平,進一步影響巨噬細胞對脂質的攝取、巨噬細胞泡沫化程度及AS的進展。
2.巨噬細胞排出脂質
進入巨噬細胞內的oxLDL經過酯化、水解等處理后轉化為游離膽固醇,再由巨噬細胞表面的膽固醇轉運蛋白將其從細胞中轉運排出,這些轉運蛋白主要包括三磷酸腺苷結合盒轉運體A1(ABCA1)、三磷酸腺苷結合盒轉運體G1(ABCG1)和B1型SR(SR-B1)(見圖2)[1]。如果脂質不能及時排出,將對細胞產生毒性作用,誘發急性血管閉塞或血栓形成等惡性事件。一項關于丹吉爾疾病的報告顯示巨噬細胞表面ABCA1基因突變的患者喪失ABCA1的功能,此類型患者體內巨噬細胞脂質含量顯著增加,并且他們發生嚴重AS的風險也顯著增加[25-26]。國外學者建立了ABCA1、ABCG1和SR-B1基因缺陷型的小鼠模型與基因正常型的小鼠進行對比,發現基因缺陷型小鼠的巨噬細胞內膽固醇的排出被抑制,并且此類小鼠的主動脈更容易發生AS變化[27-28]。因此,膽固醇轉運蛋白對調節巨噬細胞內脂質含量及AS的進展有非常重要的影響。
大量研究顯示炎癥因子TNF-α及IL-6抑制膽固醇轉運蛋白(ABCA1、ABCG1和SR-B1)的表達,表明IRF5誘發炎癥反應對膽固醇的轉運排出有抑制作用,可能通過激活過氧化物酶體增殖物激活受體γ、肝X受體和核因子-κB等途徑導致大量膽固醇滯留在巨噬細胞內,加重巨噬細胞泡沫化程度[19, 29-30]。有學者發現了一種使IL-10在巨噬細胞中長期表達的特異性逆轉錄病毒載體方法,這種方法能促進巨噬細胞排出膽固醇而發揮抗AS作用,此過程與激活過氧化物酶體增殖物激活受體γ-肝X受體-ABCA1/ABCG1途徑相關[31]。
因此,IRF5具有通過干預巨噬細胞的極化而調控膽固醇轉運蛋白的基因表達的能力,最終達到抑制AS發展的治療目的。
五、展 望
綜上所述,IRF5對巨噬細胞的極化及分泌抗炎或促炎細胞因子具有調節作用,而巨噬細胞極化影響脂質的攝取和排出,進而影響巨噬細胞泡沫化程度,賦予其對抗或促進AS的作用。目前通過改變巨噬細胞表型治療AS仍處于初級階段,但明確IRF5調控巨噬細胞極化表型從而影響膽固醇代謝,對AS靶向治療具有臨床參考價值。
參 考 文 獻
[1] Chistiakov DA, Melnichenko AA, Myasoedova VA, Grechko AV,Orekhov AN. Mechanisms of foam cell formation in atherosclerosis. J Mol Med (Berl), 2017,95(11): 1153-1165.
[2] Phillips MC. Molecular mechanisms of cellular cholesterol efflux. J Biol Chem, 2014,289(35): 24020-24029.
[3] Zhao GN, Jiang DS, Li H. Interferon regulatory factors: at the crossroads of immunity, metabolism, and disease. Biochim Biophys Acta, 2015,1852(2): 365-378.
[4] Graham RR, Kozyrev SV, Baechler EC, Reddy MV, Plenge RM, Bauer JW, Ortmann WA, Koeuth T, González Escribano MF; Argentine and Spanish Collaborative Groups, Pons-Estel B, Petri M, Daly M, Gregersen PK, Martín J, Altshuler D, Behrens TW, Alarcón-Riquelme ME. A common haplotype of interferon regulatory factor 5(IRF5) regulates splicing and expression and is associated with increased risk of systemic lupus erythematosus. Nat Genet,2006,38(5):550-555.
[5] Seneviratne AN, Edsfeldt A, Cole JE, Kassiteridi C, Swart M, Park I, Green P, Khoyratty T, Saliba D, Goddard ME, Sansom SN, Goncalves I, Krams R, Udalova IA, Monaco C. Interferon regulatory factor 5 controls necrotic core formation in atherosclerotic lesions by impairing efferocytosis. Circulation,2017,136(12):1140-1154.
[6] Murray PJ, Wynn TA. Protective and pathogenic functions of macrophage subsets. Nat Rev Immunol,2011,11(11):723-737.
[7] Shapouri-Moghaddam A, Mohammadian S, Vazini H, Taghadosi M, Esmaeili SA, Mardani F, Seifi B, Mohammadi A, Afshari JT, Sahebkar A. Macrophage plasticity, polarization, and function in health and disease. J Cell Physiol,2018,233(9):6425-6440.
[8] Atri C, Guerfali FZ, Laouini D. Role of human macrophage polarization in inflammation during infectious diseases. Int J Mol Sci,2018,19(6):1801.
[9] Li B, Sheng Z, Liu C, Qian L, Wu Y, Wu Y, Ma G, Yao Y. Kallistatin inhibits atherosclerotic inflammation by regulating macrophage polarization. Hum Gene Ther,2019,30(3):339-351.
[10] Vianello E, Dozio E, Arnaboldi F, Marazzi MG, Martinelli C, Lamont J, Tacchini L, Sigrüner A, Schmitz G, Corsi Romanelli MM. Epicardial adipocyte hypertrophy: association with M1-polarization and toll-like receptor pathways in coronary artery disease patients. Nutr Metab Cardiovasc Dis,2016,26(3):246-253.
[11] Stein T, Wollschlegel A, Te H, Weiss J, Joshi K, Kinzel B, Billich A, Guntermann C, Lehmann JCU. Interferon regulatory factor 5 and nuclear factor kappa-B exhibit cooperating but also divergent roles in the regulation of pro-inflammatory cytokines important for the development of TH1 and TH17 responses. FEBS J,2018,285(16):3097-3113.
[12] Almuttaqi H, Udalova IA. Advances and challenges in targeting IRF5, a key regulator of inflammation. FEBS J,2019,286(9):1624-1637.
[13] Sun K, He SB, Qu JG, Dang SC, Chen JX, Gong AH, Xie R, Zhang JX. IRF5 regulates lung macrophages M2 polarization during severe acute pancreatitis in vitro. World J Gastroenterol,2016,22(42):9368-9377.
[14] Wei Z, Yan L, Chen Y, Bao C, Deng J, Deng J. Mangiferin inhibits macrophage classical activation via downregulating interferon regulatory factor 5 expression. Mol Med Rep,2016,14(2):1091-1098.
[15] Fang H, Yang M, Pan Q, Jin HL, Li HF, Wang RR, Wang QY, Zhang JP. MicroRNA-22-3p alleviates spinal cord ischemia/reperfusion injury by modulating M2 macrophage polarization via IRF5. J Neurochem,2020. doi: 10.1111/jnc.15042. Epub ahead of print.
[16] Orekhov AN, Oishi Y, Nikiforov NG, Zhelankin AV, Dubrovsky L, Sobenin IA, Kel A, Stelmashenko D, Makeev VJ, Foxx K, Jin X, Kruth HS, Bukrinsky M. Modified LDL particles activate inflammatory pathways in monocyte-derived macrophages: transcriptome analysis. Curr Pharm Des,2018,24(26):3143-3151.
[17] Orekhov AN, Nikiforov NG, Sukhorukov VN, Kubekina MV, Sobenin IA, Wu WK, Foxx KK, Pintus S, Stegmaier P, Stelmashenko D, Kel A, Gratchev AN, Melnichenko AA, Wetzker R, Summerhill VI, Manabe I, Oishi Y. Role of phagocytosis in the pro-inflammatory response in LDL-induced foam cell formation; a transcriptome analysis. Int J Mol Sci,2020,21(3):817.
[18] Hashizume M, Mihara M. Atherogenic effects of TNF-α and IL-6 via up-regulation of scavenger receptors. Cytokine,2012,58(3):424-430.
[19] Zhang N, Lei J, Lei H, Ruan X, Liu Q, Chen Y, Huang W. MicroRNA-101 overexpression by IL-6 and TNF-α inhibits cholesterol efflux by suppressing ATP-binding cassette transporter A1 expression. Exp Cell Res,2015,336(1):33-42.
[20] Yang H, Chen S, Tang Y, Dai Y. Interleukin-10 down-regulates oxLDL induced expression of scavenger receptor A and Bak-1 in macrophages derived from THP-1 cells. Arch Biochem Biophys,2011,512(1):30-37.
[21] Park SJ, Lee KP, Kang S, Lee J, Sato K, Chung HY, Okajima F, Im DS. Sphingosine 1-phosphate induced anti-atherogenic and atheroprotective M2 macrophage polarization through IL-4. Cell Signal,2014,26(10):2249-2258.
[22] Ding Z, Liu S, Wang X, Theus S, Deng X, Fan Y, Zhou S, Mehta JL. PCSK9 regulates expression of scavenger receptors and ox-LDL uptake in macrophages. Cardiovasc Res,2018,114(8):1145-1153.
[23] Bagchi AK, Surendran A, Malik A, Jassal DS, Ravandi A, Singal PK. IL-10 attenuates OxPCs-mediated lipid metabolic responses in ischemia reperfusion injury. Sci Rep,2020,10(1):12120.
[24] Kim YH, Pyo S. Interleukin-10 suppresses adipogenesis via Wnt5a signaling pathway in 3T3-L1 preadipocytes. Biochem Biophys Res Commun,2019,509(4):877-885.
[25] Bodzioch M, Orsó E, Klucken J, Langmann T, B?ttcher A, Diederich W, Drobnik W, Barlage S, Büchler C, Porsch-Ozcürümez M, Kaminski WE, Hahmann HW, Oette K, Rothe G, Aslanidis C, Lackner KJ, Schmitz G. The gene encoding ATP-binding cassette transporter 1 is mutated in Tangier disease. Nat Genet,1999,22(4):347-351.
[26] Sampietro T, Puntoni M, Bigazzi F, Pennato B, Sbrana F, Dal Pino B, Azzarà A, Magagnini E, Perossini P, Cei G, Bacci G. Images in cardiovascular medicine. Tangier disease in severely progressive coronary and peripheral artery disease. Circulation,2009,119(20):2741-2742.
[27] Galle-Treger L, Moreau M, Ballaire R, Poupel L, Huby T, Sasso E, Troise F, Poti F, Lesnik P, Le Goff W, Gautier EL, Huby T. Targeted invalidation of SR-B1 in macrophages reduces macrophage apoptosis and accelerates atherosclerosis. Cardiovasc Res,2020,116(3):554-565.
[28] Westerterp M, Murphy AJ, Wang M, Pagler TA, Vengrenyuk Y, Kappus MS, Gorman DJ, Nagareddy PR, Zhu X, Abramowicz S, Parks JS, Welch C, Fisher EA, Wang N, Yvan-Charvet L, Tall AR. Deficiency of ATP-binding cassette transporters A1 and G1 in macrophages increases inflammation and accelerates atherosclerosis in mice. Circ Res,2013,112(11):1456-1465.
[29] Park Y, Pham TX, Lee J. Lipopolysaccharide represses the expression of ATP-binding cassette transporter G1 and scavenger receptor class B, type I in murine macrophages. Inflamm Res,2012,61(5):465-472.
[30] De Simone V, Franzè E, Ronchetti G, Colantoni A, Fantini MC, Di Fusco D, Sica GS, Sileri P, MacDonald TT, Pallone F, Monteleone G, Stolfi C. Th17-type cytokines, IL-6 and TNF-α synergistically activate STAT3 and NF-kB to promote colorectal cancer cell growth. Oncogene,2015,34(27):3493-3503.
[31] Han X, Kitamoto S, Wang H, Boisvert WA. Interleukin-10 overexpression in macrophages suppresses atherosclerosis in hyperlipidemic mice. FASEB J,2010,24(8):2869-2880.
(收稿日期:2020-09-10)
(本文編輯:楊江瑜)

