糖尿病性周圍神經病理性疼痛中circ-SCN9A 的作用與臨床價值*
劉 磊 席 鵬 李文舉 雷舒煜 李亦梅
(新疆醫科大學第一附屬醫院疼痛科,烏魯木齊 830011)
神經病理性疼痛 (neuropathic pain, NP) 是由軀體感覺神經系統的損傷或疾病而直接造成的疼痛,主要分為周圍神經病理性疼痛和中樞神經病理性疼痛[1]。糖尿病性周圍神經病理性疼痛 (diabetic peripheral neuropathic pain, DPNP) 是指由糖尿病或糖尿病前期病變導致的周圍神經病理性疼痛[2]。目前,DPNP 的發生率逐年升高,已成為亟待解決的醫學難題之一。本研究致力于進一步明確DPNP 的發病機制并尋找其可靠的診斷標記物。鈉電壓門控通道α亞單位9 (sodium voltage-gated channel alpha subunit 9, SCN9A) 基因編碼的蛋白 (Nav 1.7) 參與組成神經細胞中的痛覺感受器[3,4]。該基因的突變可以導致多種以疼痛為主的疾病[5]。微小RNA (microRNA, miRNA)可通過降低編碼基因mRNA 的表達來抑制其蛋白質的翻譯。例如,miR-30b 可通過降低SCN9A 基因mRNA 的表達來抑制Nav 1.7 蛋白翻譯,從而降低NP 實驗大鼠疼痛的嚴重程度[4]。
在基因的轉錄成分中,環狀 RNA (circular RNA, circRNA)缺乏線性轉錄本的 “poly (A) 尾”,通過首尾末端的相接形成環化結構[6,7],可結合各種 miRNA,抑制其功能,發揮 miRNA“海綿”的作用[7]。人類神經系統中高豐度的circRNA 可通過多種途徑游離于外周循環系統[8,9]。最新研究證實circRNA可通過內源性miRNA“海綿”機制參與疼痛性疾病的發生[10,11]。例如,circRNA_9119 可以通過吸附miR-26a 減輕進行性的熱痛覺過敏和機械性痛覺過敏[12]。circAnks1a 對miR-324-3p 的吸附可提高背角神經元的興奮性和神經損傷引起的疼痛程度[13]。DPNP 病人血清circHIPK3 水平顯著高于健康人群,敲減circHIPK3 則可減輕糖尿病大鼠的NP 程度[14]。
由于circRNA 分子呈封閉環狀結構,不容易受RNA 外切酶影響,在神經系統表達豐度高且具有一定的時序和疾病特異性,這使得circRNAs 有巨大潛力成為疼痛類疾病的診斷標志物。本研究在前期通過生物信息學分析發現SCN9A 基因區域可以轉錄生成多個circRNA 分子,創新性地探討了它們在DPNP 中的作用和臨床價值。通過擬合臨床樣本、生物信息學分析和分子生物學實驗等多種技術手段對其在DPNP 發生中的潛在診斷價值和可能作用機制進行了研究,以期推動該病的臨床診斷治療。
方 法
1.樣本采集
收集2017 年1 月至2019 年12 月在我科收治的診斷為DPNP 的病人。
納入標準:自愿參加本研究并同意抽取其外周靜脈血樣;符合《糖尿病性周圍神經病理性疼痛診療專家共識》的診斷標準;《ID Pain》評分> 2 分;年齡 ≥18 歲;疼痛數字評分法 (numerical rating scale, NRS)評分≥4 分,4~6 分為中度疼痛,7 分以上為重度疼痛;視覺模擬評分法(visual analogue scale, VAS)評分在6~10 分;意識清醒,可以進行正確的溝通和言語表達;無腫瘤等其他嚴重軀體性疾病。
排除標準:年齡 < 18 歲;NRS < 4 分;急慢性胰腺炎;神經系統損害性疾病;精神活性物質濫用史;肝腎功能不全者。
共收集DPNP 病人60 例(男女各30 例),其中男性平均年齡為(70.8±5.3)歲,平均病程(6.1±0.6)年;女性平均年齡為(72.3±4.2)歲,平均病程(6.5±0.5)年。收集本院無NP 癥狀的2 型糖尿病病人60 例,男30 例,平均年齡(66.3±4.5)歲;女30 例,平均年齡(69.0±3.2)歲;收集的健康對照者為本院常規體檢確認后的健康人群,男女各30 例,男性平均年齡(67.6±3.4)歲,女性平均年齡(70.0±4.5)歲。本研究所有內容和實施過程均獲得了入組者的知情同意和本單位醫學倫理委員會的批準和監督。
2.主要試劑與儀器
體液RNA 提取專用試劑TRIzol LS Reagent (Invitrogen, Karlsruhe, Germany);EDTA 真空采血管及針頭(積水,日本);circRNA 反向設計引物和線性內參 (GAPDH) 引物(生工,上海);構建circRNA過表達專用試劑盒pHB-circBasic? circular RNA cloning kit (漢恒,上海);特異性siRNA (銳博,廣州);逆轉錄試劑ReverTra Ace qPCR RT Master Mix (TOYOBO, Japan);雙熒光素酶 (Luciferase, LUC)報告系統(Promega, USA);Ribonuclease R (Epicentre, USA);2×Power Taq PCR MasterMix(百泰克,北京);胎牛血清 (Bovogen, Australian);Anti-KCNJ6抗體(義翹神州,北京)、單克隆 Anti-GAPDH 抗體 (Sigma, USA);適用于Real-time PCR 用的PowerUp?SYBR? Green Master Mix (Applied Biosystems, USA);微量移液器 (Eppendorf, Germany);細胞培養板 (Corning, USA);Real-time PCR 自動化分析儀 (Bio-RAD, USA);全自動酶標儀、細胞培養箱 (Thermo Scientific, USA);超凈工作臺(智城,上海);數顯電熱恒溫水槽、生化培養箱 (精宏,上海);水平搖床(其林貝爾,江蘇);超聲波細胞粉碎機 (新芝,浙江)。
3. 血清總RNA 提取與Real-time qPCR 分析
在上午空腹狀態下,收集入組者外周血3 ml,然后置于冷凍離心機內以3000 g 的速度離心10 min,收集上清,置于-80℃冰箱保存。按照TRIzol LS Reagent 的說明書對血清內的RNA 進行提取,采用全自動酶標儀對所提RNA 進行濃度和純度測定。取1 μg RNA 進行cDNA 合成。利用circRNA 序列數據庫(http://www.circbase.org/) 獲取所有來自SCN9A基因的已知circRNA 分子的轉錄起始位點和序列信息,設計相應的反向引物。使用Real-time PCR 自動化分析儀對血清樣本中的circRNA 進行qRT-PCR表達分析。使用△Ct 方法計算circRNA 的相對表達水平。
4. 環狀RNA 鑒定與細胞亞定位分析
用含1%雙抗(青霉素、鏈霉素)和10%胎牛血清的DMEM 培養液培養人神經母細胞瘤細胞系SH-SY5Y,細胞培養箱設為5% CO2、37℃。Ribonuclease R (RNase R) 是一種核糖核酸外切酶,可以從3'-5'方向切割降解RNA,能夠消化幾乎所有的線性RNA 分子,但不易消化呈環形的RNA。本研究以3 U RNase R/μg RNA 的比例對細胞總RNA 進行Rnase R 消化處理(37℃,10 min),然后以處理過的RNA 作為模板合成cDNA,與常規的cDNA 分別進行線性SCN9A 基因和SCN9A 來源的circRNA 進行表達測定比較。細胞的亞定位往往決定circRNA行使生物學功能的類型,按照核質分離試劑盒說明書標準流程對篩選出的circRNA 進行了細胞亞定位分析。
5.篩選SCN9A 來源circRNA 的互作miRNA
在轉染前24 h,以5×103/孔的細胞密度接種于96 孔板中。利用circRNA 生物信息學分析工具(http://www.circbase.org/和https://circinteractome.nia.nih.gov/index.html)預測可能與上述篩選出的circRNA 結合的miRNA,合成它們的類似物。將含有備選circRNA 結合位點片段的報告質粒和這些miRNA 類似物共轉染入細胞內。在48 h 后按照說明書操作步驟測定LUC 活性。最后,與陰性對照進行比較,計算每個miRNA 類似物所致LUC 活性的改變倍數。針對上述LUC 實驗篩選出的miRNA分子,在細胞中分別轉染上述circRNA 的過表達載體和siRNA 化合物,繼而檢測這些miRNA 表達水平受到circRNA 調控的影響程度。
6. SCN9A 來源circRNA 在DPNP 中的潛在診斷價值和分子作用機制分析
接受者操作特性曲線(receiver operating characteristic curve,ROC 曲線)是評估臨床指標敏感性和特異性的常用邏輯回歸模型。在本研究中SCN9A來源circRNA 的表達分為健康對照組、無NP 癥狀的2 型糖尿病病人組和DPNP 病人組,其中DPNP病人組又分為中度疼痛病人亞組與重度疼痛病人亞組。整合KEGG (Kyoto Encyclopedia of Genes and Genomes)、DIANA-mirPath 和TargetScan 等多個數據分析工具對SCN9A 來源circRNA 結合的miRNA生物學作用通路進行挖掘和分析,揭示從circRNA表達到靶向功能基因改變等復雜調控的分子機制。采用分子互作圖形化展示工具Cytoscape 3.4.0 構建 DPNP 相關SCN9A 來源circRNA 的最相關調控網絡。基于上述基礎,利用免疫印跡技術 (Western blotting, WB) 檢測SCN9A 來源circRNA 分子對靶向蛋白的調控作用,驗證circRNA 影響DPNP 發生的分子生物學機制。
7. 統計學分析
本研究所有數據使用Excel 進行錄入和整理,采用統計產品與服務解決方案軟件 (Statistical Product and Service Solutions, SPSS) 17.0 版本對數據進行統計分析,P < 0.05 認為差異具有統計學意義。
結 果
1. SCN9A 來源的circRNA 在DPNP 病人血清中存在顯著的差異表達
通過生物信息學數據檢索,在人體內SCN9A基因共發現14 條circRNA 分子,本研究發現其中hsa_circ_0117953 (circ-SCN9A) 在DPNP 病 人 血 清中的水平顯著高于健康對照組(P < 0.001,見圖1A),hsa_circ_0117948 則在病人血清中較健康對照組降低(P < 0.05,見圖1A)。示意圖顯示了circ-SCN9A的生物信息學序列分析結果,其是由母基因線性轉錄本的第二至第七外顯子剪切后首尾相接形成。進一步實驗顯示了circ-SCN9A 具有抵抗RNase R 切割的circRNA 生物學特性,主要分布于細胞結構的細胞質中(見圖1C, D)。
2.多個miRNA 受到circ-SCN9A 的吸附
針對circ-SCN9A 的序列結構進行miRNA 結合能力預測,發現了37 個可能結合circ-SCN9A的miRNA 分子。本研究采用LUC 報告分析系統與37 個miRNA 類似物的文庫進行實驗驗證后發現其中6 個miRNA (miR-661、miR-1324、miR-877-3p、miR-1256、miR-153-3p、miR-1264)對LUC 的活性抑制率超過了30%(見圖2A)。將circ-SCN9A 過表達后發現這6 個miRNA 的表達均不同程度地受到抑制(見圖2B)。敲減circ-SCN9A 后,這6 個miRNA 的表達均明顯上調 (見圖2C),這說明circ-SCN9A 可以調控這6 個miRNA 的表達水平從而影響它們生物學功能的發揮,其中hsa-miR-1256與circ-SCN9A 之間的相互作用關系最為顯著(見圖2)。
3.血清circ-SCN9A 水平在DPNP 中的臨床診斷價值
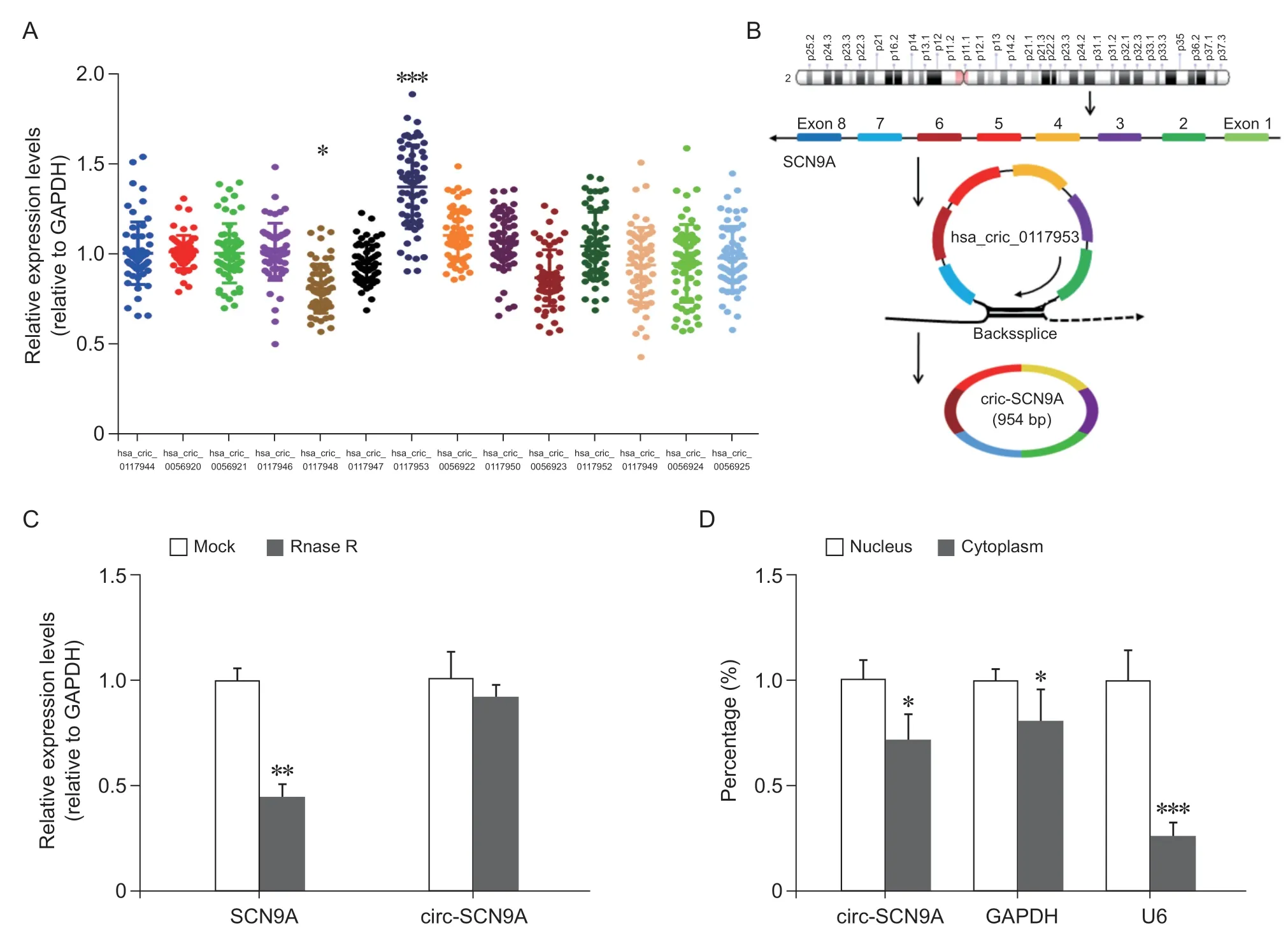
圖1 SCN9A 來源的circRNA 在DPNP 中的表達及細胞內定位(A) 在SCN9A 來源的14 條circRNA 分子中,hsa_circ_0117953 (circ-SCN9A)在DPNP 血清中呈現出顯著的高表達(n = 60),*P < 0.05,***P < 0.001,與健康對照組相比;(B) circ-SCN9A 在染色體的位置和轉錄剪切模式;(C)與線性SCN9A 轉錄本相比,circ-SCN9A 具有抵抗RNA 外切酶的生物學特性,**P < 0.01;(D)核質分離實驗證實circ-SCN9A 主要是分布于細胞質內,*P < 0.05,***P < 0.001Fig. 1 Expression and intracellular localization of SCN9A-derived circRNA in DPNP(A) Among 14 circRNA molecules from SCN9A, hsa_circ_0117953 (circ-SCN9A) showed significantly high expression in DPNP serum (n = 60), *P < 0.05, ***P < 0.001, compared with healthy control group; (B) circ-SCN9A in chromosome position and its transcriptional and cleaved pattern; (C) Compared with linear SCN9A transcript, circ-SCN9A has biological characteristics of resistance to RNA exonuclease, **P < 0.01; (D) Nucleocytoplasmic separation experiments confirmed that circ-SCN9A was mainly distributed in the cytoplasm, *P < 0.05, ***P < 0.001.
本研究發現血清中circ-SCN9A 的水平在DPNP病人和健康對照者之間存在顯著性差異(見圖1A)。ROC 曲線模型是分析連續變量特異性和敏感性的指標,曲線下的面積越大,則變量的診斷價值越大。本研究采用該模型來分析circ-SCN9A 在DPNP 中的診斷價值,結果顯示ROC 曲線的線下面積達到了0.89,敏感性為0.81,特異性為0.83(見圖2D)。為排除糖尿病本身導致circ-SCN9A 變化的影響,本研究比較了circ-SCN9A 在無NP 癥狀的2 型糖尿病病人組和健康對照組之間變化,未發現統計學差異(見圖 3A)。DPNP 伴有中度疼痛病人的血清circ-SCN9A 水平顯著低于重度疼痛病人組(P < 0.01,見圖 3B)。這些結果說明circ-SCN9A的表達變化并不受糖尿病狀態的影響,而是與其導致的DPNP癥狀相關,暗示血清中circ-SCN9A 的水平有望作為該病具有診斷價值的潛在外周生物學標志物。
4. DPNP 相關circ-SCN9A 可通過調控miR-1256影響下游靶基因的表達
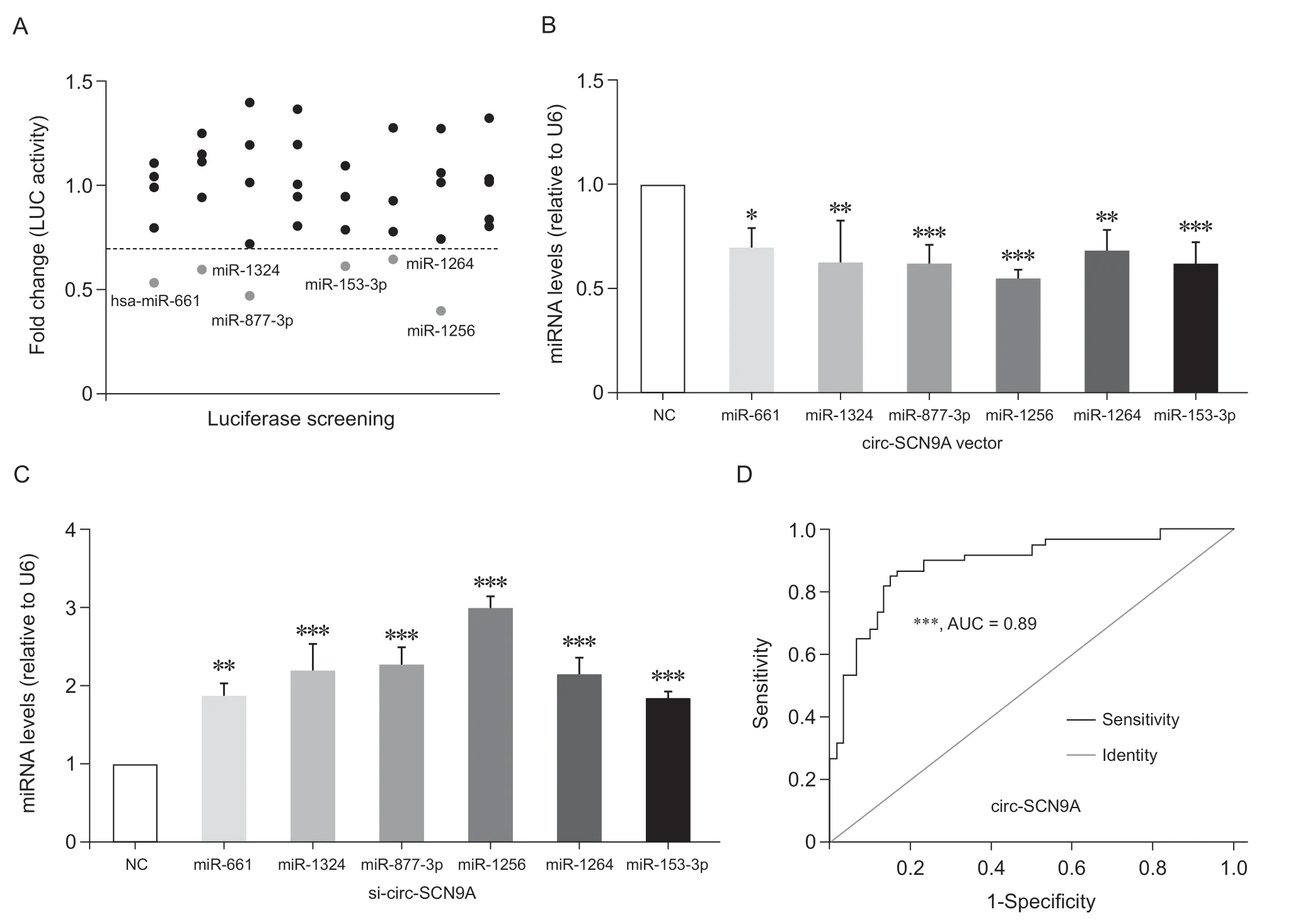
圖2 DPNP 相關的circ-SCN9A 對miRNA 的調控作用和臨床價值分析(A) LUC 報告基因實驗篩選出多個與circ-SCN9A 具有結合能力的miRNAs;(B) 與陰性對照組相比,細胞中過表達circ-SCN9A 可顯著抑制上述miRNAs 的表達,*P < 0.05,**P < 0.01,***P < 0.001;(C) 與陰性對照組相比,敲減circ-SCN9A 的表達水平可顯著提高上述miRNAs 的水平,**P < 0.01,***P < 0.001;(D) ROC 曲線分析顯示血清中circ-SCN9A 水平在DPNP 中具有較好的潛在診斷價值Fig. 2 The regulatory role of DPNP-related circ-SCN9A on miRNA and its clinical value analysis(A) A number of miRNAs with binding ability to circ-SCN9A were screened by LUC reporter gene assay; (B) Compared with negative control, upregulated circ-SCN9A in cells significantly inhibited the expression of the above miRNAs, *P < 0.05, **P < 0.01, ***P < 0.001; (C) Compared with negative control, downregulated circ-SCN9A expression can significantly improve the levels of the above miRNAs, **P < 0.01, ***P < 0.001; (D) ROC curve analysis showed that the serum level of circ-SCN9A had good potential diagnostic value in DPNP.
KEGG 是一個基因組破譯方面的數據庫,用于從分子水平來了解細胞和生物系統的高級功能,為更高層次和更復雜各種細胞活動和生物體行為作出可靠的計算推測。為探究DPNP 相關circ-SCN9A的神經生物學病理機制,本研究聯合多個生物信息學分析工具對circ-SCN9A 互相作用的多個miRNA進行KEGG 生物學作用通路分析顯示,與circ-SCN9A 存在調控作用關系的6 個miRNA 均共同參與了5-羥色胺能突觸(Serotonergic synapse) 作用通路 (見圖 4A)。對它們在該通路中的調控關系進行圖形化展示發現了多個與之有關的靶向作用蛋白基因(見圖4B)。鑒于其中miR-1256 與circ-SCN9A的作用關系最為密切(見圖2),本研究采用WB實驗對miR-1256 在該調控網絡中的靶基因鉀向內整流通道亞家族J6 (potassium inwardly rectifying channel subfamily J member 6, KCNJ6) 進行蛋白表達水平檢測,結果發現circ-SCN9A 的表達可以顯著影響下游基因KCNJ6 的蛋白水平(見圖4C)。
討 論
神經病變是糖尿病病人常見的并發癥,20%左右病人有DPNP 的癥狀,嚴重影響病人日常生活工作及心理健康,相應醫療支出也迅速增加[2,15,16]。高血糖可以使神經元處于顯著的氧化應激狀態,激活細胞內信號轉導分子引起炎癥反應,進而釋放組胺、前列腺素、細胞因子等多種細胞介質[2]。這些介質可以作用于神經細胞外膜上的痛覺感受器使其敏化,進而導致神經細胞膜上離子通道異常開放,增加興奮性神經遞質的釋放,從而使得神經細胞過度興奮,最終使機體產生痛覺過敏或超敏狀態[2]。在痛覺傳輸的過程中,編碼離子通道蛋白的基因發揮著重要的作用。SCN9A 基因編碼的離子通道蛋白Nav 1.7 是維持神經元興奮性的關鍵調節因子,其在周圍神經系統的傷害感受器神經元和大腦皮層下的結構中高度富集表達[17]。Nav 1.7 的功能獲得性突變與DPNP 等獲得性疼痛病有密切聯系[17,18]。然而,對于SCN9A 基因的環狀轉錄本在疼痛相關的疾病中的作用尚未見報道,亟待明確。
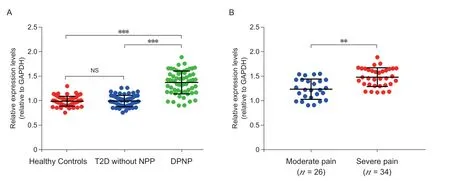
圖 3 血清circ-SCN9A 水平與疾病臨床特點之間的相關性比較(A) 血清circ-SCN9A 水平在DPNP 病人組、無NP 癥狀的2 型糖尿病病人組和健康對照組之間比較,***P < 0.001;(B) 伴有重度疼痛的DPNP 病人血清circ-SCN9A 水平顯著高于中度疼痛病人組,**P < 0.01Fig. 3 The correlation between serum circ-SCN9A level and clinical characteristics of the disease(A) Serum circ-SCN9A level among DPNP group, type 2 diabetic patients without NP symptoms and healthy controls, ***P < 0.001; (B) The serum circ-SCN9A level of DPNP patients with severe pain was significantly higher than that of patients with moderate pain, **P < 0.01.
本研究對來源于SCN9A 基因的circRNA 在DPNP 中的表達譜進行了檢測,發現部分circRNA存在顯著的差異表達,尤以circ-SCN9A 的差異最為顯著(見圖1A)。通過細胞生物學功能分析發現circ-SCN9A 可以在神經細胞質內吸附多個miRNA,進而調節這些miRNA 的生物學功能(見圖2、3)。在circRNA 與疼痛疾病的研究中發現circHIPK3 不僅在DPNP 病人的血清內高表達,而且上調程度與神經病理性疼痛分級呈正相關[14]。這提示circRNA具有作為DPNP 臨床生物學標志的潛力。本研究利用ROC 模型發現circ-SCN9A 在外周血血清中的水平具有較好的鑒別DPNP 和健康者的價值(見圖2D),且不受糖尿病本身狀態的影響并與DPNP 伴發的疼痛程度相關(見圖3),有望成為DPNP 新的客觀生物學指標。為探究其中的分子病理學基礎,本研究對circ-SCN9A 所調控的多個miRNA 的功能進行了生物信息學集合分析,發現它們可共同地作用于Serotonergic synapse(5-羥色胺能突觸)通路(見圖3A),調節多個重要功能蛋白(見圖3B)。這其中KCNJ6 基因編碼一種由G 蛋白控制的ATP 敏感的內向整流鉀通道[18,19]。已發現KCNJ6基因的突變可以降低個體對痛覺的敏感性[19],提示該基因對于人類痛覺閾值的維持具有重要的調節作用。本研究發現circ-SCN9A 的表達對于KCNJ6 基因的蛋白水平具有顯著的調節作用 (見圖3C)。這一重要發現從分子神經病理學機制層面證明了DPNP 相關的高表達circ-SCN9A 可抑制miR-1256的基因沉默作用,從而促進KCNJ6 基因的蛋白表達,進而使得DPNP 病人痛覺閾值降低,導致疼痛性臨床癥狀的發生。這一發現對于進一步深入理解DPNP 發生的分子神經病理學機制具有重要的推動作用。
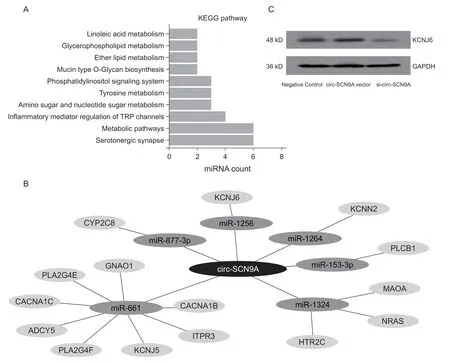
圖4 DPNP 相關的circ-SCN9A-miRNAs 調控網絡的作用通路篩選和分子機制(A) KEGG 分析顯示circ-SCN9A 所調控的6 個miRNAs 均作用于5-羥色胺能突觸(serotonergic synapse)通路;(B) 構建circ-SCN9A-miRNAs-mRNA 調控網絡展示circ-SCN9A 在該通路中的基因調控關系;(C) circ-SCN9A 的表達可以顯著影響上述調控網絡中下游基因KCNJ6 的蛋白水平Fig. 4 The pathway screening of DPNP-related circ-SCN9A-miRNAs regulatory network and their molecular mechanism(A) KEGG analysis showed that the 6 miRNAs regulated by circ-SCN9A all acted on the Serotonergic synapse pathway; (B) The regulatory network of circ-SCN9A-miRNAs-mRNA was constructed to demonstrate the gene regulatory relationship in this pathway; (C) Expression of circ-SCN9A can significantly affect the protein level of the downstream gene KCNJ6 in the above regulatory network.
DPNP 的臨床診斷主要依靠于病人的糖尿病病史和臨床表現,一直缺乏有臨床價值的生物標記物,對于DPNP 病情的客觀評估造成一定的困難。目前多項研究已證實circRNA 在外周血中具有較高的穩定性和表達豐度,有望作為神經疾病診斷和治療的潛在生物標記[20]。外周血血清circRNA 的檢測具有無創、快速和低成本的優點,本研究中DPNP 血清高表達的circ-SCN9A 不僅參與了DPNP 的發生發展并有望具備作為該病潛在的生物學診斷標志的臨床價值。目前,雖然部分具有5-羥色胺再攝取抑制作用的藥物(如度洛西汀)對于DPNP 的治療顯示出較為肯定的療效,但其詳細作用機制卻未能完全闡明[2,15]。本研究揭示DPNP 中高表達的circ-SCN9A 可作用于5-羥色胺能突觸通路,這強烈提示在DPNP 發生過程中該通路被阻滯或許是此類藥物發揮DPNP 治療效果的分子藥理學基礎之一。然而,此類藥物對于5-羥色胺能突觸通路的下游基因靶點的阻斷不具有選擇性,因此常存在諸多不良反應和治療風險。
本研究的不足之處在于缺乏活體動物模型來驗證上述臨床發現和細胞學機理,然而本研究為后續開發針對DPNP 中5-羥色胺能通路的上游和下游靶點更加特異性的靶向藥物提供了前期基礎,具有重要的轉化醫學價值。
綜上所述,本研究首次闡述了人類疼痛相關基因SCN9A 來源的circRNA 與神經病理性疼痛的關系,發現血清中circ-SCN9A 有望作為DPNP 的潛在臨床生物學標記,為更深入理解DPNP 發生的分子病理學機制提出了新的思路,對后續該病特異性靶向治療策略的提出具有重要的推動意義。

