TRPV1 通過非焦慮依賴的機制參與腸易激綜合征內臟高敏感的形成*
鄭浩楠 張 瑛 遲 雁△
(1 北京大學第一醫院消化科,北京100034;2 北京大學神經科學研究所; 3 北京大學基礎醫學院神經生物學系;4 教育部/國家衛生健康委員會神經科學重點實驗室,北京100191)
腸易激綜合征 (irritable bowel syndrome, IBS) 是臨床最常見的胃腸功能紊亂性疾病,以腹痛、腹脹或腹部不適伴有排便習慣及排便性狀的改變為主要表現,同時缺乏明顯的形態學改變及臨床常規檢查的異常[1,2]。難以緩解且反復發作的腹痛癥狀是IBS 病人的典型臨床表現,其不僅嚴重影響病人的生活質量,同時也造成大量醫療資源的浪費。目前認為,腦-腸軸互動紊亂、內臟高敏感、腸道菌群紊亂、胃腸道動力異常、腸黏膜屏障受損、黏膜免疫與炎癥、精神神經因素、遺傳等機制共同參與IBS 的產生[3],其中內臟高敏感 (visceral hypersensitivity) 被認為是IBS 的核心病理生理學機制和生物學標記[4],但是關于其形成機制目前尚不清楚。探討IBS 內臟高敏感的形成機制,對發掘新的IBS 腹痛的治療靶點和臨床治療方案具有重要意義。
瞬時受體電位通道香草素亞型1 (transient receptor potential vanilloid, TRPV1) 是一種傷害性信息感受分子,可接受熱 (> 43oC)、H+、辣椒素等多種形式的刺激,引起傷害性感受器的激活,傳遞傷害性信息[5,6]。TRPV1 高表達在外周感覺神經元及其神經末梢,在支配消化道的內臟感覺神經纖維中也有廣泛的分布[7],并且有多項研究表明,TRPV1 可通過表達和功能的改變參與IBS 內臟高敏感的產生,其機制涉及TRPV1 與膽汁酸和肥大細胞表面及釋放的多種分子的相互作用[8~10]。
臨床上,IBS 病人的焦慮/抑郁水平顯著高于一般人群[11],而且研究發現,機體在經歷生理和心理應激后,不僅可產生焦慮/抑郁情緒,同時對內臟疼痛信號的感知也有所增強,即產生內臟高敏感[12~14]。有研究顯示,TRPV1 受體可能參與焦慮/抑郁情緒的產生,除外周神經系統外,在多個腦區如海馬、杏仁核、前額葉皮質等,均可檢測到TRPV1 受體的表達,且在給予TRPV1 受體拮抗劑后,能明顯緩解動物的焦慮/抑郁程度[15~17]。另外,有研究認為,TRPV1 受體可介導位于基底外側杏仁核 (basolateral amygdala, BLA) 內突觸傳遞功能的增強,這可能是內臟痛的中樞敏化機制之一[18]。因此TRPV1 受體介導的焦慮水平的改變,是否可以作為IBS 內臟敏感性升高的原因及其相關機制值得進一步探討。本研究旨在探討 TRPV1 是否可以通過影響焦慮水平從而進一步影響IBS 內臟高敏感的產生。研究將為明確TRPV1 參與IBS 內臟高敏感形成所涉及的途徑提供新的證據,從而為臨床IBS 難治性腹痛的治療提供進一步的理論依據。
方 法
1.實驗動物及分組
本實驗所用動物均為雄性11 周齡,清潔級,體重為20~30 g 的野生型C57BL/6 小鼠和背景為C57BL/6的Trpv1-/-小鼠;飼養環境溫度為 (20±1)oC,空氣濕度為 (50±5)%,光照為12/12 h 的明暗光照循環。動物自由飲水攝食,每日更換飲水、飼料,定期更換墊料,保持小鼠生活環境通風及清潔衛生。野生型與Trpv1-/-小鼠分別隨機分為溶劑注射組 (CTRL) 與IBS 模型組 (IBS),共4 組,每組8~10 只。
2. IBS 內臟高敏感模型的建立
各組小鼠在造模前24 h 自由飲水但禁食。使用0.1 ml 三硝基苯磺酸 (trinitrobenzene sulfonic acid, TNBS) (sigma, P2297) 灌腸液 (TNBS 130 μg/ml 溶于30%乙醇),緩慢注入IBS 模型組小鼠結腸。對照組小鼠使用同樣方法,給予同等劑量的30%乙醇溶液灌腸。參照此前報道的方法進行[19]。
灌腸結束后,將所有小鼠放回原飼養籠,常規環境飼養,正常進食進水。隨后為28 天的緩解期。緩解期結束進行內臟敏感性的檢測,常規進行小鼠結腸炎癥水平的評估。
3. IBS 模型內臟敏感性的評估
采用結直腸擴張 (colorectal distension, CRD)-腹壁撤回反射 (abdominal withdrawal reflex, AWR) 的方法檢測內臟敏感性。
異氟烷(瑞沃德生命科技有限公司,中國)麻醉小鼠后,潤滑球囊并小心緩慢插入小鼠結腸,至球囊距離肛緣1 cm,并將導管固定于小鼠尾部。將小鼠置于固定器中,保持小鼠只可前后運動但不能轉身。待復蘇至少40 min 后開始CRD 操作。快速向球囊內充氣。將球囊內壓力維持在20、40、60及80 mmHg,每個壓力持續20 s,重復3 次,同一壓力每次充氣后為1 min 無壓力的間歇期。不同壓力之間為5 min 的間歇期。觀察不同壓力的CRD 下,小鼠腹壁撤回反射程度,并根據Al-Chaer 評分標準進行相應的評分(見表1)。為保證實驗操作的嚴謹性,CRD-AWR 檢測由兩位不同實驗人員依從盲法記錄實驗結果,每只小鼠的每個CRD 壓力重復記錄3 次并取平均值。

表1 Al-Chaer 評分標準Table 1 Al-Chaer AWR score
4.曠場實驗 (open field test, OFT) 及高架十字迷宮 (elevated plus maze, EPM)
通過曠場實驗和高架十字迷宮實驗反映小鼠的焦慮樣行為。
曠場實驗:塑料制箱 (小鼠 50 cm×50 cm ×100 cm 長×寬×高) 置于安靜的環境中,照明來自曠場上方白熾燈。實驗開始前,將實驗用小鼠置于實驗環境中適應1 h 后開始實驗。將小鼠放置在曠場中心開始測試,每只小鼠測試間隙,用酒精擦拭測試箱,防止上一只小鼠遺留的氣味或臟物干擾實驗結果。小鼠的行為由攝像頭記錄,中心區域(小鼠 25 cm×25 cm)停留的時間、進入中心區域次數及總運動距離由ANY-MAZE 軟件進行分析。
高架十字迷宮:儀器由四個大小相同的塑料臂 (小鼠5 cm×35 cm)和一個中心平臺(小鼠5 cm×5 cm)組成,其中兩個相對的塑料臂為封閉臂,被40 cm 塑料墻封閉。實驗開始前,將實驗用小鼠置于實驗環境中適應1 h 后開始實驗。將小鼠至于迷宮中央,頭朝開臂,每只小鼠測試間隙,用酒精擦拭測試儀器,防止上一只小鼠遺留的氣味或臟物干擾實驗結果。小鼠的行為由攝像頭記錄,開放臂停留時間比例、進入開放臂次數及總運動距離由ANY-MAZE 軟件進行分析。
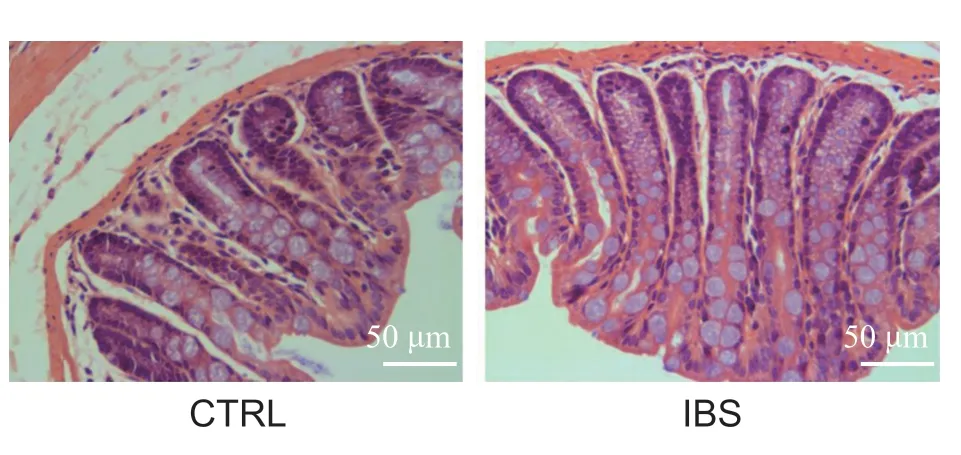
圖1 野生型小鼠溶劑注射組(WT-CTRL)和IBS 模型組(WT-IBS),造模后第28 天,結腸H&E 染色圖。結果顯示,與溶劑注射組(WT-CTRL) 類似,IBS 模 型 組(WT-IBS) 在TNBS 注 射 后28 天,結腸組織均完整,無明顯的充血和炎性細胞浸潤。標尺 = 50 μmFig. 1 H&E (hematoxylin and eosin) staining images of colon tissues 28 d after solvent (WT-CTRL) (left) or TNBS (WT-IBS) (right) injection in wild-type mice. The images show that analogous to the solvent-injected mice, the colon tissues of TNBS-injected mice are intact and no obvious congestion and inflammatory cell infiltration were observed. Scale bar = 50 μm
5.統計學分析
結 果
1. TRPV1 參與IBS 內臟高敏感的形成
參照文獻[19],選取了單次灌注0.1 ml TNBS 灌腸液(TNBS 130 μg/ml 溶于30%乙醇)的方法構建IBS 模型。野生型 (wild type, WT) 小鼠在TNBS 灌注后第28 天,結腸組織完整,無明顯的充血和炎性細胞浸潤(見圖1),表明本研究所用的TNBS 劑量不會引起持續的炎癥反應,28 天可認為炎癥期結束。同時,通過CRD-AWR 法檢測了IBS 造模后小鼠內臟敏感性的變化。結果顯示,與溶劑注射組 (WT-CTRL) 相比,IBS 模型組小鼠 (WT-IBS) 在40 mmHg (P < 0.05) 和60 mmHg (P < 0.001) 的壓力下,內臟敏感性升高,具有顯著性差異(見圖2)。以上結果表明,應用TNBS 單次灌腸的方法在野生型小鼠成功構建了IBS內臟高敏感模型。
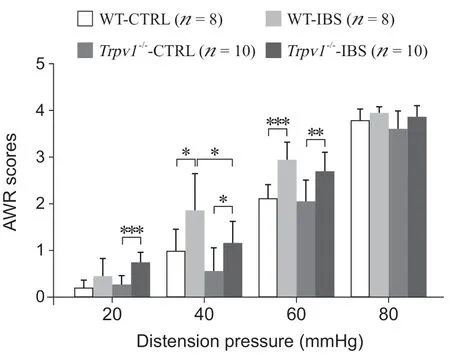
圖2 WT 小鼠與Trpv1-/-小鼠結腸灌注 TNBS 前后 CRDAWR 評分比較非參數檢驗Mann-Whitney 法,*P < 0.05,**P < 0.01,***P < 0.001Fig. 2 Comparison of the CRD-AWR scores of WT and Trpv1-/- mice after intro-colonic injection of solvent (CTRL) or TNBS (IBS)Mann-Whitney Non-parametric tests, *P < 0.05, **P < 0.01,***P < 0.001.
為進一步驗證TRPV1 受體參與IBS 模型內臟高敏感性的形成,本研究使用Trpv1-/-小鼠構建了IBS模型。在TNBS 單次灌腸后第28 天CRD-AWR 法檢測顯示,Trpv1-/-造模小鼠(Trpv1-/--IBS)與Trpv1-/-溶劑注射組(Trpv1-/--CTRL) 相比,其在20 mmHg (P < 0.001)、40 mmHg (P < 0.05) 和 60 mmHg (P < 0.01) 的壓力下均表現出內臟敏感性增加,具有顯著性差異(見圖2)。同時,與野生型IBS模型組 (WT-IBS) 小鼠相比,Trpv1-/-IBS 模型組 (Trpv1-/--IBS) 小鼠在40 mmHg 的壓力下,表現出內臟高敏感性的緩解,差異具有顯著性(P < 0.05,見圖2)。以上結果表明,TRPV1 受體可參與IBS 內臟高敏感性的形成,但內臟高敏感并非僅通過TRPV1 受體這一單一途徑形成,其他機制也參與其中。
2. TRPV1 參與焦慮情緒的產生
接下來進行了曠場實驗與高架十字迷宮檢測,觀察IBS 模型小鼠焦慮水平的改變情況。
曠場實驗結果顯示,與野生型小鼠相比,Trpv1-/-小鼠不管在基礎狀態還是IBS 造模后,均顯示中心區停留時間延長,具有顯著性差異(P < 0.05,見圖3A),但兩種基因型小鼠均未顯示IBS 造模前后,中心區停留時間的變化。類似的,Trpv1-/-小鼠在IBS 造模后 (Trpv1-/--IBS) 與野生型小鼠IBS 造模后 (WT-IBS) 比較顯示,其進入中心區次數有增加的趨勢(P = 0.056,見圖3B)。總運動距離的比較顯示,野生型小鼠溶劑注射組和IBS 模型組、Trpv1-/-溶劑注射組和IBS 模型組,各組小鼠之間均無顯著性差異(見圖3C),提示各組小鼠的運動能力無差別。
高架十字迷宮結果顯示,各組小鼠進入開放臂的時間比例(見圖4A)、開放臂進入次數(見圖4B)及總運動距離(見圖4C)均無顯著性差異。
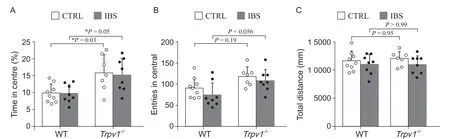
圖3 曠場實驗結果顯示,在基礎狀態和IBS 造模后,與野生型小鼠相比,Trpv1-/-小鼠中央區停留時間延長(A);進入中央區次數有增加的趨勢(B);總運動距離無顯著性變化(C) (two-way ANOVA with Tukey's post-test)Fig. 3 Open field test showed that compared with the wild type mice,both under the basal condition and in the IBS model,Trpv1-/- mice spent more time in central (A); showed an increased tendency in the entries in central (B); and showed no significant change in the total distance travelled (C) (two-way ANOVA with Tukey's post-test).
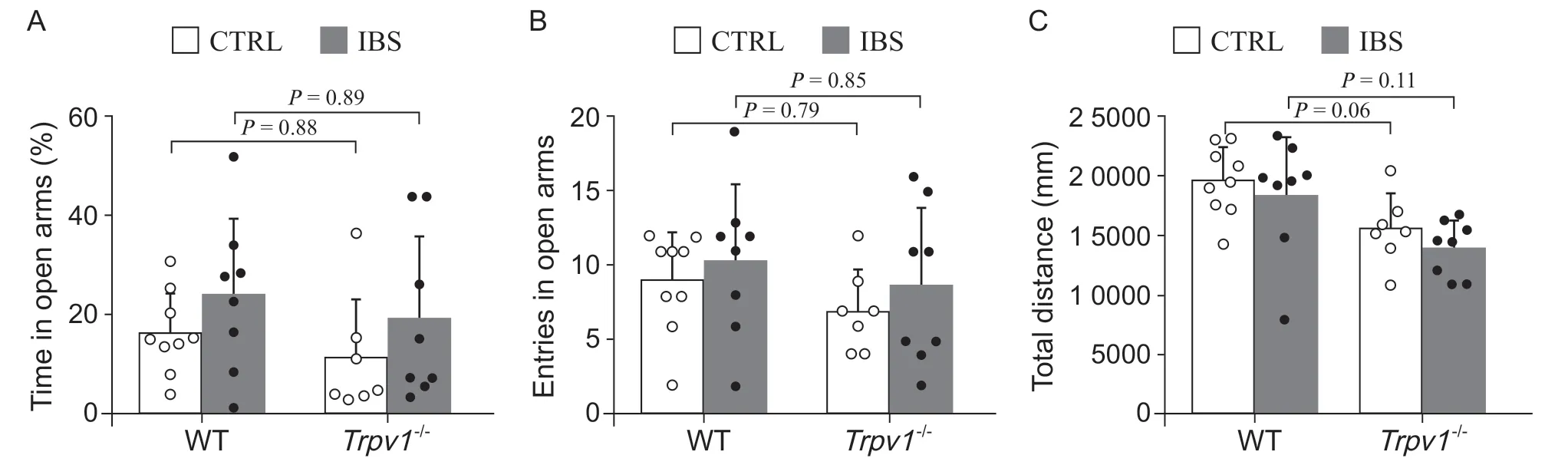
圖4 高架十字迷宮實驗顯示,在基礎狀態和IBS 造模后,與WT 小鼠比較,Trpv1-/-小鼠的開放臂停留時間(A);開放臂進入次數(B)和總運動距離(C)均無顯著性變化(two-way ANOVA with Tukey's post-test)Fig. 4 Elevated plus maze assay showed that compared with the wild type mice,both under the basal condition and in the IBS model, there is no significant difference in the time spent in the open arms (A); Entries in the open arms (B) and total distance travelled (C) between WT and Trpv1-/- mice (two-way ANOVA with Tukey's post-test).
討 論
IBS 內臟高敏感模型的構建方法種類繁多,如束縛應激、母嬰分離-避水應激、葡聚糖硫酸鈉 (dextran sulfate sodium, DSS) 灌腸、乙酸灌腸等。在眾多方法中,結腸內灌注TNBS 是應用最為廣泛的造模方法。TNBS 是一種化學半抗原,能夠與組織蛋白結合并刺激Th1 細胞介導的免疫反應。該方法能夠較好地模擬IBS 病人的內臟高敏感、結腸動力紊亂、黏膜通透性及分泌改變等病理特征。本研究結果也證實,應用該方法建立的野生型小鼠IBS模型28 天未顯示結腸炎癥的病理改變,同時使用CRD-AWR 法檢測到,IBS 模型組小鼠在40 mmHg和60 mmHg 壓力下內臟敏感性升高,表明TNBS單次灌腸方法建立的IBS 模型是探究內臟高敏感性的可靠模型。
近些年的多項研究證實TRPV1 受體與內臟高敏感的形成相關[20]。Akbar 等發現IBS 病人的乙狀結腸黏膜中TRPV1 表達上調[21]。另一項研究顯示,在結腸炎康復期,Trpv1-/-小鼠并未表現出和野生鼠類似的疼痛相關行為學改變或結腸擴張的內臟動力學改變[22]。在本研究中,使用Trpv1-/-小鼠也成功構建了IBS 模型,提示IBS 內臟高敏感的形成并非TRPV1 相關的單一通路所致,其產生是多種因素共同作用的結果。但與野生型IBS 模型組小鼠相比,敲除Trpv1 基因能夠顯著降低TNBS 灌注引起的內臟高敏感性,提示TRPV1 受體是參與IBS 內臟高敏感產生的重要分子之一。
臨床上,IBS 病人往往合并焦慮或抑郁狀態[11]。心理或生理應激除誘發機體出現焦慮/抑郁情緒,亦可導致機體對內臟痛覺的感知增加[14]。研究表明,TRPV1 受體與焦慮情緒的產生有關。除已在多個腦區檢測到TRPV1 受體的表達外[23],研究發現,給予大鼠腹腔注射capsazepine,能夠減少其焦慮樣行為的產生[24], 將capsazepine 微量注射入大鼠腹內側前額葉皮層 (vmPFC) 后可發揮其抗焦慮作用[25]。
本研究探討了TRPV1 是否可以通過影響焦慮水平而參與內臟敏感性的形成。研究發現,Trpv1基因敲除小鼠出現基礎焦慮水平的顯著降低,但與對照組相比,IBS 模型組并未顯示有焦慮水平的升高。Salameh 等[26]的研究發現:連續3 周,給予0.25 ml 的不同濃度 (15, 30, 45 mg TNBS) 的TNBS-50%乙醇溶液灌腸,誘導的結腸炎模型小鼠,其在緩解期的焦慮水平升高。本研究與之結果不同的原因,我們考慮與TNBS 的灌腸劑量有關。雖然TNBS 灌腸作為經典的感染后IBS (post-infection IBS, PI-IBS)內臟高敏感動物模型已經得到了廣泛的認可,但其缺點在于現存的使用TNBS 造模的動物實驗中,始終無統一的灌腸劑量與灌腸位置及模型評估時間。灌腸位置與劑量的不同,能夠引起不同程度的Th1型細胞介導的免疫反應,造成不同程度的炎癥反應。因此我們認為本研究所用的TNBS 造模劑量不足以引起小鼠焦慮水平的改變。另一方面,研究表明TRPV1 受體參與焦慮/抑郁情緒的產生。本研究分別借助野生型和Trpv1 敲除的小鼠構建了IBS 模型,均檢測到內臟敏感性的升高且Trpv1 基因敲除可緩解IBS 導致的內臟高敏感,但是與各自的溶劑注射組相比,并未檢測到焦慮水平的改變。由于TNBS造模后,Trpv1-/-小鼠在不改變其焦慮水平的情況下,仍然表現出內臟高敏感緩解的現象,提示TRPV1受體參與焦慮和內臟敏感性的形成可能為兩條不同的通路,不存在相關性。因此認為在TNBS 誘導的IBS 模型中,TRPV1 受體可能通過非焦慮依賴的機制參與內臟高敏感形成。
在本研究中,沒能在高架十字迷宮實驗中發現Trpv1-/-小鼠焦慮水平的改變。針對這種曠場實驗和高架十字迷宮實驗結果不一致的現象,我們認為可能的原因是在于曠場實驗后再次進行高架十字迷宮實驗,小鼠對這種刺激已經產生適應,所以并未在高架十字迷宮實驗中產生明顯差異。類似的情況在此前的一項關于TNBS 誘導的結腸炎緩解期焦慮水平的研究中也有報道[26]。因此,接下來會進一步擴大實驗樣本量,確認該實驗結果。
綜上所述,TRPV1 參與IBS 內臟高敏感的形成,也影響焦慮狀態的形成。但在TNBS 模型中其影響內臟高敏感形成的過程可能主要是通過非焦慮依賴的機制參與。今后若需進一步探尋TRPV1 受體通過焦慮影響內臟敏感性的產生,可以嘗試增加TNBS 灌腸劑量或使用其他化學誘導法如葡聚糖硫酸鈉(dextran sulfate sodium, DSS)灌腸、乙酸灌腸的造模方法,比較WT 鼠與Trpv1-/-鼠構建IBS 模型后的差異。在觀察到內臟敏感性與焦慮水平有所改變的基礎上,繼續比較灌腸給藥和腦室注射TRPV1 拮抗劑后內臟敏感性水平改變的差異,以期能更準確的說明中樞和外周TRPV1 受體在此中發揮的作用。

