牙齦癌組織中VEGF和PTEN的表達與患者血清中炎性指標水平的相關性
王祥軍 王 進 孟娜娜
牙齦癌是臨床常見口腔惡性腫瘤之一,具有較強的頸淋巴結轉移能力,因此治愈難度較大[1]。臨床上通常采用手術方式徹底切除病變組織以達到治療的目的,但術后并發癥發生率較高,從而對治療效果和患者手術預后造成不利影響[2-3]。相關研究表明:不良飲食習慣、口腔疾病史、HPV感染以及不良修復體的使用均增加了牙齦癌的發生風險[4-5]。相關研究表明:血管內皮細胞生長因子(vascular endothelial growth factor,VEGF)及張力蛋白同源基因(phosphatase and tensin homolog,PTEN)與牙齦癌的發生和進展密切相關[6]。本研究通過分析不同分化程度牙齦癌患者癌組織中VEGF和PTEN的表達與患者血清中炎性指標的相關性,從而為牙齦癌診斷提供依據。
1 資料與方法
1.1 一般資料
選擇60例2017年1月至2020年1月于我院進行牙齦癌根治術的患者為研究對象,根據其癌組織分化程度將其分為高分化組(27例)、中分化組(18例)和低分化組(15例),另取癌旁組織作為對照組(60例)。4組患者一般資料見表1,差異均無統計學意義(P>0.05),可進行比較。本研究經本院倫理委員會批準,所有患者及其家屬均知情同意,并簽署同意書。
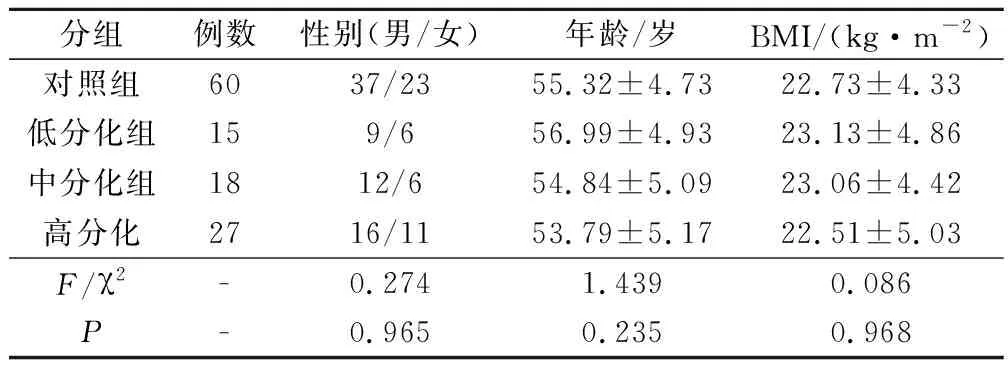
表1 患者一般資料
1.2 方法
(1)免疫組織化學染色(SP法)檢測牙齦癌組織中VEGF和PTEN的陽性表達情況:采用免疫組化試劑盒(兩步法)、DBA顯色試劑盒和鼠抗人VEGF和鼠抗人PTEN單抗,按照試劑盒說明書操作,光學顯微鏡下觀察并拍照。陽性染色結果采用雙盲法,由本院病理科兩位醫師獨立進行評判:VEGF在癌組織細胞膜或胞質中呈棕黃色;PTEN則在胞質或細胞核內呈棕黃色,單個切片中以上兩個指標表達陽性面積分別≥25%即判定為陽性;Motic Med 6.0軟件分析圖像中積分光密度值(integrated optical density,IOD)[6]。(2)牙齦癌根治術前1 d清晨,所有患者空腹狀態抽取靜脈血5 ml,室溫下離心分離血清,人ELISA試劑盒分別檢測各組患者血清中IL-10和TNF-α的含量。
1.3 統計學方法
2 結果
2.1 各組患者牙齦癌組織中VEGF和PTEN的陽性表達情況比較
各組患者牙齦癌組織中VEGF和PTEN的陽性表達率比較差異有統計學意義(P均<0.05)。與對照組、中分化組和高分化組相比,低分化組VEGF陽性表達率顯著增加,PTEN陽性表達率顯著減少(P均<0.05);對照組、中分化組和高分化組VEGF陽性表達率相比差異不具有統計學意義(P均>0.05);中分化組和高分化組PTEN陽性表達率均較對照組顯著下降,而該2組相比差異不具有統計學意義(P均>0.05)。見表2。

表2 各組患者牙齦癌組織中VEGF和PTEN的陽性表達結果比較(例,%)
2.2 各組患者牙齦癌組織中VEGF和PTEN表達的IOD值比較
各組患者牙齦癌組織中VEGF和PTEN表達的IOD值比較差異有統計學意義(P均<0.05)。與對照組相比,高、中、低分化組牙齦癌組織中VEGF表達的IOD值均顯著增加,PTEN表達的IOD值均顯著降低(P均<0.05);與高分化組相比,中、低分化組牙齦癌組織中VEGF表達的IOD值均顯著增加,PTEN表達的IOD值均顯著降低(P均<0.05);與中分化組相比,低分化組牙齦癌組織中VEGF表達的IOD值均顯著增加,PTEN表達的IOD值均顯著降低(P均<0.05)。見表3。
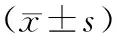
表3 各組患者牙齦癌組織中VEGF和PTEN表達的IOD值比較
2.3 各組患者血清中炎性因子含量比較
各組患者血清中炎性因子IL-10和TNF-α含量比較差異有統計學意義(P均<0.05)。與對照組相比,高、中、低分化組患者血清中IL-10含量均顯著降低,TNF-α含量均顯著增加(P均<0.05);與高分化組相比,中、低分化組患者血清中IL-10含量均顯著降低,TNF-α含量均顯著增加(P均<0.05);與中分化組相比,低分化組患者血清中IL-10含量均顯著降低,TNF-α含量均顯著增加(P均<0.05)。見表4。
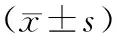
表4 各組患者血清中炎性因子含量比較
2.4 相關性分析
相關性分析結果顯示:VEGF表達與IL-10含量呈顯著負相關(γ=-0.994,P=0.003),與TNF-α含量呈顯著正相關(γ=0.990,P=0.005);PTEN表達與IL-10含量呈顯著正相關(γ=0.933,P=0.034),與TNF-α含量呈顯著負相關(γ=-0.949,P=0.026)。
3 討論
牙齦癌是發病率、轉移率和復發率均較高的口腔惡性腫瘤之一,目前該腫瘤無靶向藥物可用于治療,雖手術治療有效率較高,但預后不佳[7]。因此牙齦癌發病機制及診斷的相關研究對其精準治療具有重要意義。
血管內皮生長因子(vascular endothelial growth factor,VEGF)是刺激血管生成的細胞因子之一,通常在癌組織中高表達[8],目前其受體酪氨酸激酶抑制劑(VEGFR-TKIs)的使用已使得各種腫瘤類型患者的臨床結局得到了顯著改善[9]。磷酸酶和張力蛋白同源物(phosphatase and tensin homolog,PTEN)是一種抑癌基因,是人類癌癥遺傳缺陷的最常見靶標之一,參與細胞增殖、分化、凋亡等一系列生理病理過程[10-11]。牙齦癌相關研究顯示,不同分化程度的牙齦癌組織中PTEN甲基化和蛋白表達均存在顯著差異[12]。牙齦癌高分化是指癌細胞分化程度接近于正常細胞,成熟度高,而高分化牙齦癌其惡性腫瘤級別低,惡性程度低,屬于早期,以手術切除為主。本研究對不同分化程度牙齦癌患者癌組織中VEGF和PTEN表達進行檢測和比較,結果顯示:與對照組、中分化組和高分化組相比,低分化組VEGF陽性率顯著增加,PTEN陽性率顯著減少,中分化組和高分化組PTEN陽性率均較對照組顯著增加(P均<0.05),其余分組以上兩個指標相比差異不具有統計學意義(P均>0.05),表明隨著腫瘤分化程度的降低(即腫瘤惡性程度的增加),VEGF陽性的患者例數逐漸上升,PTEN陽性患者例數逐漸下降。而與對照組相比,高、中、低分化組牙齦癌組織中VEGF表達的IOD值均顯著增加,PTEN表達的IOD值均顯著降低(P均<0.05);與高分化組相比,中、低分化組牙齦癌組織中VEGF表達的IOD值均顯著增加,PTEN表達的IOD值均顯著降低(P均<0.05);與中分化組相比,低分化組牙齦癌組織中VEGF表達的IOD值均顯著增加,PTEN表達的IOD值均顯著降低(P均<0.05),表明:隨著腫瘤分化程度的降低(即腫瘤惡性程度的增加),癌組織中VEGF表達顯著增加,PTEN表達顯著降低。與上述前人研究結果一致。另外,本研究中,牙齦癌患者血清中炎性指標研究結果顯示:患者血清中抗炎因子IL-10的含量隨腫瘤分化程度的降低而顯著降低,促炎因子TNF-α的含量隨腫瘤分化程度的降低而顯著增加(P均<0.05),且相關性分析結果顯示:VEGF表達與IL-10含量呈顯著負相關,與TNF-α含量呈顯著正相關(P均<0.05),PTEN表達與IL-10含量呈顯著正相關,與TNF-α含量呈顯著負相關(P均<0.05)。以上表明:炎癥因子與牙齦癌的發生、分化及進展密切相關,與前人相關研究結果一致[13-14],因此可考慮將牙齦癌患者血清中炎性因子水平變化作為癌癥診斷和預測的參考指標,也可將其用于對牙齦癌術后患者預后的評估。
另外,本研究不足之處在僅分析了炎性因子水平變化對牙齦癌的預測價值,并未深入分析其判定具體數值范圍,需在后續擴大樣本量進行深入探討。總而言之,牙齦癌患者血清中炎性因子含量與癌組織中VEGF和PTEN的表達具有顯著相關性,因此患者血清中炎性因子變化可能與牙齦癌發生、進展相關,也可能一定程度反映患者的預后。

