COX-2、CD44V6與卵巢癌惡性生物學(xué)指標(biāo)的關(guān)系
狄海紅 馮未萍 王鳳姣
臨床上卵巢癌患者的多器官功能衰竭風(fēng)險可超過15%以上,同時患者的遠期生存預(yù)后惡化程度較高[1-2]。有研究指出,在卵巢癌病情發(fā)展的過程中,細胞因子或者腫瘤蛋白表達異常,進而影響了卵巢生發(fā)上皮細胞的異常病變,從而促進卵巢腫瘤的發(fā)生發(fā)展。環(huán)氧化酶-2(COX-2)是氧化酶家族成員,能夠通過影響到卵巢癌細胞的增殖速度,提高了卵巢癌細胞的轉(zhuǎn)錄激活程度,從而促進癌細胞的持續(xù)性自我擴增效應(yīng)[3];CD44變異性V6(CD44V6)是跨膜糖蛋白,能夠通過誘導(dǎo)癌細胞粘附和浸潤,增強癌細胞對于基膜組織的突破能力,進而促進卵巢癌的發(fā)生發(fā)展[4]。部分研究者認為在卵巢癌患者中,COX-2的表達濃度可顯著上升[5],但對于CD44V6的分析不足。本文選取90例卵巢癌標(biāo)本,探討了COX-2、CD44V6的表達及其與卵巢癌患者的臨床病理特征相關(guān)性,并將結(jié)果報告如下。
1 資料與方法
1.1 一般資料
收集了我院2017年1月至2019年3月的90例卵巢癌標(biāo)本作為卵巢癌組、45例卵巢良性腫瘤組織標(biāo)本為良性組。納入標(biāo)準(zhǔn):①卵巢癌、卵巢良性腫瘤均以手術(shù)后病理學(xué)檢查結(jié)果作為金標(biāo)準(zhǔn);②診斷標(biāo)準(zhǔn)參考中華醫(yī)學(xué)會制定的標(biāo)準(zhǔn)[6];③年齡范圍19~59歲;④所有納入對象既往均無放化療、免疫學(xué)治療史;⑤本研究經(jīng)醫(yī)學(xué)倫理委員會的批準(zhǔn)。排除標(biāo)準(zhǔn):①伴有全身感染性疾病;②肝腎功能疾病;③長期使用糖皮質(zhì)激素、免疫抑制劑的患者;④其他部位惡性腫瘤。卵巢癌組,年齡范圍33~58歲,平均(46.6±7.0)歲,臨床分期:Ⅰ期患者21例、Ⅱ期患者31例、Ⅲ期患者29例、Ⅳ期患者9例;分化程度:高分化患者26例、中分化患者31例、低分化患者33例;發(fā)生淋巴結(jié)轉(zhuǎn)移陽性55例。良性組,年齡范圍36~59歲,平均(48.0±9.4)歲;黏液性囊腺瘤20例、漿液性囊腺瘤16例、成熟畸胎瘤9例。2組患者就上述一般資料比較,差異無統(tǒng)計學(xué)意義(P>0.05),可進行比較。
1.2 COX-2蛋白、CD44V6蛋白的免疫組化檢測方法
將標(biāo)本石蠟包埋后,行連續(xù)性切片厚度為3 m,在溫度60 ℃下烤片60 min后脫水,使用EDTA進行抗原修復(fù),加入10 μl蒸餾水及10%過氧化氫5 μl,并在室溫下孵育30 min,再采用磷酸鹽緩沖液(PBS)洗滌3次×3 min后,加入P16蛋白的單克隆抗體(1∶1000 購自羅氏檢測公司),37 ℃孵育60 min,PBS洗滌3次×3 min,加入HRP標(biāo)記的COX-2、CD44V6二抗(1∶2000 購自羅氏公司),37 ℃孵育20 min,PBS洗滌3次×3 min,加入DAB后,PBS沖洗和復(fù)染,脫水后進行仔細觀察。
1.3 結(jié)果判定
(1)根據(jù)著色程度分為:0分-無色、1分-淡黃色、2分-棕黃色、3分-褐色、黑色;(2)根據(jù)陽性細胞比例分為:1分-陽性細胞數(shù)目所占比例≤10%、2分-陽性細胞所占比例>10%~50%、3分-陽性細胞數(shù)>50%~75%、4分-陽性細胞數(shù)所占比例>75%。兩種積分相乘總分<3分為陰性、≥3分為陽性。
1.4 統(tǒng)計學(xué)處理
2 結(jié)果
2.1 卵巢癌組織、卵巢良性腫瘤中的COX-2、CD44V6蛋白表達水平比較
卵巢癌組織中的COX-2蛋白、CD44V6蛋白陽性表達率明顯高于卵巢良性腫瘤組織,差異均具有統(tǒng)計學(xué)意義(P<0.05),見表1。
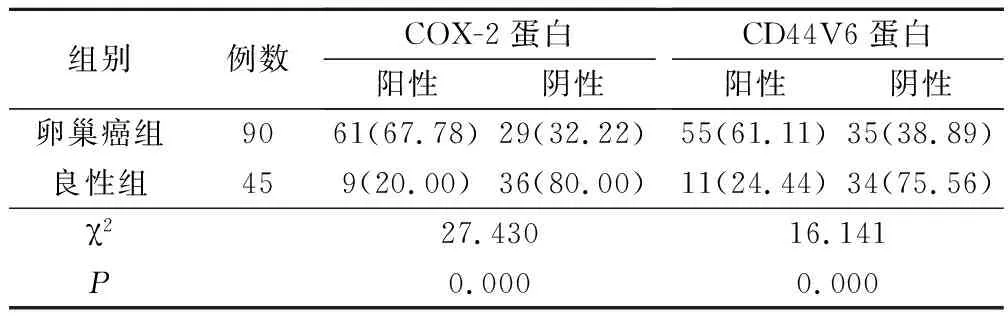
表1 2組COX-2蛋白、CD44V6蛋白表達水平比較(例,%)
2.2 卵巢癌組織、卵巢良性腫瘤中的COX-2蛋白、CD44V6蛋白表達與惡性指標(biāo)的關(guān)系
不同臨床分期、不同分化程度、是否發(fā)生淋巴結(jié)轉(zhuǎn)移的卵巢癌組織中的COX-2蛋白陽性表達率比較,差異均具有統(tǒng)計學(xué)意義(P<0.05);不同分化程度、是否發(fā)生淋巴結(jié)轉(zhuǎn)移的卵巢癌組織中的CD44V6蛋白陽性表達率比較,差異均有統(tǒng)計學(xué)意義(P<0.05),見表2。
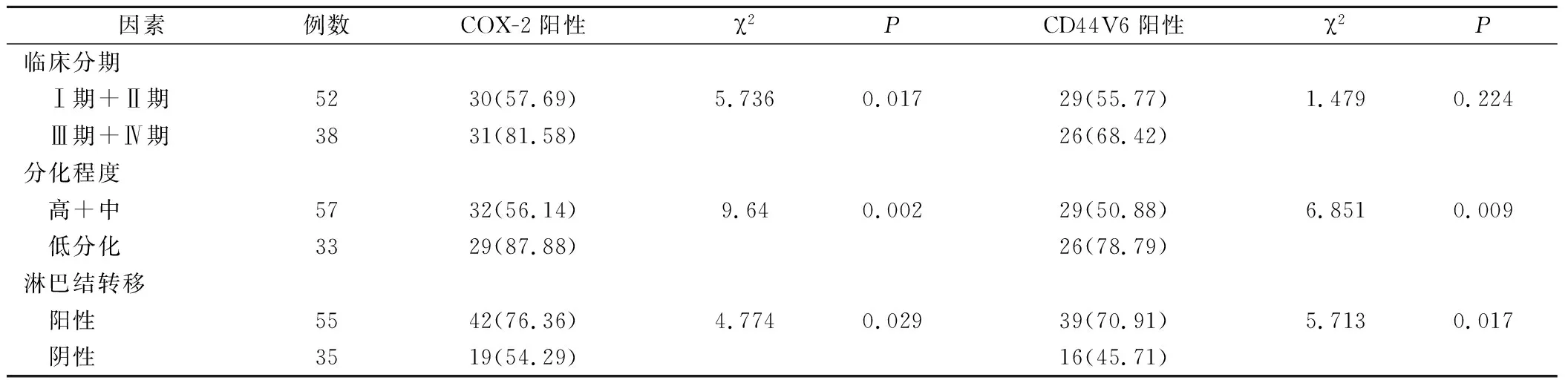
表2 卵巢癌COX-2、CD44V6蛋白表達與腫瘤惡性程度指標(biāo)的關(guān)系(例,%)
3 討論
不同病理性因素刺激下,卵巢生發(fā)上皮細胞或者卵泡細胞的異常病變,均能夠促進卵巢癌的發(fā)生,在合并有雌激素受體基因突變或者游離雌激素活性改變的群體中,卵巢癌的發(fā)病率可進一步的上升[7]。卵巢癌患者的3年及5年生存率不足35%[8],經(jīng)不同治療措施治療后,卵巢癌患者的病情進展風(fēng)險仍然較高。臨床上對于卵巢癌患者的血清學(xué)病情評估具有重要的作用,其能夠在協(xié)助臨床診療、預(yù)后判斷或者出院后隨訪方面發(fā)揮作用。血清糖鏈抗原125(CA125)雖然在卵巢癌的病情評估或者預(yù)后隨訪中發(fā)揮作用,但多中心的臨床分析研究發(fā)現(xiàn),單純依靠CA125評估卵巢癌病情或者預(yù)后的靈敏度不超過30%,其評估的一致性較低[9]。本次研究對于卵巢癌患者病灶組織中COX-2、CD44V6的表達分析研究,不僅能夠揭示卵巢癌的病情進展原因,同時能夠為臨床上提供新型的血清學(xué)參考指標(biāo)。
COX-2能夠通過誘導(dǎo)環(huán)氧化酶的代謝障礙,提高環(huán)氧化酶對于卵巢腫瘤微環(huán)境的改變,增加卵巢癌細胞的生物學(xué)惡化的風(fēng)險。COX-2蛋白結(jié)構(gòu)上包含的脯氨酸結(jié)構(gòu),能夠結(jié)合卵巢癌基因DNA上游轉(zhuǎn)錄配體,提高癌細胞核基因轉(zhuǎn)錄激活的程度。相關(guān)研究還認為,COX-2能夠促進腫瘤血管內(nèi)皮細胞的新生,促進新生血管的形成,進而提高腫瘤細胞的血流灌注水平[10];CD44V6是CD44蛋白的變異體,其能夠通過影響到卵巢癌細胞的上皮-間質(zhì)轉(zhuǎn)換過程,提高腫瘤細胞的浸潤深度,進而促進卵巢癌的病情發(fā)展[11-12]。
本次研究對于卵巢癌及卵巢良性腫瘤患者病灶組織中COX-2、CD44V6的分析可見,在卵巢癌患者中,COX-2、CD44V6的表達陽性率明顯的上升,高于良性腫瘤組,統(tǒng)計學(xué)差異較為顯著,提示了COX-2、CD44V6的高表達均能夠參與到卵巢癌的發(fā)生過程。相關(guān)細胞因子的表達對于卵巢癌的發(fā)生影響,主要通過下列途徑[13-14]:①COX-2的表達能夠提高腫瘤血管內(nèi)皮的遷移速度,促進腫瘤組織血管分子的形成,為腫瘤細胞的浸潤提供前提;②CD44V6能夠提高卵巢癌細胞的干細胞特性,提高癌細胞對于盆腔內(nèi)臟器組織的粘附和浸潤能力。研究者發(fā)現(xiàn)[15],在卵巢漿液腺癌患者中,CD44V6的表達陽性率或者表達濃度可顯著上升,同時在合并有明顯的腹水或者遠處臟器轉(zhuǎn)移的患者中,CD44V6的表達水平可翻倍上升。分析COX-2、CD44V6的表達與卵巢癌患者臨床病理特征相關(guān)性可以看出,在臨床分期較晚、發(fā)生了淋巴結(jié)組織轉(zhuǎn)移或者卵巢癌細胞低分化的患者中,COX-2蛋白的表達陽性率較高,提示了COX-2的表達與卵巢癌臨床病理特征的關(guān)系,這主要由于COX-2的表達上升,能夠加劇癌細胞生物學(xué)特征的惡化,從而引起腫瘤細胞浸潤深度的增加,提高了癌細胞對于盆腔內(nèi)淋巴結(jié)的粘附能力。在癌細胞分化程度較差或者發(fā)生淋巴結(jié)轉(zhuǎn)移的患者中,CD44V6的表達陽性率較高,提示CD44V6的表達與卵巢癌的臨床病理特征同樣密切相關(guān),這主要由于CD44V6的表達上升能夠促進卵巢癌分化成熟的調(diào)控障礙,誘導(dǎo)卵巢癌細胞的低分化,但并未發(fā)現(xiàn)臨床分期與CD44V6的關(guān)系,推測CD44V6的表達并不能影響到卵巢癌細胞的浸潤或者轉(zhuǎn)移過程。
綜上所述,在卵巢癌患者病灶組織中,COX-2、CD44V6的表達陽性率均明顯上升,同時COX-2、CD44V6的表達與卵巢癌患者的臨床分期、癌細胞分化及淋巴結(jié)轉(zhuǎn)移密切相關(guān)。但本次研究未能探討COX-2、CD44V6的表達與卵巢癌患者的預(yù)后關(guān)系。

