神經菌毛素-1靶向性自組裝多肽的構建及其在急性淋巴細胞性白血病中的應用
林 萍 莊嬌容 林茂增 許淑娟 盧蔚薇 滕 飛 蔡少華
急性淋巴細胞白血病(acute lymphocytic leukemia,ALL)是1種起源于淋巴細胞的B系或T系細胞的惡性腫瘤性疾病[1]。ALL是兒童常見的惡性腫瘤之一,發病率與病死率在兒童疾病中均排名首位,兒童期(0~9歲)為ALL的發病高峰,可占兒童白血病的70%以上[2-3]。目前,已有大量研究提示,Neuropilin-1(NRP-1)在多種癌癥包括急性淋巴細胞中表達,是ALL治療潛在的靶點[4-8]。
本研究的目的是通過構建具有NRP-1靶向性自組裝多肽(P16)作為遞送系統,與化療藥柔紅霉素(daunorubicin,DRN)自組裝成納米顆粒(P16/DRN復合物)。NRP-1靶向性自組裝多肽的結構及其與柔紅霉素的自組裝過程如圖1所示,N端帶負電荷的序列(EEDEEDEED),在生理pH=7.4條件下呈負電,可以與帶正電的柔紅霉素通過靜電力結合。C端(RPAKPAR)為Teesalu等[9]篩選出可與NRP-1特異性結合的NRP-1靶向肽。C段與NRP-1結合后,可通過NRP-1受體介導藥物進入腫瘤細胞。故利用該NRP-1靶向性自組裝多肽作為遞送系統,與柔紅霉素自組裝成納米粒后,可以增加柔紅霉素的水溶性和穩定性,C端序列使柔紅霉素具有白血病細胞的靶向性和提高柔紅霉素進入白血病細胞,從而增加化療效果。
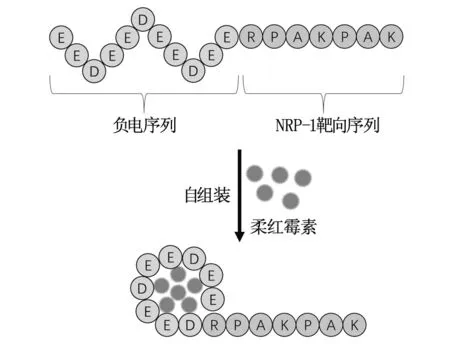
圖1 NRP-1靶向性自組裝多肽與柔紅霉素自主裝示意圖
1 材料與方法
1.1 細胞與細胞培養
人急性淋巴細胞性白血病CCRF-CEM細胞購買于上海研生實業有限公司,并由上海科維創生物科技有限公司使用慢病毒介導的shRNA基因沉默技術構建NRP-1敲低型CCRF-CEM細胞。上述細胞分別記為野生型CCRF-CEM(WT-CCRF-CEM)和NRP-1敲低型CCRF-CEM細胞(KD-CCRF-CEM)。細胞均使用CCRF-CEM細胞專用培養基(武漢普諾賽生命科技有限公司)在37 ℃、5%CO2培養箱中培養。
1.2 試劑
NRP-1靶向性自主裝多肽P16(EEDEEDEEDRPAKPAR)由上海強耀生物科技有限公司合成;柔紅霉素購買于上海阿拉丁生化科技股份有限公司;細胞周期熒光法檢測試劑盒與多肽含量定量檢測試劑盒購買于上海生物工程股份有限公司。
1.3 P16/DRN納米復合物的制備、純化與表征
將P16多肽凍干粉溶解于PBS緩沖液中,配制成0.2 mmol/ml的P16溶液。同時,取柔紅霉素粉末用PBS緩沖液配制成0.2 mmol/ml的DRN溶液。分別取1 ml的上述兩種溶液混合,避光攪拌10 min后,冰浴條件下超聲分散5 min。超聲后,12 000 g離心30 min,取上清液,經30 nm濾孔的超濾離心管純化后,送于上海鑫潼生物科技有限公司進行透射電鏡、粒徑表征。參考文獻報道的方法[10-12],高效液相色譜繪制DRN和P16蛋白質的標準曲線,并計算純化后的上清液DRN與P16多肽的濃度,計算載藥量和包封率。
1.4 P16/DRN納米復合物NRP-1靶向性檢測
取對數生長期的野生型CCRF-CEM(WT-CCRF-CEM)和NRP-1敲低型CCRF-CEM細胞(KD-CCRF-CEM)細胞,細胞全蛋白提取試劑盒提取總蛋白后,Western Blot檢測WT-CCRF-CEM和KD-CCRF-CEM細胞的NRP-1蛋白表達含量。另外取對數生長期WT-CCRF-CEM和KD-CCRF-CEM細胞按1×105/孔接種于6孔板中,培養6 h后,加入P16/DRN納米復合物(100 μl/孔)繼續培養6 h。收集細胞,PBS輕輕洗滌3次以除去非特異性結合的納米復合物。滴片固定后,Hoechst核染后共聚焦顯微鏡檢測兩種細胞的DRN自帶熒光強度。
1.5 P16/DRN納米復合物對CCRF-CEM細胞增殖的影響
分別取對數生長期的野生型CCRF-CEM 按1×105/孔的濃度接種于24孔板中。培養6 h后,分別按下列分組并做相應處理:①PBS組:每孔加入100 μl PBS;②DRN組:每孔加入DRN溶液100 μl;③P16/DRN納米復合物組:每孔加入P16/DRN納米復合物溶液100 μl。其中,根據測得的P16/DRN納米復合物中的濃度,調節DRN溶液的濃度,使兩者DRN濃度相同。每組設置4個時間點,每個時間點設置6個復孔。分別在6 h,12 h,24 h和48 h使用全自動細胞計數儀計算處理組細胞數,根據公式細胞增殖率=各時間點細胞數/處理前(0 h)細胞數,比較不同分組間的細胞增殖率。
1.6 P16/DRN納米復合物對CCRF-CEM細胞凋亡的影響
分別取對數生長期的野生型CCRF-CEM按1.5中的分組方法并做相應處理,分別在24 h和48 h收集細胞并用 500 μl Binding buffer重懸細胞,加入 5 μl Annexin V-FITC 和 5 μl PI 染色液,混勻后室溫孵育15 min。孵育完畢收集細胞用預冷 500 μl PBS 重懸后流式細胞儀檢測,以PBS處理組為陰性對照,計算各時間點與不同處理組間細胞凋亡率。
1.7 統計學方法
本研究統計均應用SPSS 22.0統計學軟件處理,定量資料以均數±標準差表示,兩組間均數比較采用t檢驗,檢驗水準為P<0.05。
2 結果
2.1 P16/DRN納米復合物的表征
將P16多肽溶液與柔紅霉素溶液按1∶1比例混合后,經攪拌、超聲分散、離心后,上清液為P16/DRN納米復合物。透射電鏡下(圖2A),可見該納米復合物粒徑約為100 nm的球形顆粒,粒徑分布均勻。該結果與馬爾文粒徑分析儀檢測結果相符,馬爾文粒徑分析儀提示,形成的納米復合物平均粒徑呈現正態分布,平均粒徑為(114.92±17.33)nm(圖2B)。
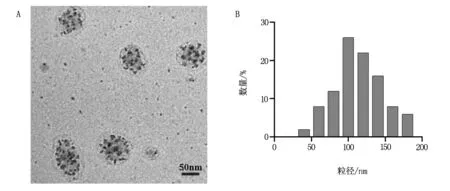
圖2 P16/DRN納米復合物的表征結果
通過梯度濃度柔紅霉素溶液繪制標準曲線,高效液相色譜儀測得P16/DRN納米復合物溶液中,DRN濃度為0.83 mmol/ml,P16濃度為1.0 mmol/ml。可知在上述反應體系中,DRN為過量的反應底物。每1 mmol的P16多肽可與0.83 mmol/ml的柔紅霉素結合,形成穩定的納米復合物,即DRN的載藥量和包封率分別為0.83 mmol/ml和83%。
2.2 P16/DRN納米復合物NRP-1靶向性檢測
Western Blot檢測WT-CCRF-CEM和KD-CCRF-CEM細胞的NRP-1蛋白表達含量,結果如圖3A所示,NRP-1蛋白在野生型CCRF-CEM(WT-CCRF-CEM)細胞呈高表達,而NRP-1敲低型CCRF-CEM(KD-CCRF-CEM)表達量明顯較WT-CCRF-CEM低。三次獨立Western Blot結果如圖3B所示,KD-CCRF-CEM細胞組的NRP-1蛋白表達量明顯較WT-CCRF-CEM細胞組低,差異有統計學意義。

圖3 P16/DRN納米復合物NRP-1靶向性檢測
P16/DRN納米與WT-CCRF-CEM和KD-CCRF-CEM細胞共孵育6h后,可在WT-CCRF-CEM細胞組檢測到明顯的紅色熒光,為柔紅霉素的自帶熒光。而KD-CCRF-CEM組的細胞紅色熒光量明顯較WT-CCRF-CEM組低。結果提示,由于野生型細胞高表達NRP-1,可在P16的作用下,促進P16/DRN納米復合物與細胞結合并誘導復合物進入細胞。即P16/DRN納米復合物仍保留NRP-1的靶向性和介導入胞的能力。
2.3 P16/DRN納米復合物對CCRF-CEM細胞增殖的影響
根據上述結果,可知所制備的P16/DRN納米復合物溶液中,DRN濃度為0.83 mmol/ml。故DRN組使用的DRN溶液也調節濃度為0.83 mmol/ml。各分組在四個時間點的細胞增殖率如圖4所示。在24 h和48 h時間點,DRN組與P16/DRN組細胞增殖率較PBS組低,P<0.05,結果提示,單純的DRN和P16/DRN納米復合物均能明顯抑制CCRF-CEM細胞的增殖。此外,在24 h和48 h兩個時間點,P16/DRN組的細胞增殖率也較DRN組低,P<0.05,結果提示,DRN與P16形成P16/DRN納米復合物后,具有更高的細胞增殖抑制率。
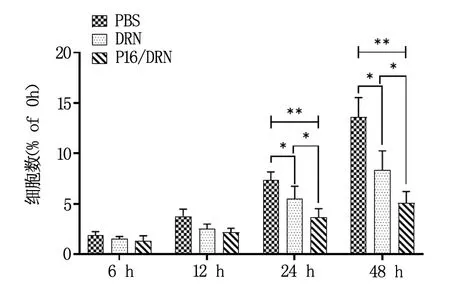
圖4 DRN與P16/DRN納米復合物對CCRF-CEM細胞增殖的影響
2.4 P16/DRN納米復合物對CCRF-CEM細胞凋亡的影響
分別取對數生長期的野生型CCRF-CEM按1.5中的分組方法并做相應處理,分別在24 h和48 h后,以PBS組為陰性對照,流式細胞儀檢測各組的細胞凋亡率。三次獨立實驗的流式細胞術結果如圖5所示,在24 h,DRN處理組細胞凋亡率為(31.11±6.51)%,而P16/DRN納米復合物處理組的細胞凋亡率為(46.64±7.88),P<0.05;在48 h,DRN處理組和P16/DRN納米復合物處理組的細胞凋亡率分別為(44.72±9.13)%,( 64.72±12.76)%,P<0.05。上述結果提示,P16/DRN納米復合物較同濃度的單獨DRN處理組具有更高的細胞凋亡率,即P16/DRN納米復合物具有更高的細胞毒性。
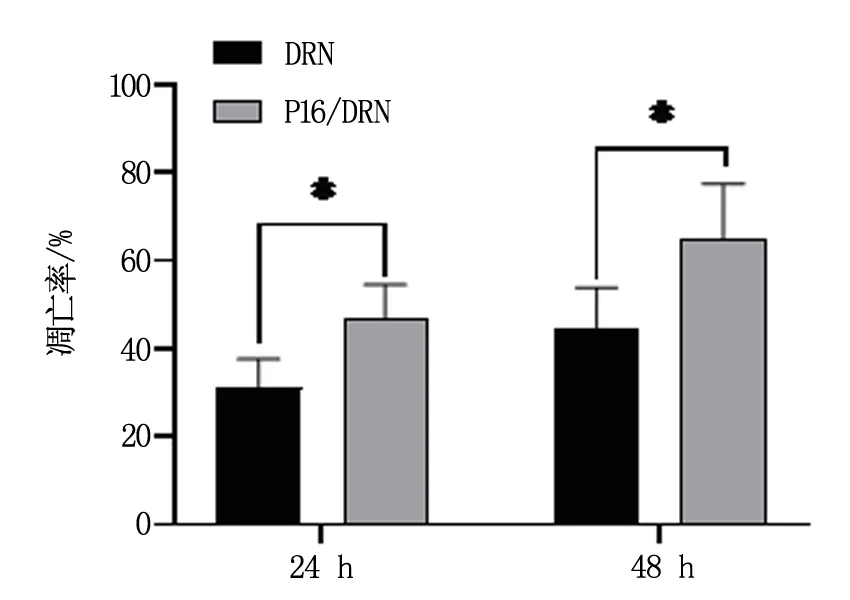
圖5 DRN與P16/DRN納米復合物對CCRF-CEM細胞凋亡的影響
3 討論
目前,急性淋巴性白血病的治療主要依靠化療,如何提高化療效果是治愈該病的關鍵。NRP-1是1995年Satoda等[13]在歐洲爪蟾神經纖維軸突上發現并報道的一種相對分子量為130kD的Ⅰ型跨膜糖蛋白。目前針對NRP-1的研究已經從最早的神經軸突導向逐漸擴展至血管生成、腫瘤增殖與轉移、腫瘤免疫等多個方面[14-17]。然而,NRP-1在白血病方面的研究仍不多。劉宇宏等[5]發現,NRP-1在人急性淋巴性白血病CCRF-CEM細胞中高表達。且使用NRP-1單克隆抗體與CCRF-CEM細胞表面的NRP-1結合后,可明顯抑制細胞的增殖和遷移,促進腫瘤細胞的凋亡和提高腫瘤細胞的化療敏感性。結果提示,NRP-1是急性淋巴性白血病治療的潛在靶點。故本研究也選取NRP-1作為靶點,合成具有NRP-1靶向性自組裝多肽,與柔紅霉素自組裝成穩定的納米復合物。柔紅霉素是急性淋巴細胞常用的化療。柔紅霉素易溶于水,其水溶液相當穩定,在0 ℃或37 ℃能保存3周活力不變。通過與P16結合形成P16/DRN納米復合物后,可實現柔紅霉素的腫瘤細胞靶向投遞,并且在P16的介導下,促進納米復合物入胞,從而增強化療效果。
掃描電鏡結果顯示,本研究所制備的P16/DRN納米復合物為粒徑約100 nm的球形結構。共聚焦顯微鏡觀察所制備的P16/DRN納米復合物,仍保留C端靶向肽的NRP-1靶向能力,可與CCRF-CEM細胞結合并介導P16/DRN入胞。高效液相色譜儀測得P16/DRN納米復合物溶液中,DRN濃度為0.83 mmol/ml,P16濃度為1.0 mmol/ml。細胞計數儀結果提示,與同濃度的單純DRN對比,DRN與P16形成P16/DRN納米復合物后,具有更高的細胞增殖抑制率。同樣地,流式細胞術結果也顯示,P16/DRN納米復合物較同濃度的單獨DRN處理組具有更高的細胞凋亡率,即P16/DRN納米復合物具有更高的細胞毒性。
綜上所述,本研究制備的P16多肽,可在柔紅霉素的促發下,形成粒徑約100 nm的P16/DRN納米復合物。P16/DRN納米復合物較單純同濃度的DRN溶液具有更好的化療效果。后期可進一步研究DRN與P16形成納米復合物的機制及藥物釋放機制,為P16多肽的進一步應用提供理論基礎。

