奶牛乳腺內微生物區系與乳房健康的關系研究進展
童津津 張 華 熊本海 蔣林樹*
(1.北京農學院動物科學技術學院,奶牛營養學北京市重點實驗室,北京 102206;2.中國農業科學院北京畜牧獸醫研究所,北京 100193)
動物機體各個部位存在各種共生細菌,條件致病菌、致病微生物與宿主之間形成相互依存,相互作用,維持穩定且營養豐富的生態系統動態平衡。有些微生物共生體(微生物組)的共有基因組為宿主動物提供了多種優勢,例如不同結構的碳水化合物的消化吸收與代謝、維生素的生物合成以及對先天性和適應性免疫系統的調節作用等。
奶牛乳腺內環境中,以傳統宿主-病原體相互作用的角度看待乳腺與微生物之間的關系,即當病原微生物的感染或環境性病原菌侵入時,導致乳腺防御能力下降,引起乳腺組織炎性反應及乳成分的改變,造成嚴重危害。據報道,引起奶牛乳房炎的病原菌有150多種,主要包含細菌、病毒、真菌和支原體等。其中細菌為主要的致病菌,例如金黃色葡萄球菌、鏈球菌、大腸桿菌占所有病原菌的83.74%[1-2]。然而,近年來隨著宏基因組學的快速發展與廣泛應用,越來越多的研究表明,臨床上健康的乳腺分泌物也可以包含各種細菌群基因組的標記物,且其中絕大多數與乳腺炎無關[3]。因此,“乳腺共生微生物”的概念運用而生,其生態特性對于更好地了解乳腺炎的發病機理可能具有重要意義,為治療和預防乳腺炎提供了新的視角與機遇。
目前研究結果表明,最佳的乳腺菌群多樣性與免疫穩態有關,而乳腺炎或患有乳腺炎病史的微生物菌群多樣性顯著減少[4-6]。那么,乳房微生物群多樣性的破壞(生物代謝)是否具有決定乳腺炎易感性的作用尚不清楚。而且,關于各種生物和非生物因子對乳房內微生物菌落多樣性形成的作用研究較少。因此,本文旨在綜述目前關于乳房各個生態部位中微生物菌群的研究進展,并強調了微生物群落代謝網絡特點及高度動態的微生物生態系統研究方向,并對乳腺抗菌方面的應用潛力及開發進行了展望。
1 乳頭部菌群
奶牛乳頭和乳池在泌乳活動中發揮了重要作用,具有排出和儲存乳汁的作用。乳頭管作為預防病原菌侵襲的第1道防線,內襯有角質蛋白,不但封閉管道,還可有效抑制細菌和病原菌的生長;此外,乳頭管底部,靠近乳頭乳池處,含有特殊的生理結構——弗斯登堡靜脈環(圖1),可有效抵御外來病原菌的侵襲以及防止乳汁的溢出[7]。其次,乳頭作為病原菌入侵的重要窗口,其生理結構是防止乳房炎的有效結構。研究發現,基于傳統培養方法和DNA提取等方法,奶牛乳頭細菌群落具有較高的微生物多樣性[8],作為共生菌群,主要包括病原體及與皮膚相關的條件致病菌;在門水平上的細菌主要包括放線菌門(Actinobacteria)、擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)和變形桿菌門(Proteobacteria),可以留在奶牛乳頭的皮膚上;在屬水平上的細菌主要包括不動桿菌屬(Acinetobacter)、氣球菌屬(Aerococcus)、棒狀桿菌屬(Corynebacterium)、腸桿菌屬(Enterobacter)、法克菌屬(Facklamia)、乳桿菌屬(Lactobacillus)、乳球菌屬(Lactococcus)、微球菌屬(Micrococcus)、丙酸桿菌屬(Propionibacterium)、葡萄球菌屬(Staphylococcus)和鏈球菌屬(Streptococcus)等。曾學琴[9]等通過對乳房炎奶牛乳頭和乳汁中微生物群落多樣性分析,結果表明,在門水平上乳頭豐度最高的是細菌厚壁菌門,而乳汁中豐度最高的細菌是變形菌門;且患有乳房炎奶牛的乳頭樣品均含有擬桿菌門細菌,而乳汁中幾乎沒有,但梭桿菌門細菌僅存在于乳頭中。因此,奶牛乳頭的菌落結構與乳房炎的發生發展密切相關。
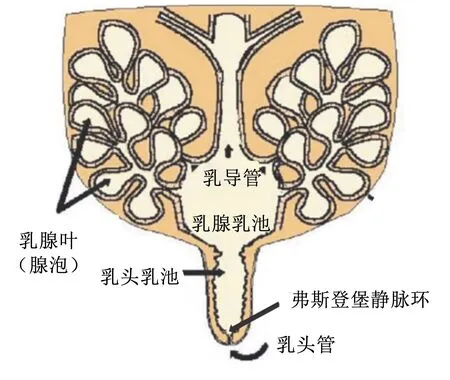
圖1 奶牛乳腺乳區解剖示意圖
長期以來,乳頭端過度角化病一直被認為是發展臨床型乳房炎的潛在危險因素之一[11]。過度角化是指乳頭末端的角質層(即角蛋白襯里)的厚度增加,通常是由于長期刺激(例如,由于擠奶習慣造成的創傷)而引起的。多項研究表明,乳頭過度角化病與較高的微生物負荷和隱性乳房炎的發生呈正相關[12-13]。Derakhshani等[14]評估奶牛的生理狀態和乳頭過度角化對乳頭管和乳汁中微生物群特征的影響,結果表明,乳頭過度角化病與乳房任一部位的微生物群總體多樣性之間沒有很強的相關性,然而鞘氨醇桿菌屬(Sphingobacterium)除外,乳頭過度角化病與Sphingobacterium豐度呈顯著正相關關系,而Sphingobacterium是進一步與臨床型乳房炎的潛在發病率相關的細菌屬。因此,乳頭的過度角化嚴重危害了乳頭管的完整性,并通過機會型或者致病型細菌群抑制乳腺內細菌的定植能力。
此外,環境性病原菌也是影響乳腺健康的主要外源性致病菌,經乳頭感染而引起奶牛的乳房炎。研究發現,大腸桿菌、變形桿菌、肺炎克雷伯菌、產氣腸桿菌等為主要的環境性病原體[15]。據報道,不動桿菌、氣球菌和棒狀桿菌是奶牛乳頭頂端皮膚上最常見的菌屬[16],而環境中的不動桿菌和氣球菌是人類皮膚的正常定居者[17],但是它們是否與奶牛乳房健康和隱性乳房炎相關尚未見報道。
2 乳頭管部菌群結構
奶牛的乳頭管長0.65~1.30 cm,一端與乳頭乳池相連,另一端開口于乳頭頂端的乳頭孔;乳頭管的大小和括約肌的緊縮度與奶牛泌乳速度密切相關[18]。乳頭管由于其復雜的生化和結構特性,可以有效阻止環境微生物進入乳腺。但是,如果乳頭管的角蛋白塞部分丟失或擠奶后乳頭管的括約肌擴張,則會損害乳房的第1道防御屏障,并通過多種來自乳房外部環境中的微生物,增加奶牛對乳腺炎的易感性[19]。致病菌破壞了乳頭管并進入乳房的乳頭池,大多數乳腺炎病原體能夠以相對較快的速度在乳房內生態系統中生存和增殖,并引發不同程度的炎癥反應[20]。
目前,由于在牛場擠奶廳條件下,對乳頭管進行無菌采樣比較困難,只有少數研究報道了該部位的微生物群落多樣性[21]。研究發現,葡萄球菌屬是乳頭管菌群中最常見的定居者,即使在擠奶前后對乳頭消毒后也是如此[22]。此外,一些與腸道相關的細菌,如梭菌科(Clostridiaceae)和鞭毛藻科(Lachnospiraceae),也被認為是乳頭管中微生物群的主要成員。Falentin等[21]研究發現,健康母牛的乳頭管和乳池中的Corynebacterium、瘤胃球菌屬(Ruminococcus)、Aerococcus、雙歧桿菌屬(Bifidobacterium)和Facklamia是常見的微生物群。有研究報道,將患有臨床型乳腺炎病史的奶牛乳頭管的菌群結構與健康奶牛相比,臨床型乳腺炎病史的奶牛乳頭管含有更高比例的細菌[14]。梭狀芽胞桿菌屬(Clostridia)和Bifidobacterium在健康乳區的比例較高,因此,桿菌與梭狀芽胞桿菌的比例在判定乳房健康中起重要作用。據報道,從牛奶或乳頭管中分離出的乳酸菌可以黏附并內化奶牛乳腺上皮細胞,并調節細胞促炎性細胞因子的產生[23],有助于充分認識乳腺免疫防御機制,對預防與治療奶牛乳腺炎具有重要的意義。
因此,乳頭和乳頭管等部位定居的微生物群落組成和功能直接影響著乳房內微生物的結構組成,與乳房的健康密不可分。大量研究結果表明,某些金黃色葡萄球菌物種在乳頭管的微生物定植可為研發治療乳房炎的藥物提供重要的依據[24-26]。此外,通過對乳汁、乳頭皮膚、糞便和床墊材料中的微生物群落比較分析結果證實,乳頭皮膚是牛奶微生物群中最重要的來源[27];而畜群糞便和床墊鋪料的微生物群是乳內微生物群第二大流行來源[28]。這些發現強調了乳房的各個部位,特別是乳頭皮膚和乳頭管的微生物群,以及各種環境源(如墊料和擠奶設備等)在塑造乳腺內微生物群中的重要作用。
3 乳腺內微生物的潛在起源與環境因素
乳腺對微生物定植的防御機制受到多種因素的調節(圖2),包括:奶牛的基因型(特別是編碼先天性和適應性免疫系統各個組成部分的基因)、母牛生理狀況的變化、不同泌乳周期的代謝狀況和飼養管理[29],例如干奶期抗微生物的治療、擠奶后乳頭消毒和擠奶衛生等[27]。上述各個因素在調節乳房的免疫穩態和抵抗乳腺感染的過程中都起著重要的作用。因此,這些因素在對乳腺內微生物群落的組成及功能等方面也具有直接或間接影響。

圖2 奶牛乳腺健康影響因素概圖
目前,鑒定乳腺炎易感性遺傳標志物的主要方法是候選基因內的遺傳變異,最重要的是對乳腺炎病原體所發生的全身和局部免疫反應[30],即與抗原識別后,白細胞募集和病原體消除是最重要的評判標準。例如,由于編碼主要組織相容性復合物(major histocompatibility complex,MHC)分子的基因[也稱為牛白細胞抗原(BoLA)]在調節先天性和獲得性免疫應答中的關鍵作用而受到越來越多的關注[31-32]。特別是MHC基因和共生菌群之間的潛在聯系,也得到廣泛研究。研究表明,MHC基因型的多態性可以影響胃腸道上共生菌群的組成,例如某些Ⅱ類MHC基因型可以增加小鼠對沙門氏菌誘導的腸道感染的抵抗力[33],但在奶牛乳腺炎中關于MHC基因與共生菌群之間的聯系研究較少。此外,在最近的一項研究中,BoLA DRB3.2的多態性與分娩后立即收集的初乳樣品中獨特的微生物群譜密切相關[34],在這項研究中,每種已鑒定的BoLA-DRB 3.2單倍型(n=3)與初乳菌群內特定操作分類單元的富集相關,如S.chromogenes、S.sciuri和S.succinus物質。因此,與乳腺炎易感性密切相關的候選基因可能通過調節乳內微生物群落,參與調節乳房穩態以及保護乳房免受主要乳腺炎病原體的侵襲而發揮作用。
奶牛的營養管理對乳房穩態及乳腺健康具有重要的意義。例如在圍產期,奶牛的營養供應和干物質采食量(DMI)落后于機體所需的能量,負能量平衡(NEB)的這種不可避免的狀態會導致各種新陳代謝疾病的發展,從而導致免疫系統受損[35]。機體內非酯化脂肪酸(NEFA)和酮體濃度升高與關鍵免疫功能受損密切相關,這些免疫功能包括吞噬活動、巨噬細胞和中性粒細胞的活性氧(ROS)產生、中性粒細胞的募集及其易位內皮、炎性細胞因子的分泌、肝細胞產生補體因子和急性期蛋白、激活免疫系統以及分泌免疫球蛋白等。但是,目前關于圍產期代謝紊亂對乳房微生物群組成的潛在影響知之甚少。
此外,亞急性瘤胃酸中毒(SARA)是一種因高精料飼喂而引起的瘤胃和后腸微生物群失調所發生的代謝紊亂疾病[36]。研究發現,在發生SARA的初產奶牛泌乳初期的乳汁微生物群與病原菌和條件性致病菌[包括嗜麥芽單胞菌屬(Stenotrophomonas)、Streptococcus、假單胞菌屬(Pseudomonas)和產堿桿菌屬(Alcaligenes)]的富集顯著相關[37],證實全身和局部炎癥反應的誘導是SARA調節乳房免疫穩態的潛在機制。還有研究報道,在SARA期間,反芻動物胃腸道中游離脂多糖(LPS,革蘭氏陰性細菌外細胞膜的免疫原性成分)的脫落和積累會觸發系統性炎癥反應[38]。那么,SARA對胃腸道上皮屏障的破壞可使得游離的LPS從腸腔轉移到血液循環和淋巴系統,與特定的急性期蛋白結合稱為LPS結合蛋白[39-40];所得的LPS結合蛋白是一種免疫調節復合物,能夠從血液循環/淋巴系統轉移到包括乳房在內的各種身體部位,并通過激活核因子-κB(NF-κB)促炎途徑來調節局部免疫力。但是,與SARA相關的乳房微生物群組成的變化是炎癥性免疫反應激活的結果,還是由于細菌從胃腸道轉移到乳房引起的,仍未得到答案,需要進一步研究。
奶牛的居住條件在塑造乳房微生物群的組成中起著核心作用,而乳頭和乳頭管內微生物群落的組成與牛場環境密切相關[28]。據報道,雖然擠奶前乳頭消毒不影響室內奶牛乳汁的微生物群,但在室外放牧季節,經過擠奶前乳頭消毒的奶牛乳汁微生物群比未處理組更為多樣化[41]。在擠奶廳收集的乳汁樣本中,牛奶菌群中與腸道相關的菌屬如Ruminococcus、Aerococcus和普雷沃菌屬(Prevotella)的比例較高;而在牧場收集的乳汁樣本中,革蘭氏陰性菌[如假單胞菌(Pseudomonas)]和Acinetobacter的比例較高。這些發現為更好地了解環境因素(尤其是牛場管理和擠奶衛生)在塑造整體乳房微生物群中的作用提供了寶貴的見解。床墊管理是乳腺炎控制程序的另一個重要方面,它可能會影響奶牛環境的微生物狀況,進而影響乳房的微生物定植;據報道,在使用稻草墊料的農場中,冬季采集的牛奶和乳頭采集的棉簽樣本均比夏季采集的樣本富含物種更豐富的微生物群[42]。這項發現強調了季節性因素(如環境溫度和濕度)對奶牛周圍環境微生物群組成以及乳房微生物群的潛在貢獻。
4 微生物菌群失調與乳房健康的潛在影響
越來越多的證據表明,臨床型乳房炎的發生與乳腺內微生物多樣性的減少和菌群組成的改變密切相關。研究發現,與健康奶牛相比,梭桿菌門僅在乳房炎奶牛乳頭中檢測到,而在健康奶牛乳頭中未檢測到;乳房炎奶牛乳頭Staphylococcus豐度高于正常奶牛,腸球菌屬(Enterococcus)僅在乳房炎奶牛牛奶中檢測到,正常奶牛牛奶中未檢測到[9]。而且,乳腺炎病原體通常有多種毒力因子,使它們能夠抵抗機體介導的免疫反應而在乳房內定植[43]。在最初的定植之后,病原體可以迅速地在乳房的生態系統中生長并消除其常駐共生菌群。然而,在乳房生態系統中,致病菌的優勢通常不會持續存在,而且由于免疫細胞的活動和通過定期擠奶進行的清除,或者在治療干預的幫助下(如乳腺內注射抗菌劑),這種優勢通常會自行消除。因此,共生細菌的恢復程度一方面取決于用于治療乳腺炎的抗菌劑的活性,另一方面也取決于侵入性病原體的毒力因子,如生物膜的形成和內化乳腺上皮細胞的能力等[44]。因此,充分了解乳腺微生物群落不僅能加深我們對乳房各個部位之間的生態關系的理解,而且能使我們更全面、更準確地評估各種乳腺炎治療的有效性。
5 小 結
綜上所述,乳腺內的共生菌群棲息于乳房的不同部位,包括乳頭頂端、乳導管和乳房內的生態系統,可以通過直接的微生物-微生物交互作用、間接的免疫刺激或兩者兼用來調節奶牛對乳腺炎病原體的易感性。因此,更好地了解能夠影響乳房內環境穩定的各種因素,為開發治療奶牛乳房炎的新思路及新方法奠定基礎。
雖然目前對乳房的微生物生態系統的了解尚處于嬰兒期,但是乳房內微生物群的最佳多樣性及由1個健康的乳房組成共生菌群和機會菌群之間的平衡,對于維持促炎反應和抗炎反應之間的平衡從而維持乳房內環境穩定是至關重要的。研究奶牛的生理狀態、乳房的解剖特征、與免疫應答相關的遺傳特性以及環境因素會改變乳房微生物群的組成等,可以更好地了解乳房不同部位的共生菌群相互作用及與乳腺炎病原體和免疫系統相互作用,為更好地治療奶牛乳腺炎及相關藥物的研發提供有利保障。

