STEMI介入術中冠脈內不同部位應用重組人尿激酶原的療效觀察
王德良 王新華 裴建行 賈涵鑠 董京京 張苗苗 馬光
近年來,我國急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)的發生率和病死率持續增加[1]。再灌注治療是STEMI主要治療方法,通過再通閉塞的冠狀動脈,使缺血心肌得以恢復灌注,改善血流動力學,恢復心臟血液供應,從而減少死亡的發生。經皮冠脈介入治療(percutaneous coronary intervention,PCI)是臨床上最為常見的再灌注治療措施[2,3]。然而,由于植入支架造成對血管內壁的損傷,導致斑塊進一步破裂、脫落,且支架植入激活了凝血系統。因此,PCI術中可能出現冠脈微血栓、微循環功能障礙等一系列不可避免的并發癥,引起冠脈“無復流”、“慢血流”現象的發生,對患者手術效果及術后造成嚴重的影響[4,5]。通過應用重組人尿激酶原(recombinant human prourokinase for injection,rh-proUK)能有效預防STEMI患者PCI術中及術后發生“無復流”、“慢血流”,在臨床應用上具有較好的療效[6]。rh-proUK主要的作用部位為血栓的纖維蛋白,使纖維蛋白溶解,其部分溶解物質可導致rh-proUK發生級聯放大反應,使之具有更強的活性及溶栓作用[7]。本研究從以下方面觀察rh-proUK對改善STEMI患者PCI術的應用療效。通過靶向灌注導管冠脈內應用rh-proUK與指引導管前向應用rh-proUK相對比,報道如下。
1 資料與方法
1.1 一般資料 選取保定市第二中心醫院在2018年3月至2019年3月診斷為STEMI并擬行PCI術的患者82例,其中男43例,女39例;年齡36~75歲,平均年齡(62.75±9.12)歲。隨機分為A組和B組,A組為在梗死相關動脈(infarct related artery,IRA)靶病變近端給予20 mg rh-proUK的指引導管給藥組(n=40),B組為在IRA遠端給予20 mg rh-proUK的靶向導管給藥組(n=42)。2組患者年齡、性別比、吸煙史及冠心病主要危險因素(高血壓、糖尿病、高脂血癥、家族史)比較,差異均無統計學意義(P>0.05),具有可比性。見表1。

表1 2組一般資料比較
1.2 納入與排除標準
1.2.1 納入標準:符合中華醫學會心血管病學分會制定的相關診斷標準[8];癥狀出現時間<12 h。
1.2.2 排除標準:主動脈夾層、嚴重肝腎功能不全、近期有活動性內出血、藥物過敏或有禁忌者等。
1.3 研究方法
1.3.1 PCI治療方法:對所有患者均進行吸氧、心電監護,并予以急性心肌梗死等常規治療。隨即行PCI術,常規經皮穿刺橈動脈、肱動脈或股動脈,行冠脈造影,確定IRA病變部位。將引導導絲穿過IRA到達靶病變遠端,并且將靶向灌注導管沿著導絲送至距靶病變閉塞處約2 cm處。將稀釋至10 ml的rh-proUK 20 mg 分別通過指引導管和靶向灌注導管在3 min內注入A、B組患者中,2組患者均選擇直接支架植入或球囊擴張后支架植入,隨即完成PCI治療。其中A組采用6F指引導管;B組采用的靶向灌注導管為刺破球囊[Boston Scientific,型號Maverick,規格:2.0 mm×15 mm]。
1.3.2 觀察指標:記錄患者一般臨床資料。PCI術后冠脈造影,采用心肌梗死溶栓治療(thrombolysis myocardial infarction,TIMI)分級和心肌灌注(TIMI myocardial perfusion grading,TMPG)分級為評價指標[9,10]。通過心電圖檢查計算ST段回落指數(ST-segment elevation resolution,STR)>50%比例。觀察磷酸肌酸激酶同工酶(CK-MB)、肌鈣蛋白I(cTnI)的峰值時間。術前及術后7 d,通過超聲心動圖檢查左心室射血分數(LVEF)、左心室舒張末期內徑(LVEDD):左心室收縮末期內徑(LVDs)。記錄術后1個月內復發心絞痛、心肌梗死、惡性心律失常、心力衰竭、死亡等主要心血管不良事件(MACE)發生率和出血情況。
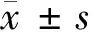
2 結果
2.1 PCI術后血流恢復情況比較 PCI術后,B組的TIMI分級、TMBG分級均優于A組,差異均有統計學意義(P<0.05)。見表2。

表2 不同部位組患者血流恢復情況比較 例(%)
2.2 心電圖及心肌壞死標志物比較 PCI術后,不同部位組中,B組的STR>50%比例高于A組,CK-MB、cTnI的峰值時間均較A組提前,差異均有統計學意義(P<0.05)。見表3。
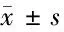
表3 不同部位組患者心電圖及心肌壞死標志物比較
2.3 心功能改善情況比較 不同部位組中,2組LVEF均高于術前,差異均有統計學意義(P<0.05);術后7 d,B組LVEF高于A組,LVEDD、LVDs均低于A組,差異均有統計學意義(P<0.05)。見表4。
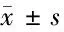
表4 不同部位組患者心功能改善情況比較
2.4 MACE發生率及出血事件比較PCI術后1個月內,不同部位組中,A組出現復發心絞痛2例,惡性心律失常1例,心力衰竭1例,總發生率為10%;B組出現復發心絞痛1例,惡性心律失常1例,心力衰竭1例,總發生率為7.14%;2組MACE發生率比較,差異無統計學意義(P>0.05)。不同部位分組中,僅有少部分患者出現穿刺部位出血、皮膚瘀斑等,均無內出血和腦出血等嚴重出血事件。
3 討論
新版定義的心肌梗死標準為:血清心肌標志物(主要是肌鈣蛋白)升高(至少>99%參考值上限),并至少伴有以下一項臨床指標:(1)缺血癥狀;(2)新發生的缺血性ECG改變[新的ST-T改變或左束支傳導阻滯(LBBB)];(3)ECG病理性Q波形成;(4)影像學證據顯示有新的心肌活性喪失或新發的局部室壁運動異常;(5)冠脈造影或尸檢證實冠狀動脈內有血栓。
目前,全球心肌梗死統一定義,心肌梗死分為5型6類。患者可能同時或先后出現1種以上類型的心肌梗死。1型:與缺血有關的自發性心肌梗死,由原發冠狀動脈事件如斑塊侵襲和(或)破裂、裂隙或夾層引起的冠狀動脈內血栓形成,從而心肌灌注明顯下降或遠端血管血小板血栓形成,導致心肌梗死。2型:繼發于缺血的心肌梗死,心肌供氧減少或需氧增加所致,如冠狀動脈痙攣、冠狀動脈栓塞、貧血、心律失常、高血壓或低血壓。3型:突發、未預料到的心臟性死亡,包括心臟停搏,通常有心肌缺血的癥狀,伴隨新的ST段抬高或新的左束支阻滯(LBBB)或冠狀動脈造影和(或)尸檢發現冠狀動脈有新鮮血栓的證據,但死亡發生于可取得血樣之前或血中生物標志物增多之前。4型:危害最大,病死率高,需要加強教育,對高危患者加強預防。4a型:伴發于經皮冠狀動脈介入治療(PCI)的心肌梗死。4b型:冠狀動脈造影或尸檢證實的伴發于支架血栓形成的心肌梗死。5型:伴發于冠狀動脈旁路移植術(CABG)的心肌梗死。
1型心肌梗死主要是由于冠脈內不穩定的斑塊破裂、冠狀動脈阻塞導致的心肌缺血、壞死引起的。STEMI患者的典型癥狀為壓榨性胸痛,伴出汗、恐懼或瀕死感等。約半數以上的急性心肌梗死患者,在起病前1~2 d或1~2周有前驅癥狀,最常見的是原有的心絞痛加重,發作時間延長,或對硝酸甘油效果變差;或繼往無心絞痛者,突然出現長時間心絞痛。常見的心肌梗死癥狀為突然發作劇烈而持久的胸骨后或心前區壓榨性疼痛,休息和含服硝酸甘油不能緩解,常伴有煩躁不安、出汗、恐懼或瀕死感。心律失常見于75%~95%患者,發生在起病的1~2周內,以24 h內多見,前壁心肌梗死易發生室性心律失常,下壁心肌梗死易發生心率減慢、房室傳導阻滯。輔助檢查包括血清心肌壞死標志物水平上升及心電圖中ST段的抬高等,該病發病迅速,患者在短時間內出現心肌損傷甚至死亡等情況,造成嚴重的影響[11,12]。為了改善患者的心功能及生命安全,需盡快進行再灌注治療,疏通閉塞血管,恢復心肌再灌注。溶栓治療、血栓抽吸以及心導管系統等是目前主要的再灌注治療方法[13]。其中,PCI術是最為高效、安全的再灌注治療手段。但PCI術中有微循環發生障礙的傾向,引起“無復流”、“慢血流”,影響術后血流的恢復以及心功能情況[14]。因此,怎樣采取有效的措施從而預防“無復流”、“慢血流”現象的發生已成為PCI術研究的關鍵問題。
無復流現象(no-reflow)或慢血流(Slow Re-flow)是指PCI時心外膜大冠狀動脈血管已解除狹窄,但遠端前向血流喪失(TIMI 0~1級,無復流)或明顯減慢(TIMI 2級,慢血流)導致心肌細胞灌注不能維持的一種現象,與患者的臨床情況、冠狀動脈病變特點和介入操作有關。臨床試驗提示每年PCI術后無復流和慢血流的發生率為5%~25%,而無復流或慢血流會導致左室重構(室壁瘤、心臟破裂)、惡性心律失常、心功能下降、心源性休克、主要心血管不良事件、晚期重復住院率、病死率增加[15],因此,正確認識無復流和慢血流的發生機制及防治策略至關重要。
無復流或慢血流的發病機制主要包括:(1)臨床因素:無復流的個體的臨床因素主要取決于個體的易患性,個體易患性可以是遺傳的,具有先天性,也可以是與遺傳以外的后天因素有關造成的。后天因素中的高血糖與PPCI術中微循環再灌注損傷相關,高膽固醇血癥動物模型可以通過增加內皮細胞的氧化應激加重再灌注損傷。(2)遠端栓塞:遠端栓塞可以在6%~15%的急性心肌梗死患者冠狀動脈造影中發現。在溶栓治療或行球囊擴張術后死亡患者中大約有81%于尸檢中發現微循環組織中存在有大量的血栓物質和動脈粥樣硬化碎屑。(3)缺血再灌注性損傷:心肌缺血后的再灌注誘導氧化應激與損傷的內皮血管擴張。長時間的心肌缺血在大量腺苷與次黃嘌呤核苷大量釋放后導致ATP的缺乏,通過一系列的反應導致一氧化氮(NO)的含量與生物效應的降低進而引起內皮依賴性血管舒張血管的損傷,同時并進一步導致微循環系統的小動脈阻力血管強烈收縮。通過血管內皮及血小板活性機制的相互影響,相互作用,共同導致了無復流現象。(4)壞死心肌水腫滲出壓迫微細毛細血管。
無復流現象易發生于急性心肌梗死行急診介入治療或溶栓治療、梗死后心絞痛、不穩定型心絞痛、心源性休克等。冠脈內有大的富含脂質的斑塊、高齡、高血糖、高膽固醇、代謝綜合征的患者,有較高的無復流發生率。梗死相關動脈再灌注期間發生無復流主要與缺血時間、缺血程 度和梗死面積及再灌注時間的長短有關。另外,嚴重狹窄、鈣化、潰瘍病變、長期病變等易發生無復流現象。
針對STEMI,早期臨床治療是以尿激酶溶栓為主,該藥屬于非特異性溶栓劑,直接作用于內源性纖維蛋白溶解系統,能催化裂解纖溶酶原成纖溶酶,后者不僅能降解纖維蛋白凝塊,亦能降解血循環中的纖維蛋白原、凝血因子Ⅴ和凝血因子Ⅷ等,從而發揮溶栓作用,臨床療效不甚理想,且出血風險較高。rh-proUK作為尿激酶的前體,主要作用部位為血栓的纖維蛋白,結合后使纖維蛋白部分溶解,暴露E-片段,經級聯放大效應,激活纖溶酶原,從而達到溶栓作用[15,16]。如今,rh-proUK已成為新一代的溶栓藥物,可有效減少STEMI患者PCI術中及術后“無復流”、“慢血流”的發生,是STEMI治療上的關鍵藥物。
本研究結果顯示,冠脈內經靶向灌注導管在IRA靶病變遠端給予rh-proUK,在術后血流恢復情況,心電圖,心肌壞死標志物,心功能改善情況等均優于指引導管給藥,且不增加MACE和出血事件發生率。可能原因是:經靶向灌注導管給藥,可快速充盈冠脈遠端,其產生的壓強與流速的物理效應可對血栓的遠端及微循環內的微血栓產生機械的高壓沖擊,具有一定的溶栓作用。同時,微循環局部藥物濃度較指引導管給藥增加數倍,且起效迅速,在進一步介入治療前,已對微循環障礙發生的可能因素發揮了作用。靶向應用藥物可進一步有效恢復冠脈血流,減小“無復流”、“慢血流”的發生率,改善心肌灌注和心功能,同時不增加MACE和出血事件發生率,有助于STEMI患者預后。
綜上所述,與指引導管給藥相比較,經靶向灌注導管(刺破球囊)給藥可進一步促進血流恢復,改善心肌再灌注,從而改善STEMI患者PCI術的溶栓效果及預后情況。但本研究樣本量較少,觀察時間較短,且為單中心研究,存在一定的局限性,有待在今后的研究中進一步豐富完善。

